刺桐叶过氧化物酶催化氧化内分泌干扰物双酚A的研究
赵广华,向运蓉,洪 健,肖 强
(湖北民族学院 林学园艺学院,湖北 恩施 445000)
刺桐叶过氧化物酶催化氧化内分泌干扰物双酚A的研究
赵广华,向运蓉,洪 健,肖 强*
(湖北民族学院 林学园艺学院,湖北 恩施 445000)
双酚A(BPA)是目前世界上使用最广泛的工业化合物之一,该酚类化合物是内分泌干扰物(Endocrine Disrupting Chemicals,EDCs)的重要成员之一; BPA对水生生物和人体细胞具有雌激素作用和生物学毒性.EDCs具有生物富集、效用持久以及生理学响应浓度极低等特性,使得其在水体中很难通过传统水处理技术去除.基于酶催化高效、反应条件温和等优点以及刺桐叶片中具有较高的过氧化物酶活性,为了开发其叶片经济价值,探讨刺桐叶片过氧化物酶在清除水体中EDCs中应用前景.考察了刺桐叶片过氧化物酶对水体中EDCs类物质BPA的去除效果及反应条件.结果表明,经过3 h,该酶对BPA清除达99.7%,最佳清除能力的pH范围为7~9,温度为25~50 ℃,最适酶活性单位为15 U/mL,最佳H2O2/BPA摩尔浓度之比为5.
过氧化物酶;刺桐;双酚A;内分泌干扰物
刺桐(Erythrinavariegata)是多年生落叶乔木,其树皮或根皮可入药,在医药方面应用较为广泛[1];刺桐树形美观、花色艳丽,可作为园林观赏植物.刺桐季相变化丰富,可以作为季节性指标.在刺桐整个生长期中,大量叶片凋落,未产生任何经济价值;目前关于刺桐叶片的研究,主要是关于其鲜叶汁用于镇静和止痛的研究[2].通过前期研究发现,刺桐叶过氧化物酶具有较高活性、稳定性较好等特点.
过氧化物酶(Peroxidase,POD)是一种以过氧化氢为电子受体的酶[3-4].POD是通过催化底物发生氧化反应改变结构,引起底物理化性质发生变化的生物催化剂,它广泛分布于生物体内[4].POD的反应具有反应条件温和、高效、专一的特点.其在植物细胞壁形成、生长激素失活、次生物质代谢以及防卫反应应答等多种生理过程中发挥重要作用.在现今已发表的论文中发现,POD对氯酚、甲氧基苯酚、卤代胺等物质的清除能力较强[5].此外,POD催化活性在工业上也用于石化、造纸、纺织等行业废水中酚类和芳香胺类污染物高效降解.国内外许多学者开展了辣根过氧化物酶(horseradish peroxidase,HRP)和大豆过氧化物酶(soybean peroxidase,SBP)用于酚类物质清除的条件优化、动力学特性和反应机理研究[6-7].展现了POD在去除环境水体中微量酚类污染物中的良好前景.
双酚A(Bisphenol A,BPA)是一种重要的化工原料,广泛应用于生活塑料制品、罐头食品及食品金属包装物表面涂层等的制造过程.BPA的广泛使用给环境和饮用水带来了严重污染.2001年,有研究者发现,德国饮用水BPA含量范围为 300pg/L~2 ng/L;2004年,对我国北京某典型污水厂的调查显示,城市污水中BPA含量最高可达825 μg/L[8].有研究表明[9],BPA属低毒性化学物;也是属于内分泌干扰物(Endocrine Disrupting Chemicals,EDCs)的一种,EDCs能产生内分泌干扰物效应,从而对动物和人类健康产生一些潜在的不利影响.有资料[10]显示BPA 具有一定的胚胎毒性和致畸性,可明显增加动物卵巢癌、前列腺癌、白血病等癌症的发生,科学家以中国化工厂里暴露于BPA 环境中工作5年以上的男性工人作为研究对象,5年之内没有暴露于BPA环境中的工人作为对照,研究结果表明,暴露于BPA环境中的男性工人发生勃起功能障碍的风险约为对照组的4倍,说明BPA对人体健康的危害比较大.
鉴于动物实验和人群流行病学调查研究结果,BPA对人体毒性已受到广泛关注.作为普遍使用的工业原料之一,BPA对环境水体污染已被诸多学者研究证实;如何对水体中BPA进行有效经济的清除就显得极其重要和迫切.目前对环境中BPA的消除主要采用生物降解、光催化的化学降解、物理吸附以及生物酶降解等方法,其中,POD催化的降解方法具有高效、反应条件温和等优点受到广泛关注.其中以HRP为代表的POD酶类已被证实可以有效去除芳香类化合物,如烷基酚、苯酚和BPA[6].
优化刺桐叶POD去除溶液中BPA的酶催化过程,也是为了降低使用POD处理废水的运营成本,探索新的具有较强清除能力的POD植物来源,优化反应条件,对于减少酶的要求具有重要价值.通过实验得出清除溶液中BPA的最佳H2O2/BPA摩尔浓度比值、pH、温度等的反应条件,为工业生产提供相应指导.
1 材料与方法
1.1 材料与试剂
以湖北民族学院植物园内种植的刺桐(Erythrinavariegata)成熟叶为原料.
1.2 实验方法
1.2.1 刺桐过氧化物粗酶液的提取 称取新鲜刺桐叶片5 g,自来水洗净后,用蒸馏水冲洗,再用吸水纸吸干表面水分,置于预冷的研钵中,分次加入8 mL含2%聚乙烯吡咯烷酮(PVP-K30)和2 mmol/L乙二胺四乙酸(EDTA)的磷酸缓冲液(50 mmol/L,pH 7.8)在冰浴上研磨成匀浆,转入离心管中,4 ℃、12 000 g条件下离心10 min,上清液即为粗酶提取液.
1.2.2 酶活性测定
1)反应混合液配制:取50 mL PBS缓冲液于烧杯中,加入28 μL愈创木酚于恒温式磁力搅拌器上加热搅拌,直至愈创木酚完全溶解.待溶液冷却后加入19 μL 30%的H2O2,搅拌混匀后保存于冰箱中备用.
2)酶活性测定:在分光光度计中,用时间扫描[11],以蒸馏水为对照调零后,取3 mL反应液并加入10 μL酶液后测定OD 470值在180 s内的变化,每间隔3 s记录一次,共记录60个数值,将测定结果导出,当其相关性达到0.999时,分析其斜率(k)值.
1.2.3 酶活力计算 以每分钟 OD值变化(升高)0.1为1个酶活性单位(U),按下式计算活性[12]:
POD活性=(ΔA470×Vt)/(W×Vs×0.1×t) (U/g)
ΔA470:为反应时间内吸光度的变化;W为样品鲜质量(g);t为反应时间(min);Vt为提取酶液总体积(mL);Vs为测定时取用酶液体积(mL).
2 结果与分析
2.1 最佳清除酶活性单位确定
在预试验中,取新鲜叶片清洗、研磨、多层纱布过滤、离心、测酶活,得粗酶液活性为312 U/mL.在随后的BPA清除实验中,加酶600 U(即取粗酶液1.923 mL),在 pH=6,H2O2/BPA为2的条件下,将反应混合物置25 ℃的恒温水浴磁力搅拌器中进行反应.分别在1、3、5、15、45、90、120和180 min取样,用甲醇和硫酸铝钾终止反应,测定BPA含量.采用UPLC-TOF-MS测定[13],结果显示在120 min时BPA被完全清除.
在实验过程中,尝试使用不同活性的POD进行实验,注意采用单一变量法控制其他变量一致,在此情况下,确定最佳反应酶活性单位为15 U/mL.
2.2 最佳清除pH确定

图1 不同pH对BPA清除率的影响Fig.1 Effects of different pH value on the removal rate of BPA
设定pH为 6、7、8、9、10、11、12和13,控制温度、酶活性、H2O2摩尔浓度相同,在此条件下,对清除速度,底物完全清除时间进行比较.在实验中,最初采用50 mmol/L的磷酸缓冲液,并将温度设定为25 ℃(在集热式恒温加热磁力搅拌器上操作),酶活性单位用15 U/mL,H2O2/BPA为2,分别测出pH为6、7、8、9、10、11、12、13时的反应情况,其中pH 6~8采用磷酸盐缓冲体系,pH 9采用硼酸盐缓冲液,得出结论为当pH等于7、8、9时,酶反应的活性均比较高,所以之后又用甘氨酸配置溶液,用NaOH滴定配置pH 10、pH 11、pH 12和pH 13的缓冲溶液,在之前的反应条件下测得相应pH值的酶反应体系的清除效果.

图2 不同温度对BPA清除的影响Fig.2 Effects of different temperature on the removal rate of BPA
图1为不同pH条件下,于1、3、5、15、45、90、120、180 min分别取样测定反应体系中剩余BPA含量结果.从图1中可以看出在pH 7~9时,90 min时BPA被完全清除,清除速率较其它pH条件更快.
2.3最佳清除温度确定
设定温度为25、30、35、40、50、60 ℃,分别在集热式恒温加热磁力搅拌器上操作,控制pH等于7、酶活性为15 U/mL、H2O2/BPA为2,反应时间3 h,在此反应体系中,对清除速度,底物完全清除时间进行比较,从图2可见,在25~50 ℃范围内,BPA清除率均达到100%.在25、30、40 ℃的温度条件下,分别反应3 h和6 h后,测得剩余酶活如下(200 μL 待测液+2 800 μL愈创木酚反应混合液).
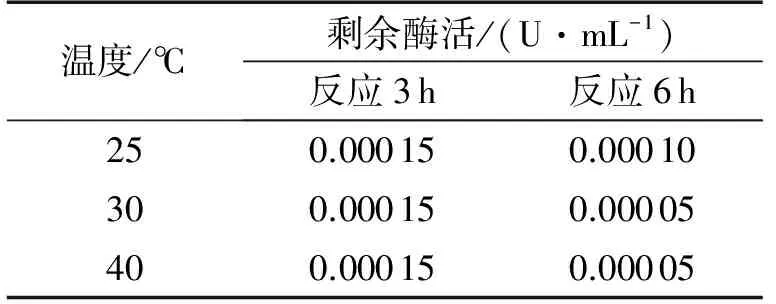
表1 反应3 h、6 h剩余酶活
表1表明,在温度为25 ℃的条件下,酶活的稳定性是最大的,而且其清除比率较高,在反应90 min时就完全清除,所以,将对BPA的最佳清除温度确定为25 ℃.
2.4 最佳清除H2O2/BPA比值确定
研究H2O2/BPA摩尔浓度之比因素时,设定比值分别为0.2、0.5、0.8、1.2、2、3、5倍,控制温度、酶活性、pH相同,在此条件下,对清除速度,底物完全清除时间进行比较.

图3 不同H2O2/BPA比值对BPA的清除影响Fig.3 Effects of mole ratio of H2O2 to BPA on the removal rate of BPA
将温度设定为25 ℃(在集热式恒温加热磁力搅拌器上操作),酶活性单位用15 U/mL,pH为7,分别测出当H2O2比值分别为0.2、0.5、0.8、1.2、2、3、5倍时的清除效果,如图3所示,当H2O2比值为5倍时,45 min时,BPA被完全清除,故得出较好的清除BPA的H2O2/BPA比值为5.
3 讨论
经过三个多月的实验和数据处理,提取新鲜刺桐叶片中POD与BPA反应,探索最佳的反应条件,得出最适刺桐叶POD活性单位为15 U/mL,最佳pH范围为7~9,适宜温度范围为25~50 ℃,但在25 ℃酶活性最稳定,所以确定的最适反应温度为25 ℃,此外,H2O2/BPA摩尔浓度之比最适为5.
对于内分泌干扰物的相关清除实验中,国内外已经有许多学者探讨了不同来源的POD清除酚类和胺类物质的性质.在徐芝勇[14]对SBP的研究中,实验结果表明,以愈创木酚为底物的条件下,最佳反应的pH范围在5.0~5.2;在冯义平等[5]关于POD催化去除水中酚类内分泌干扰物的研究进展一文中,发现HRP可以在pH为5.0、7.0、8.0的条件下迅速的清除BPA;这与本实验中刺桐过氧化物酶对BPA的清除最佳pH值相近,所以可以看出,本次实验结论与前面相关实验结论相近,在工业上具有实际生产的价值.
此外,在冯义平等的酚类物质清除实验中,HRP对BPA的最佳清除温度为20 ℃,催化的速度与HRP的剂量有极大关系;而本实验确定最适反应温度为25 ℃,与前面的研究结果相近.所以不难看出,在温度适宜时,不同来源的POD对内分泌干扰物BPA的清除效果明显,有利于工业生产,本实验中最佳反应温度为接近常温的25 ℃,在运用中可以于室温条件下进行,有利于降低运行成本.
适宜含量的H2O2在实验中起到氧化底物的作用,有H2O2存在的情况下,POD能催化酚类物质反应产生茶褐色物质,当含量低于最适H2O2时,适当的增加H2O2,实验速度会明显改善,当高于最适H2O2时,会抑制反应的进行.之前的学者也探讨了H2O2对反应的影响.HRP与激素类物质反应实验中[6],最适的H2O2/BPA摩尔浓度之比为2,而本实验中最适的H2O2/BPA摩尔浓度之比为5.表明在不同的反应中,对过氧化氢的需求有一定差异,所以在实验中要严格的控制H2O2的剂量,以防把握不当,影响反应进行.
之前的学者在类似的实验中探讨了HRP与H2O2对BPA的清除效果.冯义平等[5]的实验结果表明,该反应的最适pH值为6.0,反应最佳温度为30 ℃,最佳的H2O2/BPA值为2,经过120 min的降解,0.5 U/mL的HRP对BPA的清除效果最好.Duarte-Va’zquez等[15]关于TP对酚类物质的降解效果,实验结果表明,在温度为25 ℃,pH为4~8,H2O2/BPA浓度之比为2的条件下,经过3 h的反应,1.28 U/L的TP对0.5 mmol/L的酚类物质清除率可达到85%以上.这些实验结论与本实验的结果相近,表明刺桐叶过氧化物酶也具有工业化运用的良好基础.
由于BPA在现今社会,尤其是在工业生产上运用相当的广泛,其毒性已被科学研究证实[9].与男性功能、小白鼠患哮喘相关联,在流行病学调查中显示孕妇在妊娠早期受BPA影响可能会导致婴儿哮喘.BPA还是一种内分泌干扰物的重要成分,在多种水体中广泛存在,在生物富集性、持久性方面对生物的影响较大,所以对BPA的清除比较迫切.
对酶的失活而言,酶失活是工业运用中比较常见的困扰,是限制工业运用的主要因素之一,同时也是不可避免的,所以,探索酶失活的原因及相应处理措施是刻不容缓的.需要经过仔细的研究和分析探索,对其失活进行防治,将成本降到最低,将效果提到最佳.在本实验中,刺桐叶POD失活的原因之一是,酶与BPA反应产生大分子的聚合物,聚合物的溶解性比较的低,所以会吸附到刺桐叶过氧化物酶的表面,影响酶与底物的接触面积.使得底物与酶的接触位点减少,使酶渐渐失活[16].在酶反应的过程中,对失活的防止可以外加一些辅助物质,以此延长酶的反应周期.比如一定量的凝胶、聚乙二醇(PEG)等物[17].此外,高亲水性的明胶也可以有效的增长酶反应的时间,达到提高效率的作用.
目前,对于刺桐叶POD的清除效果研究未见报道,而以刺桐作为实验材料简便易行,容易获得,清除效果也比较明显,所以本研究对于解决时下含有机污染物废水的处理和达标排放具有显著意义.
本研究对于今后选用有开发价值的材料及方法具有指导意义,对高效经济的酶的筛选具有明显价值,目前,利用酶的氧化催化作用对酚类的处理是近年来受到广泛关注的新方法,但本研究与现实应用还有一定距离,下一步将致力于探索相关反应的工作机理,探索该工艺在实际污水处理中的应用,充分发掘刺桐叶POD的应用价值.
[1] 冯媛媛,姜卫兵,魏家星.论刺桐属树种的园林特性及其应用[J].湖南农业科学,2014(20): 69-72.
[2] RATNASOORIYA W D,DHARMASIRI M G.Aqueous extract of sri lankan erythrina indica leaves has sedative but not analgesic activity[J].Fitoterapia,1999,70(3):311-313.
[3] PAUL K G.Historical background.In molecular and physiological aspects of plant peroxidases(greppin h,penel c,gaspar t,eds)[M].Switzerland: University of Geneva,1986:1-14.
[4] 田国忠,李怀方,裘维蕃.植物过氧化物酶研究进展[J].植物科学学报,2001,19(4):332-344.
[5] 冯义平,毛亮,董仕鹏,等.过氧化物酶催化去除水体中酚类内分泌干扰物的研究进展[J].环境化学,2013(7):1218-1225.
[6] 李洪枚.辣根过氧化物酶催化氧化17β-雌二醇的研究[J].安徽农业科学,2010,38(23):12314-12316.
[7] BASSI A,GENG Z,GIJZEN M.Enzymatic removal of phenol and chlorophenols using soybean seed hulls [J].Engineering in Life Sciences,2004,4(2):125-130.
[8] 杜兵,张彭义,张祖麟,等.北京市某典型污水处理厂中内分泌干扰物的初步调查[J].环境科学,2004,25(1):114-116.
[9] 张彦丽,任佳丽,李忠海,等.食品包装材料中双酚a的研究进展[J].食品与机械,2011,27(1):155-157.
[10] 邓茂先,吴德生,詹立.环境雌激素双酚a的生殖毒理研究[J].环境与健康杂志,2001,18(3):134-136.
[11] AMAKO KATSUMI,CHEN GONG XIANG,ASADA KOZI.Separate assays specific for ascorbate peroxidase and guaiacol peroxidase and for the chloroplastic and cytosolic isozymes of ascorbate peroxidase in plants[J].Plant amp; Cell Physiology,1994,35(3):497-504.
[12] 彭方林,王丽,穆春,等.萝卜过氧化物酶基因rsprx1对其抗氧化能力的影响[J].贵州农业科学,2014(9):40-42.
[13] 阮国洪.水中苯酚、苯二酚和苯三酚的高效液相色谱分析方法的研究[J].环境与健康杂志,2002,19(1):64-65.
[14] 徐芝勇.大豆过氧化物酶的酶学特性与应用研究[D].杭州:浙江大学,2006.
[15] DUARTE-VZQUEZ MIGUEL A,ORTEGA-TOVAR MNICA A,GARCíA-ALMENDAREZ BLANCA E,et al.Removal of aqueous phenolic compounds from a model system by oxidative polymerization with turnip(brassicanapuslvar purple top white globe) peroxidase [J].Journal of Chemical Technology amp; Biotechnology,2003,78(1):42-47.
[16] ZAZOULI MOHAMMAD ALI,TAGHAVI MAHMOUD.Phenol removal from aqueous solutions by electrocoagulation technology using iron electrodes:Effect of some variables[J].Journal of Water Resource amp; Protection,2012,11(4):980-983.
[17] ATOR M A,PR ORTIZ DE MONTELLANO.Protein control of prosthetic heme reactivity,Reaction of substrates with the heme edge of horseradish peroxidase[J].The Journal of biological chemistry,1987,262(4):1542-51.
责任编辑:高山
RemovalofEndocrineDisruptorsBPAbyErythrinavariegataLeavesPeroxidase
ZHAO Guanghua,XIANG Yunrong,HONG Jian,XIAO Qiang*
(School of Forestry and Horticulture,Hubei University for Nationalities,Enshi 445000,China)
Currently,BPA is one of the most widely used industrial compounds,and the phenolic compounds are one of the important members of endocrine disruptors(Endocrine Disrupting Chemicals,namely EDCs).A series of studies have shown that BPA has estrogen effect and biological toxicity to aquatic organisms and human cells.As EDCs have characteristics of bioaccumulation,utility lasting and extremely low physiological response and so on,the conventional technology of water treatment is very difficult to sweep away the EDCs.Based on the advantages of enzyme catalyzed in high efficiency,moderate reaction conditions and the higher peroxidase activity in the leaves,in order to develop the leaf economic value,this study investigated the application prospect of the peroxidase in the leaves ofErythrinavariegatain the removal of water.We surveyed the removal effect and reaction conditions of BPA byErythrinavariegataleaves peroxidase in the water.The results showed that the removal efficiency of BPA catalysed byErythrinavariegataleaves peroxidase was 99.7% after three hours,and the best pH range of removal ability was 7~9,the temperature of 25~50℃,the optimum substrate concentration was 15 U/mL,and the best ratio of the molar concentration of H2O2/BPA was 5.
Peroxidase;Erythrinavariegata;Bisphenol A;EDCs
2017-05-25.
国家自然科学基金项目(31260057;31460203).
赵广华(1992-),男,硕士生,主要从事水土保持与荒漠化防治的研究;*
:肖强(1970-),男,博士,教授,主要从事植物生理生态的研究.
1008-8423(2017)04-0366-04
10.13501/j.cnki.42-1569/n.2017.12.002
Q554.6
A

