人肝癌细胞Hep⁃G2的冷冻干燥保存初探
宋萍 李维杰 周新丽 刘宝林
(上海理工大学医疗器械与食品学院 上海 200093)
人肝癌细胞Hep⁃G2的冷冻干燥保存初探
宋萍 李维杰 周新丽 刘宝林
(上海理工大学医疗器械与食品学院 上海 200093)
冷冻干燥是长期有效保存细胞的手段之一。本文以肝癌细胞Hep⁃G2为研究对象,选取了不同体积分数的Me2SO、丙三醇及不同质量浓度的PVP、复方保护剂进行冷冻干燥保存,筛选出最佳保护剂配方。此外,将细胞在不同摩尔浓度的海藻糖溶液中孵育,通过检测细胞回收率、存活率和24 h贴壁率,探究胞内海藻糖对细胞冷冻干燥的影响。结果表明:添加40%PVP(w/v)+10%甘油(v/v) +15%FBS(v/v) +20%海藻糖(w/v)保护剂的细胞,在复水后回收率、存活率和 24 h贴壁率分别为29.58%、42.18%和18.71%,与对照组相比三项指标均得到有效提高,该种保护剂的效果最佳;当胞外海藻糖摩尔浓度为800 mmol/L时,冻干效果最好,肝癌细胞Hep⁃G2在复水后回收率、存活率和24 h贴壁率分别为27.81%,66.65%和33.68%,存活率和贴壁率显著高于其他组。
冷冻干燥;冻干保护剂;细胞;存活率
长期有效的保存细胞在医学、生物学等领域具有重要意义,并一直受到广泛关注。目前常用的方法是低温保存,但该种手段液氮耗费多,对设备要求高,运输过程还可能因为震荡而造成细胞破损,维护及保存条件也较为苛刻。且在低温保存期间,细胞活力、免疫力等均有不同程度的下降,对研究样本有一定的损伤。而细胞的真空冷冻干燥是先将细胞进行低温冻结,再通过降压直接将冰晶除去,从而达到干燥细胞的目的。相比于细胞的低温保存,真空冷冻干燥有显著优势:去除样品中90%以上的水分,使样品可以长期保存;避免微生物的滋长;质量轻便,大大降低了运输保存的难度;冻干后的样品形态外观基本没有改变,极大的保存了细胞原有的活性和特性等。所以,利用冻干的方法保存细胞也受到了研究者的极大关注。肝癌细胞Hep⁃G2不但可以连续传代不断增殖,而且具有肝细胞的各种特异性功能以及体细胞的基本特征,实现冷冻干燥,对冻干保护剂配方选择以及机理上的认知提供了一定的参考,更有利于今后拓展其他体细胞的冻干保存。
对于人体细胞冻干,目前报道较多的为人血液细胞、组织细胞的冻干。 I.Bakaltcheva等[1]尝试对红细胞冻干后,血红蛋白恢复率高达95%。科学家在保护剂的选择上发现,海藻糖对细胞膜和蛋白质有着很好的抗逆保护作用[2-3]。 G.R.Satpathy 等[4]成功将海藻糖载入到红细胞内,且冻干后红细胞的恢复率达到40%。对于人血小板的研究,早在1956年就开始进行尝试,但效果并不理想[5]。W.F.Wolkers等[6]实验发现,海藻糖可以通过内吞作用进入到血小板内。Zhang Shaozhi等[7]提出超声波可以强化海藻糖进入血小板中,范菊莉等[8]使用超声波对冻干血小板做预处理,达到了强化海藻糖负载入血小板中的效果,进一步为冻干血小板提供了参考。由于脐带血中含有大量的造血干细胞,肖洪海等[9]首次实现了人脐带全血和单核细胞冻干的研究。1953年,Stocker发现,角膜内皮细胞是维持角膜透明的基础,成功保存角膜内皮细胞成为了研究热点。杨宏伟等[10]通过光镜、电镜酶组织化学方法探讨了冻干角膜内皮细胞的有效性,推测该方法有望成为角膜长期保存的新手段。
在生物样品冻干的过程中,常常需要添加冻干保护剂。糖类,尤其是海藻糖,因其自身特殊的结构,可以在冻干过程中有效保护细胞内部结构不受破坏,保持生物膜的完整性而成为生物制品冻干中常用的保护剂之一[11]。聚乙烯吡咯烷酮(PVP)是一种非渗透冻干保护剂,因可以提高溶液的黏度,显著提高溶液的玻璃化程度而被广泛应用[12];胎牛血清(FBS)中含有大量细胞生长所需的营养物质[13],可以在复水过程中大大提高细胞存活率,因此受到研究者们的青睐;甘油作为渗透性保护剂,可以进入胞内而提供良好的保护效果[14-15],也是近年来冻干保护剂选择的热点;而低体积分数的二甲基亚砜(Me2SO)更是在冻结过程中对细胞起到巨大的保护作用[16]。
因此,本文以肝癌细胞Hep⁃G2为对象,初步探索肝癌细胞Hep⁃G2的真空冷冻干燥,选取了海藻糖、PVP、FBS、甘油及Me2SO作为保护剂,探讨不同种类和不同质量浓度或体积浓度的保护剂效果,寻找合适的冻干保护剂配比,同时,将细胞置于不同摩尔浓度的海藻糖溶液中,以肝癌细胞复水后的回收率、存活率及24 h贴壁率为指标,探讨胞内海藻糖对冻干肝癌细胞的影响,为今后冻干其他细胞提供一定的参考。
1 材料与方法
1.1 材料与试剂
实验材料:人肝癌细胞Hep⁃G2(购于中科院)。
主要试剂:胎牛血清(FBS)和胰蛋白酶(赛默飞世尔生物化学制品有限公司);Dulbecco’s Modified Eagle Medium (DMEM)培养基(GIBCO公司);二甲基亚砜(Me2SO)(德国APPLICHEM公司);台盼蓝染色液(2X)(碧云天生物技术公司);等渗磷酸盐缓冲液(PBS,PH 7.4)、聚乙烯吡咯烷酮(PVP)、海藻糖、甘油(国药集团化学试剂有限公司)、青霉素和链霉素(华北制药)。
1.2 仪器与设备
真空冷冻干燥机,Advantage 2.0 Benchtop Freeze Dryer(美国SP Industries公司);二氧化碳培养箱(上海博讯实业有限公司);低速台式离心机(上海安亭科学仪器厂);Countess II FL细胞计数仪(赛默飞世尔科技有限公司);低温台(BCS196 Biological Cyro⁃stage);BX51TRF 显微镜(Olympus,日本)。
1.3 实验方法
1.3.1 肝癌细胞的获取
从二氧化碳培养箱中取出细胞培养皿,吸掉培养皿中的培养基(10%胎牛血清 +1%双抗 +89%DMEM 培养基),每个皿都加入 2 mL D⁃Hank′s,清洗2遍,接着用0.5 mL胰酶进行消化1~2 min后,当在显微镜下观察细胞呈圆粒状并较均匀的分布在培养皿中时,每个皿加入2 mL DMEM培养基终止消化,并将所有细胞吸入到同一离心管中,转速为1 00 0 r/min,离心 5 min,倒去上清液。
将肝癌细胞 Hep⁃G2用等渗 PBS溶液离心(1 000 r/min,离心 5 min)、洗涤 3 遍,收集肝癌细胞备用。
1.3.2 冻干保护剂配方优化
实验分组:保护剂基础液均为DMEM,将保护剂分为12组,根据保护剂不同种类又分为5组,第一组序号为0,是对照组,保护剂组成为15%FBS+20%海藻糖;第二组序号为1~3,是Me2SO组;第三组序号为4~8,是PVP组;第四组序号为9~10,是甘油组;第五组序号为11,是根据第1~4大组实验的结果选出的配方,为复方保护剂组。将备用的肝癌细胞分装1 mL到12个1.5 mL的离心管中,保证每个样品中有足够量的细胞,离心(1 600 r/min,离心 4 min),去掉上清液,分别加入以下冻干保护剂,低温显微镜观察,均以10℃/min从室温降到-80℃,平衡10 min,再以20℃/min升温到30℃。
将每组保护剂按4∶1的比例加入到细胞中进行冻干,最终冻干测定复水后肝癌细胞的回收率、存活率和24 h贴壁率,进行三组平行实验。

表1 保护剂分组Tab.1 The group of freeze⁃drying protectants
1.3.3 肝癌细胞 Hep⁃G2 的冻干与复水
冻干:将细胞与保护剂以1∶4的体积比配制成冻干细胞混合液。取1 mL配好的冻干细胞混合液加入到容积为5 mL的西林瓶中并计数,放入冻干机中进行冻干,每次实验共设三组平行。预冻速率大概为10 K/min,预冻温度为-65℃,时间2 h,保证样品全部冻结;接着进行一次干燥,样品温度保持-45℃,持续24 h,压力为5 Pa;二次干燥样品温度为20℃,时间10 h,压力为5 Pa。冻干完成后,样品密封保存。
复水:复水液的配制将PVP溶于PBS缓冲液中,PVP终质量浓度(w/v)为10%。在37℃水浴下,将2 mL复水液加入到冻干样品中,轻轻振动,直到样品完全溶解,取样再对其进行细胞计数[17]。
1.3.4 胞内海藻糖的载入、提取与测定
胞内海藻糖的载入:用双蒸水配制400、600、800、1 000 mmol/L四种不同摩尔浓度的海藻糖溶液。将肝癌细胞置于四种不同摩尔浓度的海藻糖溶液中,并在37℃,5%CO2的培养箱中孵育7 h[4]。经孵育之后的肝癌细胞,于1 200 r/min离心5 min,去除上清液,用等渗的PBS缓冲液洗涤,反复3次,用细胞计数仪计数,并计算平均体积。
胞内海藻糖的提取:为防止提取液中其他组分的影响,加三倍体积的10%三氯乙酸于细胞悬浮液中,常温下抽提细胞内海藻糖3次[18],收集三次的抽提液,可以获得较为单一的含海藻糖组分。
胞内海藻糖的测定:采用硫酸⁃蒽酮法测定各萃取液中海藻糖质量浓度[19]。
1.3.5 负载海藻糖的细胞冻干及回收率、存活率和24 h贴壁率检测
冻干保护剂为前期实验筛选出来的最佳保护剂:基础液为 DMEM,组分为 40%PVP(w/v) +15%FBS(v/v) +20%海藻糖(w/v) +10%丙三醇(v/v)。 随后进行冻干。冻干结束后,在3 7℃水浴下进行复水,再取样进行回收率、存活率及24 h贴壁率的检测。
冻干细胞回收率[20]检测:

存活率检测[21]:采用台酚蓝染色法,取 20 μL 0.4%台酚蓝溶液和20 μL复水后细胞悬浮液,混匀,

滴加在细胞计数板上,在3 min内,插入细胞计数仪中计数。按以下公式计算存活率:24 h贴壁率检测:复水后的细胞,加入2 mL DMEM,于 1 200 r/min,离心 10 min,弃上清液,加 4 mL DMEM接种到培养皿中,放入37℃、5%CO2培养箱中培养,24 h换液后,将培养皿中培养液吸入到离心管中,计数未贴壁细胞。接着用胰酶消化后加2 mL DMEM,计数贴壁细胞。计算公式如下:

1.3.6 数据分析
用SPSS Statistics软件进行统计分析,所有实验数据均采用平均值±标准差的形式。
2 结果与分析
2.1 保护剂配方的优化
2.1.1 Me2SO组细胞回收率、存活率和24 h贴壁率
对照组、添加 Me2SO体积分数(v/v)为 5%、10%、15%的保护剂组细胞复水后的回收率、存活率和24 h贴壁率结果见表2。文中采用Duncan法进行多重比较,表格中同列标有相同字母的表示相互没有显著区别(P>0.05),没有相同字母表示互相有显著区别(P<0.05)。
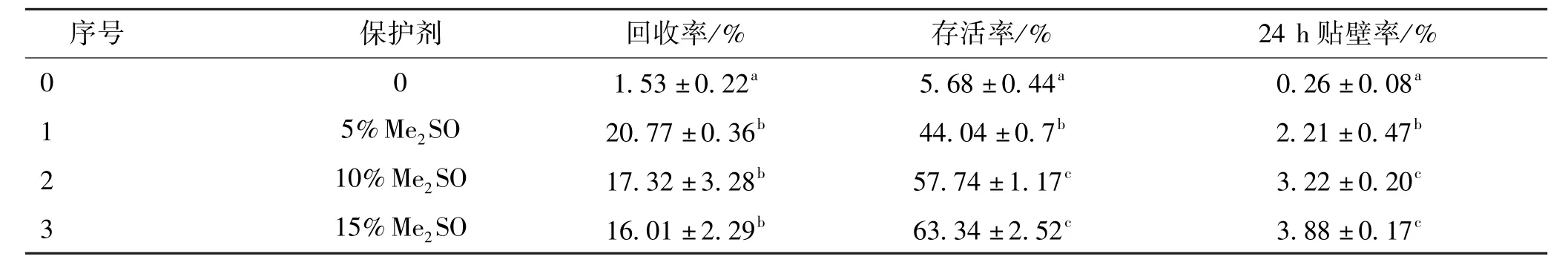
表2 添加不同体积分数Me2SO保护剂细胞冻干复水后的回收率、存活率和24 h贴壁率Tab.2 Recovery rate,survival rate,and 24 h adherent rate after the recovery of freeze⁃dried cell with Me2SO
由表2可知,添加Me2SO保护剂组细胞冻干的回收率、存活率和24 h贴壁率均与对照组有显著差异(P<0.05),这表明添加体积分数为5% ~15%Me2SO保护剂对冻干肝癌细胞有一定的保护作用。添加了5% ~15%Me2SO后,回收率并没有显著差异,但10%Me2SO和15%Me2SO组的存活率及24 h贴壁率要显著高于5%Me2SO组。而10%Me2SO和15%Me2SO组的回收率、存活率和24 h贴壁率均无显著差异(P>0.05)。 这表明 10%Me2SO和 15%Me2SO组的保护效果优于5%Me2SO组,且两者保护效果相近。
2.1.2 PVP组的细胞回收率、存活率和24 h贴壁率
对照组、添加 PVP质量浓度(w/v)为 20%、30%、40%、50%、60%的保护剂组细胞复水后的回收率、存活率和24 h贴壁率结果见图1。
添加不同质量浓度PVP保护剂的肝癌细胞Hep⁃G2冻干复水后,测定其回收率、存活率和24 h贴壁率(图1)。由图1可知,PVP对肝癌细胞的冻干过程有明显的保护作用,其作用效果随着质量浓度的增大而先增高后降低。当PVP质量浓度为20%时,肝癌细胞回收率、存活率和24 h贴壁率明显高于对照组,当PVP质量浓度增大为40%时,肝癌细胞回收率、存活率和24 h贴壁率都达到了峰值,此后,随着PVP质量浓度增大,回收率、存活率和24 h贴壁率都有着不同程度的下降,表明40%PVP质量浓度的保护剂冻干效果最佳,能产生较好的保护作用。

图1 添加不同质量浓度PVP保护剂细胞冻干复水后的回收率、存活率和24 h贴壁率Fig.1 Recovery rate,survival rate,and 24 h adherent rate after the recovery of freeze⁃dried cell with PVP
2.1.3 甘油组的细胞回收率、存活率和24 h贴壁率
对照组、添加丙三醇体积分数(v/v)为 10%、20%的保护剂组细胞复水后的回收率、存活率和24 h贴壁率结果见表3。

表3 添加不同体积分数甘油保护剂细胞冻干复水后的回收率、存活率和24 h贴壁率Tab.3 Recovery rate,survival rate,and 24 h adherent rate after the recovery of freeze⁃dried cell with glycerol
由表3可知,添加了体积分数为(v/v)10% ~20%甘油的保护剂与对照组在回收率、存活率和24 h贴壁率上差异均有显著性(P<0.05),表明添加10%~20%甘油的保护剂对肝癌细胞冻干存在积极作用。10%甘油组的细胞存活率与20%甘油组没有显著差异(P>0.05),但两者的24 h贴壁率却有显著差异(P<0.05),说明10%甘油组的冻干效果要优于20%甘油组。
2.1.4 复方保护剂组的细胞回收率、存活率和24 h贴壁率
由于Me2SO的冻干效果不佳,因此以下结果均不再进行比较。挑选前三组最优保护剂,进行复方保护剂组实验,并比较它们的回收率、存活率和24 h贴 壁率。

表4 添加不同保护剂细胞冻干复水后的回收率、存活率和24 h贴壁率Tab.4 Recovery rate,survival rate,and 24 h adherent rate after the recovery of freeze⁃dried cell with different protectant
由表4可知,添加了保护剂的细胞冻干复水后与对照组在回收率、存活率和24 h贴壁率上差异均有显著性(P<0.05),说明冻干保护剂的添加对肝癌细胞冻干有明显的保护作用。10%甘油组在回收率、存活率和24 h贴壁率上都要低于其他两组(序号6和序号11),说明甘油在冻干过程中的保护效果最差。40%PVP组与复方保护剂组的存活率高于复方保护剂组,但复方保护剂组的贴壁率明显高于40%PVP组,这表明虽然40%PVP的保护剂可以大大提高冻干复水后细胞的存活率,但多数细胞已失去其贴壁能力,而复方保护剂能较好维持肝癌细胞的基本功能。综上所述,复方保护剂在冻干肝癌细胞过程中保护效果最好。
2.2 孵育载入肝癌细胞海藻糖的摩尔浓度
采用硫酸蒽酮法测定海藻糖摩尔浓度,其中萃取液的质量浓度与胞内摩尔浓度成正比关系[22],因此,萃取液的质量浓度也可以反映胞内海藻糖摩尔浓度的大小。当细胞放在等渗的海藻糖溶液中时,胞内几乎没有负载海藻糖。所以,该实验选择了一系列高渗溶液:400、600、800、1 000 mmol/L 海藻糖溶液作为负载液。图2所示为不同摩尔浓度胞外海藻糖对肝癌细胞的影响。在37℃条件下,通过孵育的方式,萃取液海藻糖摩尔浓度呈现先增高后降低的趋势。当胞外摩尔浓度在400~600 mmol/L区间时,以相对较快的速率增加对海藻糖的摄取量,海藻糖摩尔浓度明显加大;当胞外摩尔浓度在600~800 mmol/L范围时,萃取液海藻糖摩尔浓度增加趋势减缓,此时可能细胞吸取的海藻糖摩尔浓度达到饱和;当胞外摩尔浓度为1 000 mmol/L时,细胞对海藻糖的摄取量减小,可能是过高摩尔浓度的胞外环境提供了水从胞内向胞外流动的推动力,从而形成了细胞膜内外的渗透梯度,对细胞造成了一定的渗透损伤[23]。

图2 不同摩尔浓度胞外海藻糖对肝癌细胞的影响Fig.2 The effect of extracellular trehalose at various molar concentrations on Hepatoma Hep⁃G2 cells

表5 胞外不同摩尔浓度海藻糖载入肝癌细胞后冻干的回收率、存活率和24 h贴壁率Tab.5 Recovery rate,survival rate,and 24 h adherent rate after the recovery of freeze⁃dried cell in extracellular trehalose at various molar concentrations
2.3 冻干肝癌细胞的回收率、存活率和24 h存活率
将肝癌细胞放置在不同摩尔浓度海藻糖溶液中,通过热孵育载入细胞内后进行冻干,测得的回收率、存活率和24 h贴壁率如表5所示。
由表5可知,当胞外摩尔浓度为400 mmol/L时,回收率、存活率和24 h贴壁率均与对照组无明显差异,可能由于进入细胞的海藻糖摩尔浓度不足以对细胞提供保护作用[24]。当胞外摩尔浓度为600 mmol/L时,回收率要明显高于对照组,但存活率和24 h贴壁率并没有显著差异(P>0.05)。当胞外摩尔浓度为800 mmol/L时,存活率和24 h贴壁率均大大高于其他组(P<0.05),说明该组具有活性的细胞明显多于对照组。当胞外海藻糖摩尔浓度为1 000 mmol/L时,肝癌细胞冻干的回收率、存活率和24 h贴壁率差异均有显著性(P<0.05),明显低于其他组。
综上所述,当胞外海藻糖摩尔浓度为400 mmol/L或 600 mmol/L 时,肝癌细胞冻干效果与不添加海藻糖组基本无变化;当胞外海藻糖摩尔浓度为800 mmol/L时,与对照组相比,冻干效果有显著差异(P<0.05),冻干效果最好;当胞外摩尔浓度为1 000 mmol/L时,冻干效果低于对照组。
3 讨论
肝脏是人体代谢的重要器官,但由于人肝脏细胞在生理条件下获取困难、个体差别大、传代培养不易,而肝癌细胞Hep⁃G2培养传代较为容易,且有正常肝细胞的很多功能以及体细胞的基本特征[25],因此,本研究以肝癌细胞Hep⁃G2为模型,探索肝癌细胞的真空冷冻干燥以及海藻糖对肝癌细胞冻干的影响。
保护剂在生物制品冻干过程中是不可或缺的,二甲基亚砜(Me2SO)为常见的低温保护剂,添加Me2SO后冻存,可以降低溶液的冰点,减少胞内冰的形成,从而有效地减少了由冰晶带来的机械损伤[26]。真空冷冻干燥细胞前的预冻过程,为了减小细胞的冷冻损伤,因此选择加入一定体积分数的Me2SO作为保护剂。杨波等[27]在冻存人肝细胞实验中,添加体积分数(v/v)为 10%Me2SO作为保护剂,贴壁率高达81.05%。 Han Ying等[28]在研究红细胞冻干保存实验中,将Me2SO、PVP等加入保护剂配方中,发现有积极的冻干效果,细胞和血红蛋白复水后的恢复率达到80%以上。本研究发现,加入Me2SO的保护剂对细胞冻干虽然产生了积极保护作用,但保护效果并不理想,这可能是由于Me2SO体积分数过高不利于干燥过程的进行。
权国波等[29]发现随着PVP质量浓度的增高,体系的结晶起始点随之降低,玻璃化程度增高,有利于整个体系度过危险温区,从而减少细胞在冻干过程中受到的机械损伤。但随着PVP质量浓度的进一步升高,游离血红蛋白质量浓度只有0.5 g/L左右,表明过高质量浓度的PVP并不利于冻干。本研究中,当PVP质量浓度达到40%时,细胞的回收率、存活率和24 h贴壁率显著提高,但当PVP质量浓度增大为50%时,细胞的回收率、存活率和24 h贴壁率均有不同程度的下降,和权国波等[29]的结论一致。这可能是由于对细胞造成了较高的渗透压以及PVP的亲水性质的影响[30]。
甘油由于可以渗透到细胞内部提供良好的保护作用,因而一直被广泛应用于细胞的冻存中,体积分数20%(v/v)的甘油可以在冻存肝癌细胞中取得较理想的效果[31]。本研究亦发现,与对照组相比,加入了体积分数(v/v)为10%、20%甘油的保护剂与可以使细胞回收率、存活率和24 h贴壁率均显著提高。其中,体积分数(v/v)为10%甘油的保护效果较好。
在细胞冻干过程中,糖类往往与大分子聚合物一起作为保护剂,为细胞膜提供优良的保护作用,尤其是海藻糖[32]。 B.Stokich 等[33]在分子层面研究了海藻糖对肝癌细胞分子层的影响,当海藻糖加入到低温保护剂中时,会改变冰晶形成特征。Han Ying等[28]配比了质量浓度(w/v)为0% ~15%的海藻糖保护剂,冻干红细胞后发现,血红蛋白和红细胞的恢复率与对照组并没有显著差异,因此,得出结论:胞外海藻糖在冻干过程中并没有起到保护作用。但是否海藻糖必须进入胞内才能提供膜的保护作用,很多学者对于胞内海藻糖的保护效果进行了研究。T.Chen等[34]利用基因重组成的通道将海藻糖引入胞内,使细胞在复水后质膜的恢复率高达90%。何晖等[35]通过孵育的方法将海藻糖载入胞内,细胞回收率最高达到51.8%。本研究中,将肝癌细胞置于不同摩尔浓度的海藻糖溶液中孵育7 h后冻干,当胞外海藻糖摩尔浓度为800 mmol/L时,与对照组相比,细胞存活率和24 h贴壁率差异显著(P<0.05),冻干效果最佳。
4 结论
采用真空冷冻干燥的方法保存肝癌细胞Hep⁃G2,选择不同体积分数的Me2SO、甘油及不同质量分数的PVP、复方保护剂筛选出最优保护剂配方,并通过测定细胞回收率、存活率和24 h贴壁率来探究海藻糖对肝癌细胞冻干的影响。结果表明:添加40%PVP(w/v) +10%甘油(v/v) +15%FBS(v/v) +20%海藻糖(w/v)的保护剂的细胞,在复水后回收率、存活率和 24 h 贴壁率分别为 29.58%,42.18% 和18.71%,与对照组差异显著,对细胞保护效果最佳;当胞外海藻糖摩尔浓度为800 mmol/L时,冻干效果最好,肝癌细胞Hep⁃G2在复水后回收率、存活率和24 h 贴壁率分别为 27.81%,66.65% 和 33.68%,存活率和贴壁率显著高于其他组。该结论对冻干肝癌细胞Hep⁃G2的可能性提供了初步证明,对其他体细胞的冻干工艺也具有一定的借鉴价值。
[1]BAKALTCHEVA I,LESLIE S,MACDONALD V,et al.Reversible cross⁃linking and CO treatment as an approach in red cell stabilization[J].Cryobiology,2000,40(4):343⁃359.
[2]BIEGANSKI R M,FOWLER A,MORGAN J R,et al.Stabilization of active recombinant retroviruses in an amor⁃phous dry state with trehalose[J].Biotechnology Progress,1998,14(4):615⁃620.
[3]CERRUTTI P,HUERGO M S D,GALVAGNO M,et al.Commercial baker's yeast stability as affected by intracellu⁃lar content of trehalose,dehydration procedure and the physical properties of external matrices[J].Applied Micro⁃biology and Biotechnology,2000,54(4):575⁃80.
[4]SATPATHY G R,TÖRÖK Z,BALI R,et al.Loading red blood cells with trehalose:a step towards biostabilization[J].Cryobiology,2004,49(2):123⁃136.
[5]ARNOLD P,DJERASSI I,FARBER S,et al.The prepa⁃ration and clinical administration of lyophilized platelet ma⁃terial to children with acute leukemia and aplastic anemia[J].Journal of Pediatrics,1956,49(5):517⁃522.
[6]WOLKERS W F,WALKER N J,TABLIN F,et al.Hu⁃man platelets loaded with trehalose survive freeze⁃drying[J].Cryobiology,2001,42(2):79⁃87.
[7]ZHANG Shaozhi,FAN Juli,XU Xianguo,et al.An ex⁃perimental study of the use of ultrasound to facilitate the loading of trehalose into platelets[J].Cryobiology,2009,59(2):135⁃140.
[8]范菊莉,张绍志,徐梦洁,等.超声波预处理的人血小板冻干保存实验[J].南京航空航天大学学报,2012,44 (3): 420⁃424. ( FAN Juli,ZHANG Shaozhi,XU Mengjie,et al.Experimental study on lyophilization preser⁃vation of human platelets pretreated by ultrasound[J].Journal of Nanjing University of Aeronautics& Astronau⁃tics,2012,44(3):420⁃424.)
[9]肖洪海,李军,华泽钊,等.人脐带血有核细胞冷冻干燥保存实验初步研究[J].中国细胞生物学学报,2003,25(6):389⁃393.(XIAO Honghai,LI Jun,HUA Zezhao,et al.Research on freeze⁃drying of the nucleated cell of hu⁃man cord blood[J].Chinese Journal of Cell Biology,2003,25(6):389⁃393.)
[10]杨宏伟,陈晓隆,黄永刚.应用酶组织细胞化学技术对真空冷冻干燥保存兔角膜内皮细胞的研究[J].中国医科大学学报,2004,33(3):221⁃222.(YANG Hongwei,CHEN Xiaolong,HUANG Yonggang.Enzymes of corneal endothelial cells in vacuum freeze drying preservation in rabbit by using enzyme histocytochemistry[J].Journal of China Medical University,2004,33(3):221⁃222.)
[11]ZHANG M,OLDENHOF H,SIEME H,et al.Freezing⁃induced uptake of trehalose into mammalian cells facilitates cryopreservation [J].Biochimica et Biophysica Acta,2016,1858(6):1400⁃1409.
[12]华泽钊.低温生物医学技术[M].北京:科学出版社,1994.(HUA Zezhao.Low temperature biomedical technol⁃ogy[M].Beijing: Science Press,1994.)
[13]MENDENHALL C L,THEUS S A,ROSELLE G A,et al.Biphasic in vivo immune function after low⁃versus high⁃dose alcohol consumption[J].Alcohol,1997,14(3):255⁃260.
[14]何晖,刘宝林,华泽钊,等.甘油预处理对红细胞冷冻干燥保存作用的实验研究[J].制冷学报,2006,27(4):54⁃58.(HE Hui,LIU Baolin,HUA Zezhao,et al.Experimental study on effect of pretreatment with glycerol upon freeze⁃drying preservation quality of red blood cells[J].Journal of Refrigeration,2006,27(4):54⁃58.)
[15]KANIAS T,ACKER J P.Biopreservation of red blood cells—the struggle with hemoglobin oxidation[J].Febs Journal,2009,277(2):343⁃356.
[16]CHESNÉ C,GUILLOUZO A.Cryopreservation of isolated rat hepatocytes:a critical evaluation of freezing and thawing conditions[J].Cryobiology,1988,25(4):323⁃330.
[17]SPIELES G,HESCHEL I,RAU G.An attempt to recover viable human red blood cells after freeze⁃drying[J].Cryo Letters,1996,17(1):43⁃52.
[18]周俊,刘景汉,欧阳锡林,等.血小板胞内海藻糖测定方法的建立和评价[J].中国实验血液学杂志,2004,12(6):837⁃840.(ZHOU Jun,LIU Jinghan,OUYANG Xilin,et al.Establishment and evaluation on the method for platelet intracellular trehalose determination[J].Jour⁃nal of Experimental Hematology,2004,12(6):837⁃840.)
[19]LILLIE S H,PRINGLE J R.Reserve carbohydrate metab⁃olism in Saccharomyces cerevisiae:responses to nutrient limitation[J].Journal of Bacteriology,1980,143(3):1384.
[20]周新丽,刘建峰,周国燕,等.蛋黄卵磷脂对冻干红细胞恢复率的影响[J].制冷学报,2009,30(6):49⁃51.(ZHOU Xinli,LIU Jianfeng,ZHOU Guoyan,et al.Effect of egg yolk phosphatidylcholine on recovery of freeze⁃dried red blood cells[J].Journal of Refrigeration,2009,30(6):49⁃51.)
[21]司徒镇强,吴军正.细胞培养[M].北京:世界图书出版公司,1996.(SITU Zhenqiang,WU Junzheng.Cell cul⁃ture[M].Beijing: World Book Publishing Company,1996.)
[22]杨维,姜曼,耿文鑫,等.大鼠皮肤的冷冻干燥保存[J].中国组织工程研究,2009,13(41):8080⁃8084.(YANG Wei,JIANG Man,GENG Wenxin,et al.Freeze⁃drying preservation of rat skin tissues[J].Journal of Clini⁃cal Rehabilitative Tissue Engineering Research,2009,13(41):8080⁃8084.)
[23]LYNCH A L,CHEN R,SLATER N K.pH⁃responsive polymers for trehalose loading and desiccation protection of human red blood cells[J].Biomaterials,2011,32(19):4443⁃4449.
[24]GUO N,PUHLEV I D,MANSBRIDGE J,et al.Trehalose expression confers desiccation tolerance on human cells(see comments) [J].Nature Biotechnology,2000,18(2):168⁃171.
[25]ZANNIS V I,BRESLOW J L,SANGIACOMO T R,et al.Characterization of the major apolipoproteins secreted by two human hepatoma cell lines[J].Biochemistry,1981,20(25):7089⁃7096.
[26]DABOS K J,PARKINSON J A,HEWAGE C,et al.1H NMR spectroscopy as a tool to evaluate key metabolic func⁃tions of primary porcine hepatocytes after cryopreservation[J].Nmr in Biomedicine,2002,15(3):241⁃250.
[27]杨波,周燕,刘宝林,等.肝细胞低温保存的实验研究[J].中国生物医学工程学报,2011,30(2):308⁃311.(YANG Bo,ZHOU Yan,LIU Baolin,et al.Studies on cryopreservation of human hepatocytes[J].Chinese Journal of Biomedical Engineering,2011,30(2):308⁃311.)
[28]HAN Ying,LIU Mingdong,MA Enpu,et al.Preservation of human red blood cells by lyophilization[J].Bulletin of the Academy of Military Medicalences,2005,51(2):152⁃164.
[29]权国波,刘敏霞,郭永,等.聚乙烯吡咯烷酮和葡萄糖在冰冻干燥保存人红细胞中的效果研究[J].制冷学报,2006,27(5):11⁃16.(QUAN Guobo,LIU Minxia,GUO Yong,et al.Study on effect of pvp and glucose in ly⁃ophilization of human red blood cells[J].Journal of Refrig⁃eration,2006,27(5):11⁃16.)
[30]权国波,韩颖,刘秀珍,等.保护液的玻璃化状态对红细胞冷冻干燥保存后回收率的影响[J].中国实验血液学杂志,2003,11(3):308⁃311.(QUAN Guobo,HAN Ying,LIU Xiuzhen,et al.Effect of vitrification state of protective solutions on recovery of red blood cells after ly⁃ophilization preservation[J].Journal of Experimental He⁃matology,2003,11(3):308⁃311.)
[31]姚岚,梁玮,刘宝林.人肝癌细胞Hep⁃G2的低温保存研究[J].制冷学报,2015,36(2):95⁃100.(YAO Lan,LIANG Wei,LIU Baolin.Study on Cryopreservation of hu⁃man hepatoma Hep⁃G2 cell[J].Journal of Refrigeration,2015,36(2):95⁃100.)
[32]CROWE J H,CROWE L M,OLIVER A E,et al.The trehalose myth revisited:introduction to a symposium on stabilization of cells in the dry state[J].Cryobiology,2001,43(2):89⁃105.
[33]STOKICH B,OSGOOD Q,GRIMM D,et al.Cryopreser⁃vation of hepatocyte (HepG2) cell monolayers: impact of trehalose[J].Cryobiology,2014,69(2):281⁃290.
[34]CHEN T,ACKER J P,EROGLU A,et al.Beneficial effect of intracellular trehalose on the membrane integrity of dried mammalian cells[J].Cryobiology,2001,43(2):168⁃181.
[35]何晖,刘宝林,华泽钊,等.胞内海藻糖对红细胞冷冻干燥保存效果的影响[J].制冷学报,2006,27(3):41⁃44.(HE Hui,LIU Baolin,HUA Zezhao,et al.Beneficial effect of intracellular trehalose on viability of freeze⁃dried red blood cells[J].Journal of Refrigeration,2006,27(3):41⁃44.)
Preliminary Research on Freeze⁃drying Preservation of Human Hepatoma Hep⁃G2 Cells
Song Ping Li Weijie Zhou Xinli Liu Baolin
(School of Medical Instrument and Food Engineering,University of Shanghai for Science and Technology,Shanghai,200093,China)
Freeze⁃drying is a long⁃term and effective method for cell preservation.The lyoprotectant can have a significant effect on cell freeze⁃drying.In this study,different volume concentrations of Me2SO,glycerol,and different mass concentrations polyvinylpyrrolidone(PVP),compound lyoprotectant for lyophilizing human Hepatoma Hep⁃G2 cells were considered.The effect of intracellular trehalose on the lyophilized cells was investigated by determining the cell⁃recovery rate,survival rate,and 24 h attachment rate.The results show that,compared with the control group,the cells added in a 40%PVP (w/v) + 10% (v/v) glycerol + 15%fetal bovine serum (FBS) (v/v) + 20% trehalose (w/v) solution
better protection.The cell recovery rate,survival rate,and 24 h adherent rate are 29.58%,42.18%,and 18.71%,respectively.When the extracellular trehalose molar concentration is 800 mmol/L,the Hepatoma Hep⁃G2 cell⁃recovery rate,survival rate,and 24 h adherent rate are 27.81% ,66.65% ,and 33.68% ,respectively.It is significantly better than the control group and has the best protection for cell freeze⁃drying.
freeze⁃drying;lyoprotectant;cell;survival rate
Li Weijie,male,lecturer,College of Medical Equipment and Food,University of Shanghai for Science and Technology,+86 13651731551,E⁃mail:liweijie10 @ 139.com.Research fields:cryopreservation or freeze⁃drying of food,cells and tissues.
TB61+1;R318.52;R735.7
A
0253-4339(2017)06-0111-08
10.3969 /j.issn.0253 - 4339.2017.06.111
国家自然科学基金(51376132)资助项目。(The project was supported by the National Natural Science Foundation of China (No.51376132).)
2017年1月23日
李维杰,男,讲师,上海理工大学医疗器械与食品学院,13651731551,E⁃mail:liweijie10@ 139.com。 研究方向:食品及生物细胞、组织冷冻冷藏以及冻干工艺。

