一氧化氮供体JS-K对H22荷瘤小鼠肿瘤能量代谢的调节作用
刘 玲,黄紫乐,慎会娜,王 静,刘沐辰,花昌林
(河南科技大学医学院药学系,河南洛阳 471003)
一氧化氮供体JS-K对H22荷瘤小鼠肿瘤能量代谢的调节作用
刘 玲,黄紫乐,慎会娜,王 静,刘沐辰,花昌林
(河南科技大学医学院药学系,河南洛阳 471003)
目的研究新型一氧化氮(NO)供体O2-(2,4-二硝基苯基)1-〔(4-乙氧羰基)哌嗪-1-yl〕偶氮-1-鎓-1,2-二醇(JS-K)对H22荷瘤小鼠肿瘤能量代谢的调节作用。方法BALB/c小鼠皮下接种H22细胞建立荷瘤小鼠模型,并随机分为模型组、氟尿嘧啶(5-FU)组、JS-K 0.75和1.50 mg·kg-1组。JS-K组和模型组小鼠每3 d尾静脉注射不同剂量JS-K或生理盐水,连续14 d(共给药5次);5-FU组每天1次ip给予5-FU 20 mg·kg-1。给药后第15天将小鼠处死,分离胸腺、脾和完整瘤体,并称取其质量,计算抑瘤率和脏器系数。比色法检测瘤组织中己糖激酶(HK)、丙酮酸激酶(PK)、磷酸果糖激酶(PFK)、琥珀酸脱氢酶(SDH)和腺苷三磷酸酶(ATPase)活性,以及乳酸和ATP水平;Western蛋白印迹法检测各组瘤组织中缺氧诱导因子-1α(HIF-1α)和己糖激酶Ⅱ(HKⅡ)蛋白表达。结果与模型组比较,JS-K 0.75和1.50 mg·kg-1组瘤质量显著下降(P<0.01),抑瘤率分别为23.9%和50.3%。JS-K 0.75和1.50 mg·kg-1组小鼠胸腺系数和脾系数与模型组无明显差异。比色法检测结果显示,JS-K 1.50 mg·kg-1组瘤组织中HK,PFK,SDH,PK和ATPase活性较模型组的〔22.6±3.7,14.4±2.6,(10.5±2.6)U·g-1蛋白,(12.9±3.2)kU·g-1蛋白和(0.70±0.10)mmolPi·g-1蛋白·h-1〕分别下降了42.0%,26.6%,23.3%,22.7%和21.7%(P<0.01,P<0.05);JS-K 1.50 mg·kg-1组瘤组织中ATP水平较模型组下降16.6%(P<0.01);JS-K 0.75和1.50 mg·kg-1组瘤组织中乳酸水平较模型组分别下降38.7%和59.4%(P<0.01)。Western蛋白印迹检测结果显示,与模型组比较,JS-K 1.50 mg·kg-1组瘤组织中HIF-1α蛋白表达显著降低(P<0.01);JS-K 0.75和1.50 mg·kg-1组HKⅡ蛋白表达均显著降低(P<0.05,P<0.01)。结论JS-K能抑制H22荷瘤小鼠肿瘤生长,其机制可能与抑制糖酵解和有氧氧化途径从而调节肿瘤能量代谢有关。
一氧化氮供体;偶氮鎓二醇盐;肿瘤;能量代谢
原发性肝癌是临床上最常见的恶性肿瘤之一,肝癌发病率居我国恶性肿瘤发病率第4位,而在恶性肿瘤致死率中居第2位,仅次于肺癌。在我国,肝癌多在乙肝和肝硬变基础上发展而来,其中90%为肝细胞肝癌,手术是肝癌首选的治疗方法,但对于一些体质较弱、出现了广泛肝外转移或肿瘤较大的患者则不适宜手术,因此药物治疗仍是肝癌治疗的主要手段之一。
一氧化氮(nitric oxide,NO)是生物体内重要的信号分子,在体内生理和病理过程中发挥重要作用,如血管扩张、神经信号传导和肿瘤发生与转移等。研究表明,NO对肿瘤生长具有双重作用,低浓度NO通过参与血管形成、增加血管通透性和减少淋巴内皮细胞的黏附等效应改善血液供应而促进肿瘤生长,而高浓度NO可通过抑制血管生成和转移、诱导细胞凋亡等机制抑制肿瘤细胞增殖[1]。由于NO在体内半衰期较短,在水溶液中不稳定,因此开发NO供体型抗肿瘤药物成为研究的热点。NO供体是指在体内经酶或非酶作用释放NO的化合物,它可作为一种NO体内运输形式,又可作为一种贮存形式,延长NO半衰期。现已发现多种结构类型的NO供体,如有机硝酸酯类、亚硝基硫醇、呋咱氮氧化合物和偶氮鎓二醇盐等,其中偶氮鎓二醇盐类在靶向性释放NO方面优势明显[2]。O2-(2,4-二硝基苯基)1-〔(4-乙氧羰基)哌嗪-1-yl〕偶氮-1-鎓-1,2-二醇(JS-K),是在偶氮二醇盐O2端以硝基芳香取代基进行取代,在体内某些特定酶作用下在肿瘤细胞释放NO而发挥抗肿瘤作用。Shami等[3-4]发现,JS-K可选择性地在急性粒细胞白血病HL-60细胞内释放NO,杀灭癌细胞,而不伤害正常细胞;对免疫缺陷型小鼠体内植入的HL-60细胞及前列腺癌细胞PC-3,JS-K均能抑制其生长,且不导致小鼠血压下降等副作用。前期研究显示,JS-K可诱导HepG2细胞凋亡,提高Bax/Bcl-2比值,释放细胞色素c(cytochrome c,Cyt c),升高胞浆中Ca2+水平,降低线粒体膜电位,激活胱天蛋白酶9和3[5]。为进一步研究JS-K的抗肿瘤作用,本研究通过制备H22荷瘤小鼠模型,观察JS-K对H22荷瘤小鼠肿瘤生长的抑制作用,为该化合物的临床应用提供实验依据。
1 材料与方法
1.1 动物、药品、试剂和主要仪器
健康雄性BALB/c小鼠40只,体质量22~24 g,由河南科技大学医学院实验动物中心提供,动物许可证号:SCXK(鄂)2010-0007。饲养环境通风良好,室温18~25℃,光照12 h(7∶00-19∶00),相对湿度45%~55%,自由摄食饮水。
JS-K(纯度≥97%,相对分子质量384),美国Santa Cruz公司。氟尿嘧啶注射液(规格10 mL∶0.25 g,批号100605),上海旭东海普药业有限公司。己糖激酶(hexokinase,HK)、磷酸果糖激酶(phosphofructokinase,PFK)、丙酮酸激酶(pyruvate kinase,PK)、琥珀酸脱氢酶(succinate dehydrogenase,SDH)和腺苷三磷酸酶(adenosinetriphosphatase,ATPase)活性检测试剂盒,以及乳酸和ATP含量检测试剂盒均为南京建成生物工程研究所产品;缺氧诱导因子-1α(hypoxia-inducible factor 1 alpha,HIF-1α)和己糖激酶Ⅱ(hexokinaseⅡ,HKⅡ)兔多克隆抗体和辣根过氧化物酶(HRP)标记的羊抗兔IgG为武汉三鹰生物技术有限公司产品;其他化学试剂均为分析纯。UV1901PC紫外分光光度计(上海奥析科学仪器有限公司);酶标仪(美国Molecular Devices公司);Mini Trans-blot电转膜系统(美国Bio-Rad公司);荧光及化学发光成像系统Clinx Chemi Scope2850(上海勤翔科学仪器有限公司)。
1.2 H22荷瘤小鼠模型的制备和实验分组
H22细胞株复苏后,以无菌生理盐水配成浓度为1.0×107L-1,取0.2 mL接种于小鼠腹腔,7 d后选择腹水饱满小鼠,在超净台内里消毒鼠腹,无菌条件下用1mL的一次性注射器抽取乳白色腹水,置于无菌器皿内,以1∶3生理盐水稀释后匀浆制成瘤细胞悬液,调整瘤细胞密度为1.0×107L-1。用无菌注射器从细胞悬液中取0.2 mL,接种于经乙醇消毒后的小鼠右侧腋窝皮下,整个实验操作在1 h内完成,术后观察动物行为无异常。接种次日,称重,将小鼠随机分为4组,每组8只,即模型组、5-FU组、JS-K 0.75和1.50 mg·kg-1组。JS-K组和模型组每3 d尾静脉注射不同剂量JS-K或同体积生理盐水,连续给药14 d(共给药5次),给药容积为10 mL·kg-1。5-FU组每天1次ip给予5-FU 20 mg·kg-1,连续给药14 d。期间每天记录各组小鼠的体质量、进食量和生存状态。
1.3 肿瘤抑制率和脏器系数计算
开始给药后第15天将小鼠处死,摘取小鼠胸腺、脾及完整瘤组织,用电子天平分别称取各组织质量,并计算抑瘤率及脏器系数。抑瘤率(%)=(模型组平均瘤质量-给药组平均瘤质量)/模型组平均瘤质量×100%;脏器系数=脏器质量(g)/体质量(g)×100。
1.4 比色法检测瘤组织中能量代谢相关酶活性以及乳酸和ATP含量
取部分瘤组织置于离心管中,按体积比1∶9加入生理盐水,冰浴下用匀浆机制成组织匀浆,1368×g离心10 min,取上清液,按试剂盒操作步骤,在酶标仪上测定HK,PFK,PK,SDH和ATPase活性,及乳酸和ATP含量。采用BCA试剂盒于562 nm处测定样品蛋白含量。
1.5 Western蛋白印迹法检测瘤组织HlF-1 α和HKⅡ蛋白水平
将瘤组织剪碎,加裂解液裂解提取总蛋白,BCA法测定蛋白含量。用12%SDS-PAGE电泳分离蛋白,电转印至PVDF膜上,5%脱脂奶粉常温封闭1 h,加入一抗(稀释倍数均为1∶1000)于封闭袋中4℃孵育过夜;二抗室温孵育2 h。ECL化学发光法显影,凝胶成像系统拍照,并对蛋白条带进行半定量分析。以目的蛋白条带与内参蛋白条带积分吸光度值的比值表示目的蛋白相对表达水平。
1.6 统计学分析
实验结果数据以x±s表示,经SPSS13.0软件进行统计学分析,总体均数比较采用单因素方差分析,两组间均数比较采用Dunnett t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 JS-K对H22荷瘤小鼠肿瘤生长的影响
如表1所示,与模型组比较,JS-K 0.75和1.50 mg·kg-1组瘤质量显著减少(P<0.01),肿瘤生长抑制率分别达23.9%和50.3%;5-FU 20 mg·kg-1组瘤质量显著减少(P<0.01),肿瘤生长抑制率为60.0%。

Tab.1 lnhibition of JS-K on tumor growth in H22 tumorbearing mice
2.2 JS-K对H22荷瘤小鼠胸腺和脾系数的影响
与模型组比较,JS-K 0.75和1.50 mg·kg-1组对小鼠脾系数和胸腺系数均无显著影响;5-FU组小鼠脾和胸腺系数显著降低(P<0.05,P<0.01)(表2)。

Tab.2 Effect of JS-K on thymus and spleen coeffient in H22 tumor-bearing mice
2.3 JS-K对H22荷瘤小鼠瘤组织HK,PFK和PK活性和乳酸水平的影响
模型组小鼠瘤组织中糖酵解途径相关的HK,PFK和PK活性分别为22.6±3.7,(14.4±2.6)U·g-1蛋白和(12.9±3.2)kU·g-1蛋白,JS-K 1.50 mg·kg-1组上述激酶活性分别下降42.0%(P<0.01)(图1A),26.6%(P<0.01)(图 1B)和 22.7%(P<0.05)(图1C)。模型组小鼠瘤组织中乳酸水平为(0.44±0.09)mmol·g-1蛋白,JS-K 0.75和1.50 mg·kg-1组乳酸水平分别下降38.7%(P<0.01)和59.4%(P<0.01)(图1D)。5-FU组小鼠瘤组织中HK,PFK和PK活性分别下降46.9%(图1A),34.1%(图1B)和25.6%(图1C),乳酸水平下降53.2%(图1D)(P<0.05,P<0.01)。

Fig.1 Effect of JS-K on activities of hexokinase(HK)(A),phosphofructokinase(PFK)(B),pyruvate kinase(PK)(C)and level of lactic acid(LD)(D)in tumor tissue of H22 tumor-bearing mice by colorimetric method.See Tab.1 for the mouse treatment.±s,n=8.*P<0.05,**P<0.01,compared with model group.
2.4 JS-K对H22荷瘤小鼠瘤组织SDH和ATPase活性及ATP水平的影响
模型组小鼠瘤组织中有氧氧化途径的SDH和ATPase活性分别为(10.5±2.6)U·g-1蛋白和(0.70±0.10)mmolPi·g-1protein·h-1;与模型组比较,JS-K 1.50 mg·kg-1组SDH和ATPase活性分别下降 23.3%(P<0.05)(图 2A)和 21.7%(P<0.01)(图2B)。JS-K 1.50 mg·kg-1组ATP水平由模型组的(303±24)mmol·g-1蛋白下降16.6%(P<0.01)(图2C)。5-FU组SDH和ATPase活性分别下降26.0%(P<0.05)(图 2A)和 27.9%(P<0.01)(图2B),ATP水平下降14.9%(P<0.01)(图2C)。
2.5 JS-K对H22荷瘤小鼠瘤组织HlF-1 α和HKⅡ蛋白表达的影响
如图3所示,与模型组比较,JS-K 1.50 mg·kg-1组小鼠瘤组织HIF-1α蛋白表达显著降低(P<0.01);JS-K 0.75和1.50 mg·kg-1组HKⅡ蛋白表达均显著降低(P<0.05,P<0.01)。
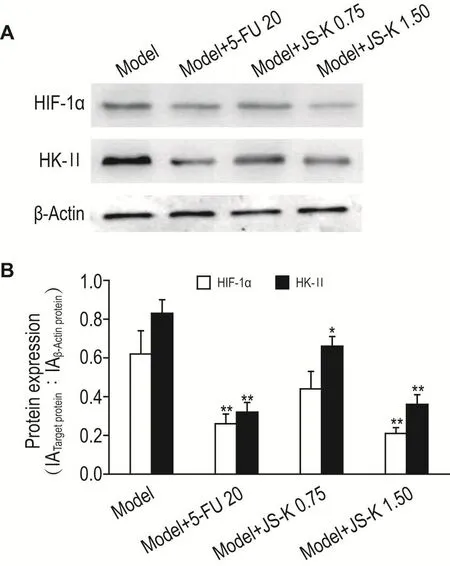
Fig.3 Effect of JS-K on expressions of hypoxia-inducible factor-1 alpha(HlF-1 α)and hexokinaseⅡ(HKⅡ)in tumor tissue of H22 tumor-bearing mice by Western blotting.See Tab.1 for the mouse treatment.B was the semiquantitative result of A.IA:integrated absorbance.±s,n=8.*P<0.05,**P<0.01,compared with model group.
3 讨论
本研究结果显示,模型组小鼠平均瘤质量为(1.62±0.12)g,肿瘤生长良好,提示造模成功。5-FU是一种人工合成的抗代谢药,对消化道肿瘤、肝癌和膀胱癌等均有一定的疗效。本研究中,5-FU在20 mg·kg-1剂量下能显著抑制荷瘤小鼠肿瘤生长,但使小鼠脾系数和胸腺系数显著降低,提示其对免疫器官具有一定损伤作用。JS-K给药组也可抑制肿瘤生长,在1.5 mg·kg-1剂量下抑瘤作用显著,且对小鼠脾系数和胸腺系数均无显著影响。提示JS-K在治疗肝癌方面可能具有很好的应用前景。
细胞代谢需要ATP提供能量,主要通过糖酵解和氧化磷酸化途径产生。糖酵解过程中,葡萄糖分解生成丙酮酸,在有氧条件下,丙酮酸被转运至线粒体内进一步氧化分解生成乙酰辅酶A进入三羧酸循环,经氧化磷酸化完全分解生成H2O和CO2,并产生ATP;在缺氧条件下,丙酮酸被还原成乳酸。肿瘤细胞在能量代谢上与正常细胞不同,即使在有氧条件下仍然通过有氧糖酵解(Warburg效应)来获取能量[6]。研究表明,由于肿瘤细胞快速增殖,内部远离血管的肿瘤细胞常处于缺氧的微环境中,而糖酵解途径可提高细胞对缺血缺氧的耐受性,提供能量以满足其快速生长的需要[7-8]。HK是糖酵解途径第一个酶,也是糖酵解的限速酶,分为Ⅰ~Ⅳ4种亚基,其中HKⅡ与恶性肿瘤的相关性最强[9]。肿瘤细胞在缺氧环境下可激活HIF-1α,通过上调葡萄糖转运体1、HK和乳酸脱氢酶A等促进葡萄糖转化成丙酮酸和乳酸;HIF-1α还能提高HKⅡ和3-磷酸肌醇依赖性蛋白激酶1的活性,并协同myc癌基因的突变,启动肿瘤细胞进行有氧糖酵解[10]。本研究发现,NO供体JS-K可显著降低糖酵解途径中的HK,PFK和PK的活性,降低组织中乳酸水平,并显著降低肿瘤组织中HIF-1α和HKⅡ蛋白表达,提示其抑制肿瘤生长作用可能与抑制糖酵解途径有关。
肿瘤细胞的恶性增殖是一个能量消耗的过程,除有氧糖酵解途径之外,线粒体氧化磷酸化途径对细胞总ATP产生也有一定作用[11]。SDH是线粒体内膜的结合酶,可为真核细胞线粒体和多种原核细胞需氧和产能的呼吸链提供电子,为线粒体的一种标志酶。ATPase能催化ATP水解产生ADP和无机磷酸并释放能量。本研究发现,JS-K在1.5 mg·kg-1剂量下,可显著抑制有氧氧化途径中SDH和ATPase的活性,降低组织中ATP水平。
综上,NO供体JS-K具有显著抑制H22荷瘤小鼠肿瘤生长的作用,可能主要通过“双效”机制干扰肿瘤能量代谢而产生。一方面通过降低HIF-1α和HKⅡ蛋白表达,抑制有氧糖酵解途径中关键酶HK,PFK和PK的活性,减弱肿瘤细胞糖酵解能力,降低组织中乳酸水平;另一方面通过抑制有氧氧化途径中关键酶SDH和ATPase的活性,降低组织中ATP水平。
[1] Rabender CS,Alam A,Sundaresan G,Cardnell RJ,Yakovlev VA,Mukhopadhyay ND,et al.The role of nitric oxide synthase uncoupling in tumor progression[J].Mol Cancer Res,2015,13(6):1034-1043.
[2] Zhou X,Zhang J,Feng G,Shen J,Kong D,Zhao Q.Nitric oxide-releasing biomaterials for biomedical applications[J].Curr Med Chem,2016,23(24):2579-2601.
[3] Shami PJ,Saavedra JE,Wang LY,Bonifant CL,Diwan BA,Singh SV,et al.JS-K,a glutathione/glutathione S-transferase-activated nitric oxide donor of the diazeniumdiolate class with potent antineoplastic activity[J].Mol Cancer Ther,2003,2(4):409-417.
[4] Shami PJ,Saavedra JE,Bonifant CL,Chu J,Udupi V,Malaviya S,et al.Antitumor activity of JS-K{O2-(2,4-dinitrophenyl)1-[(4-ethoxycarbonyl)piperazin-1-yl]diazen-1-ium-1,2-diolate}and related O2-aryl diazeniumdiolatesin vitroandin vivo[J].J Med Chem,2006,49(14):4356-4366.
[5]Liu L,Wang D,Wang J,Wang S.The nitric oxide prodrug JS-K induces Ca2+-mediated apoptosis in human hepatocellular carcinoma HepG2 cells[J].J Biochem Mol Toxicol,2016,30(4):192-199.
[6] Lee N,Kim D.Cancer metabolism:fueling more than just growth[J].Mol Cells,2016,39(12):847-854.
[7]Potter M,Newport E,Morten KJ.The Warburg effect: 80 years on[J].Biochem Soc Trans,2016,44(5):1499-1505.
[8] Schwartz L,Supuran CT,Alfarouk KO.The Warburg effect and the hallmarks of cancer[J].Anticancer Agents Med Chem,2017,17(2):164-170.
[9] Kudryavtseva AV,Fedorova MS,Zhavoronkov A,Moskalev AA,Zasedatelev AS,Dmitriev AA,et al.Effect of lentivirus-mediated shRNA inactivation of HK1,HK2,and HK3 genes in colorectal cancer and melanoma cells[J].BMC Genet,2016,17(Suppl 3):156.
[10] Mack N,Mazzio EA,Bauer D,Flores-Rozas H,Soliman KF.Stable shRNA silencing of lactate dehydrogenase A(LDHA)in human MDA-MB-231 breast cancer cells fails to alter lactic acid production,glycolytic activity,ATP or survival[J].Anticancer Res,2017,37(3):1205-1212.
[11] Jamei M,Marciniak S, Feng K,Barnett A,Tucker G,Rostami-Hodjegan A.The simcyp population-based ADME simulator[J].Expert Opin Drug Metab Toxicol,2009,5(2):211-223.
[12] Cai JX,Chen SY,Zhang WP,Sun JY,Wang TT,LÜ J,et al.Proteomic analysis of 5-fluorouracil induced apoptosis in MCF-7 human breast carcinoma cells[J].Chin Pharm J(中国药学杂志),2014,49(4):303-308.
2017-04-10 接受日期:2017-07-14)
(本文编辑:赵 楠)
Regulation of nitric oxide donor JS-K on tumor energy metabolism in H22 tumor-bearing mice
LIU Ling,HUANG Zi-le,SHEN Hui-na,WANG Jing,LIU Mu-chen,HUA Chang-lin
(Department of Pharmacy,Medical College,Henan University of Science and Technology,Luoyang 471003,China)
OBJECTlVETo investigate the regulation of{O2(2,4-dinitrophenyl)1-[(4-ethoxycarbonyl)piperazin-1-yl]diazen-1-ium-1,2-diolate}(JS-K),a nitric oxide donor,on tumor energy metabolism in H22 tumor-bearing mice.METHODSThe hepatoma animal model in BALB/c mice was established with H22 cell line.The inoculated mice were randomly divided into four groups.The JS-K group and model group
JS-K(0.75 and 1.50 mg∙kg-1)and saline via tail the vein intravenously once every 3 d for 14 d,and 5 injections,respectively.The fluorouracil(5-FU)group received 5-FU 20 mg·kg-1by intraperitoneal injection once a day for 14 d.On the 15thday after the first administration,mice were sacrificed and the tumor,thymus and spleen were isolated and weighed immediately.The tumor growth inhibitory rate and organ index were calculated.The activities of hexokinase(HK),phosphofructokinase(PFK),pyruvate kinase(PK),succinate dehydrogenase(SDH),adenosinetriphosphatase(ATPase),and the levels of lactic acid(LD)and adenosine triphosphate(ATP)in tumor tissues were determined by colorimetric method.The expression of hypoxia-inducible factor 1 alpha(HIF-1α)and hexokinaseⅡ(HKⅡ)in the tumor tissue was analyzed by Western blotting.RESULTSCompared with model group,the tumor mass of JS-K 0.75 and 1.50 mg·kg-1groups was significantly reduced(P<0.01),and the tumor growth inhibitory rate was 23.9%and 50.3%,respectively.There was no diffrence in thymic and splenic indexes between JS-K group and model group.The activity of HK,PFK,SDH,PK and ATPase of tumor tissue in model group was 22.6±3.7,14.4±2.6,(10.5±2.6)U·g-1protein,(12.9±3.2)kU·g-1protein and(0.70±0.10)mmolPi·g-1protein·h-1,respectively,which dropped by 42.0%,26.6%,22.7%,23.3%and 21.7%respectively(P<0.01,P<0.05)in JS-K 1.50 mg∙kg-1group.Compared with the model group,the level of ATP of tumor tissue in JS-K 1.50 mg∙kg-1groups dropped by 16.6%(P<0.01)and the level of LD in JS-K 0.75 and 1.50 mg∙kg-1groups dropped by 38.7%and 59.4%(P<0.01),respectively.In addition,the expression of HIF-1α of tumor tissue in JS-K 1.50 mg∙kg-1group was decreased(P<0.01),and the expression of HKⅡ of tumor tissue in JS-K 0.75 and 1.50 mg∙kg-1groups was decreased significantly(P<0.05,P<0.01).CONCLUSlONJS-K can inhibit the growth of tumor in H22 tumor-bearing mice and its mechanism may be related to regulating the tumor energy metabolism by inhibiting glycolysis and aerobic oxidation.
nitric oxide donor;diazeniumdiolate;tumor;energy metabolism
The project supported by Young Backbone Teachers Assistance Scheme of Henan Province Colleges and Universities(2016GGJS-065);Students Research Training Program of Henan University of Science and Technology(2016115);and National College Students′Innovation and Entrepreneurship Training Program(201610464064)
LIU Ling,E-mail:liuling921@126.com,Tel:(0379)64830345
R979.1
A
1000-3002-(2017)07-0730-06
DOl:10.3867/j.issn.1000-3002.2017.07.005
河南省高等学校青年骨干教师培养计划项目(2016GGJS-065);河南科技大学大学生科研训练计划项目(2016115);国家级大学生创新创业训练计划项目(201610464064)
刘 玲,女,副教授,主要从事肿瘤药理学研究。
刘 玲,E-mail:liuling921@126.com,Tel:(0379)64830345

