结直肠癌患者外周血中CCDC12检测的意义
梁巍 耿玮 叶智斌 范亚男 张立晓
·论著·
结直肠癌患者外周血中CCDC12检测的意义
梁巍 耿玮 叶智斌 范亚男 张立晓
目的检测CCDC12在结直肠癌患者外周血中的水平,对其临床意义进行探讨。方法80例行结直肠癌根治术的患者为手术组,70例确诊的术后复发的患者为复发组,酶联免疫法(ELISA)检测手术组患者术前、术后2周及复发组患者外周血CCDC12、多配体蛋白聚糖-1(SDC-1)、基质金属蛋白酶-9(MMP-9)的水平;同时检测同期体检的健康者50例为对照组,检测外周血CCDC12、SDC-1、MMP-9水平。免疫组化技术检测手术组、复发组肿瘤组织及癌旁正常结直肠黏膜中CCDC12、SDC-1、MMP-9的水平。结果手术组术前、复发组、对照组外周血CCDC12、SDC-1、MMP-9水平有显著差异,复发组水平最高,手术组术前次之,对照组最低(Plt;0.05);手术组术后CCDC12、SDC-1、MMP-9均比术前明显下降(Plt;0.05),与对照组比较,差异无统计学意义(Pgt;0.05)。免疫组化结果显示CCDC12、MMP-9在手术组、复发组肿瘤组织中阳性率差异无统计学意义(Pgt;0.05),均高于正常结直肠黏膜(Plt;0.05);SDC-1在3组中阳性率存在明显差异,复发组最低、手术组次之,在正常结直肠黏膜中阳性率最高(Plt;0.05)。Spearman分析显示CCDC12、SDC-1在手术组肿瘤组织与术前外周血中存在正相关;手术组肿瘤组织中CCDC12与MMP-9呈正相关,在手术组术前外周血中CCDC12与SDC-1、CCDC12与MMP-9均呈正相关(Plt;0.05)。结论检测结直肠癌患者外周血CCDC12表达可能作为新的肿瘤标志物反映患者的病情,CCDC12可能与SDC-1、MMP-9协同作用参与了结直肠癌的进展。
结直肠癌;CCDC12基因;多配体蛋白聚糖-1;基质金属蛋白酶-9;肿瘤标志物
结直肠癌在我国的发病率近年来有上升趋势,其发病率死亡率都居于恶性肿瘤前列[1]。虽然手术及药物治疗结直肠癌已取得了较大进展,但结直肠癌的早期诊断率仍较低,且术后易于复发。这是结直肠癌综合治疗效果不满意的重要原因。结直肠癌的发生及进展与多种因素有关,阐明其机制对寻找肿瘤标志物、确定治疗靶基因有重要意义。研究发现卷曲螺旋结构域(coiled-coil domain-containing,CCDC)基因家族有多个成员,其中一些CCDC基因与恶性肿瘤关系密切[2-4],也有研究发现CCDC12与结直肠癌有关[5]。但CCDC12在不同结直肠癌患者外周血中表达是否存在异常目前罕见报道。本研究检测了原发手术的结直肠癌患者及复发患者外周血及肿瘤组织中CCDC12的表达情况,比较了手术前后外周血CCDC12的变化。还检测了多配体蛋白聚糖-1(Syndecan-1,SDC-1)、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)在肿瘤组织及外周血的表达。通过对结果的分析,探讨了CCDC12在结直肠癌患者外周血中表达变化的规律及意义,为寻找新的结直肠癌相关基因、确定新的肿瘤标志物提供了一定依据。
1 资料与方法
1.1 一般资料 入组者为2014年1月至2016年6月于河北省人民医院外科就诊的结直肠癌患者,80例确诊为结直肠癌并进行手术切除原发肿瘤者为手术组;同期就诊并诊断为结直肠癌术后复发患者70例为复发组。手术组患者男55例,女25例;年龄39~81岁,平均年龄(56.49±8.93)岁;患者均为初诊患者,术前未接受新辅助放化疗或靶向治疗,手术均切除原发肿瘤。复发组患者男52例,女18例;年龄37~72岁,平均年龄(55.01±8.11)岁;患者均曾接受结直肠癌根治手术,均有病理活检证实为复发,与原手术病理一致。选取同期进行体检的正常者50例为对照组,男30例,女20例;3组性别比、年龄比较差异无统计学意义(Pgt;0.05)。本研究得到医院伦理委员会批准及入组者知情同意。
1.2 主要试剂 CCDC12检测的ELISA试剂盒为美国PPL公司产品,SDC-1、MMP-9的ELISA试剂盒为美国Thermo公司产品,CCDC12免疫组化抗体为美国Aviva公司产品,SDC-1、MMP-9抗体为美国Sigma公司产品,免疫组化试剂盒及DAB显色试剂盒为北京中杉金桥公司产品。
1.3 外周血收集及检测 入组者抽取空腹静脉血5 ml,离心分离血清后用于ELISA检测。手术组于术前1 d、术后2周各抽血1次;复发组及对照组均抽血1次。按ELISA试剂盒说明操作,检测各目的蛋白的表达。
1.4 组织收集 取手术组肿瘤及癌旁正常肠黏膜组织(标本距肿瘤边缘大于5 cm,病理学检测无癌及非典型增生组织存在),石蜡标本及复发组肿瘤石蜡组织用于CCDC12、SDC-1、MMP-9免疫组化检测。检测按免疫组化试剂盒说明书进行,以阳性细胞百分比及染色强度二次计分法判断结果。
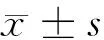
2 结果
2.1 手术组、复发组、对照组外周血CCDC12、SDC-1、MMP-9水平 手术组患者术前1 d外周血CCDC12、SDC-1、MMP-9水平分别为(76.64±20.26)pg/ml、(138.94±48.68)ng/ml、(188.58±58.86)ng/ml,术后2周水平分别是(11.25±3.88)pg/ml、(91.22±28.48)ng/ml、(104.34±30.24)ng/ml,3种指标术后均明显低于术前(Plt;0.05)。复发组患者外周血CCDC12、SDC-1、MMP-9水平分别为(123.74±52.96)pg/ml、(204.63±72.58)ng/ml、(246.28±78.52)ng/ml,均明显高于手术组术前水平(Plt;0.05)。对照组外周血CCDC12、SDC-1、MMP-9水平分别为(10.22±3.32)pg/ml、(85.65±24.72)ng/ml、(98.26±29.68)ng/ml,均低于手术组术前及复发组水平(Plt;0.05),但与手术组术后2周差异无统计学意义(Pgt;0.05)。见表1。
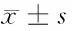
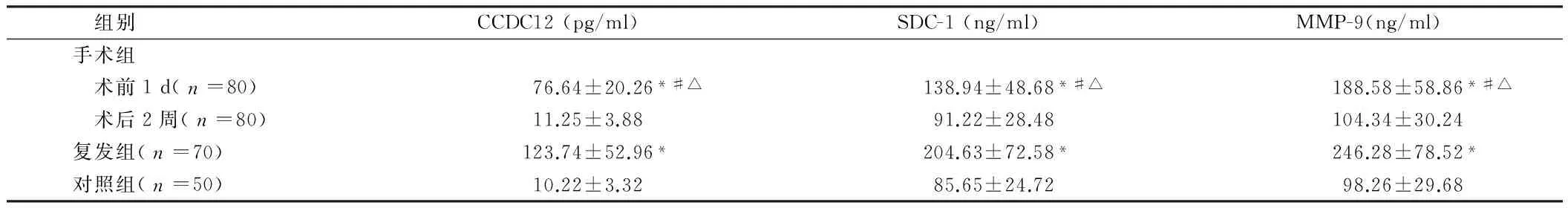
组别CCDC12(pg/ml)SDC-1(ng/ml)MMP-9(ng/ml)手术组 术前1d(n=80)76.64±20.26*#△138.94±48.68*#△188.58±58.86*#△ 术后2周(n=80)11.25±3.8891.22±28.48104.34±30.24复发组(n=70)123.74±52.96*204.63±72.58*246.28±78.52*对照组(n=50)10.22±3.3285.65±24.7298.26±29.68
注:与对照组比较,*Plt;0.05;与复发组比较,#Plt;0.05;与术后2周比较,△Plt;0.05
2.2 手术组、复发组、对照组患者肿瘤组织中CCDC12、SDC-1、MMP-9表达的免疫组化结果 免疫组化结果显示CCDC12、MMP-9在手术组、复发组肿瘤组织中的阳性率差异无统计学意义(χ2=0.139,P=0.709),复发组及手术组CCDC12表达均高于正常结直肠黏膜(χ2=55.303,Plt;0.001;χ2=56.183,Plt;0.001);复发组及手术组MMP-9表达均高于正常结直肠黏膜(χ2=55.9333,Plt;0.001;χ2=45.540,Plt;0.001)。SDC-1在3组中阳性率差异有统计学意义,在复发组最低、手术组次之,在正常结直肠黏膜中阳性率最高(Plt;0.05)。见表2。

表2 手术组、复发组肿瘤组织与正常结直肠黏膜CCDC12、SDC-1、MMP-9表达情况 例
2.3 CCDC12及SDC-1、MMP-9在肿瘤组织与外周血表达的关系 Spearmann相关分析对手术组进行了分析,结果显示CCDC12在结直肠癌肿瘤组织与术前外周血之间存在正相关性(r=0.3876,Plt;0.001),SDC-1在肿瘤组织与术前外周血之间也存在正相关(r=0.3214,P=0.004),而MMP-9则未发现明显相关性(r=0.2022,P=0.072)。
2.4 CCDC12、SDC-1、MMP-9的相关关系 对手术组结直肠癌组织及术前外周血结果分析,发现肿瘤组织中CCDC12与MMP-9的表达存在明显正相关性(r=0.4146,Plt;0.001);CCDC12与SDC-1、SDC-1与MMP-9均无明显相关性(r=0.1672,P=0.138;r=0.2106,P=0.061)。在患者术前外周血中CCDC12与SDC-1、CCDC12与MMP-9存在正相关关系(r=0.3754,Plt;0.001;r=0.2635,P=0.018),SDC-1与MMP-9未发现明显相关关系(r=0.1845,P=0.101)。
3 讨论
近年来结直肠癌在我国的发病率不断上升[1],其发病率居于我国恶性肿瘤第4位,死亡率居第5位[6],对人民的健康威胁严重。结直肠癌无明显特异性症状,因此早期难以发现,手术后复发也难以及时预测。因此,确定新的肿瘤相关分子对发现结直肠癌新标志物及治疗靶点有重要意义。CCDC 12基因是新近发现的与结直肠癌有关的基因[5],但该基因在结直肠癌中的具体作用还不明确,在外周血中的表达情况也不清楚。本研究对不同患者的外周血及组织中CCDC12进行了检测,并对其意义进行了分析。
CCDC家族的成员之一,近年来研究发现CCDC家族的多个成员与恶性肿瘤关系密切[2-4]。本研究显示,在肿瘤组织及外周血中CCDC12蛋白均存在表达增高,且复发组患者外周血的CCDC12水平更高,而手术切除肿瘤后外周血CCDC12水平明显降低;进一步分析还发现CCDC12在手术组肿瘤组织与术前外周血中表达存在正相关。这些结果提示CCDC12参与了结直肠癌的进展,检测外周血CCDC12水平可反映患者病情,CCDC12有可能作为新的肿瘤标志物进行临床推广,但具体情况还有待深入研究。
为初步分析CCDC12在结直肠癌中的调控机制,本研究还检测了组织及外周血中多配体蛋白聚糖-1(syndecan-1,SDC-1)、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)的表达情况。SDC-1可调节肿瘤的进展,在肿瘤的增殖、侵袭、黏附等多种过程中均发挥了作用,SDC-1在结直肠癌中表达减低是预后不良的标志[7]。MMP-9是基质金属蛋白酶家族(MMPs)的重要成员之一,该基因可通过降解细胞外基质促进肿瘤的侵袭迁移,研究发现MMP-9在结直肠癌肿瘤组织中具有高表达现象[8]。本结果发现,复发组、对照组外周血SDC-1、MMP-9水平有显著差异,复发组水平最高,手术组术前次之,对照组最低;手术后SDC-1、MMP-9水平明显下降至对照水平。免疫组化结果显示SDC-1在复发组表达强度最低、手术组次之,在正常结直肠黏膜中阳性率最高;MMP-9在手术组、复发组中表达均比对照组增强。这些结果说明SDC-1、MMP-9参与了结直肠癌的进展。相关分析显示,手术组肿瘤组织中CCDC12与MMP-9呈正相关,在手术组术前外周血中CCDC12与SDC-1、CCDC12与MMP-9均呈正相关,提示CCDC12与SDC-1、MMP-9之间存在调控关系,但具体分子机制还应深入研究。
总之,本研究发现CCDC12在结直肠癌患者的肿瘤组织及外周血均存在表达增高,手术后CCDC12在外周血水平降低,在复发患者外周血中又明显升高,提示CCDC12可能作为新的结直肠癌标志物。CCDC12可能通过与SDC-1、MMP-9协同作用而参与了肿瘤的进展。但本研究检测的例数不多,也没有进行深入的机制研究,故本文的结论还有待进一步证实。
1 Bode AM,Dong Z,Wang H.Cancer prevention and control:alarming challenges in China.Natl Sci Rev,2016,3:117-127.
2 Gong Y,Qiu W,Ning X,et al.CCDC34 is up-regulated in bladder cancer and regulates bladder cancer cell proliferation,apoptosis and migration.Oncotarget,2015,6:25856-25867.
3 Liu Y,Kheradmand F,Davis CF,et al.Focused Analysis of Exome Sequencing Data for Rare Germline Mutations in Familial and Sporadic Lung Cancer.J Thorac Oncol,2016,11:52-61.
4 Yin de T,Xu J,Lei M,et al.Characterization of the novel tumor-suppressor gene CCDC67 in papillary thyroid carcinoma.Oncotarget,2016,7:5830-5841.
5 Ke J,Lou J,Zhong R,et al.Identification of a Potential Regulatory Variant for Colorectal Cancer Risk Mapping to 3p21.31 in Chinese Population.Sci Rep,2016,6:25194.
6 Chen W,Zheng R,Zeng H,et al.The incidence and mortality of major cancers in China,2012.Chin J Cancer,2016,35:73.
7 Mitselou A,Skoufi U,Tsimogiannis KE,et al.Association of syndecan-1 with angiogenesis-related markers,extracellular matrix components,and clinicopathological features in colorectal carcinoma.Anticancer Res,2012,32:3977-3985.
8 Jin H,Li XJ,Park MH,et al.FOXM1-mediated downregulation of uPA and MMP9 by 3,3'-diindolylmethane inhibits migration and invasion of human colorectal cancer cells.Oncol Rep,2015,33:3171-3177.
10.3969/j.issn.1002-7386.2017.23.023
项目来源:河北省科学技术研究与发展指导计划项目(编号:162777218)
050051 石家庄市,河北省人民医院
R 735.37
A
1002-7386(2017)23-3605-03
2017-06-19)

