Krt7和p16在宫颈病变进展中的临床意义
美丽古丽·莫合买提,彭书敏,詹光熙,郭晓青*
(1石河子大学医学院,新疆 石河子 832000;2同济大学附属第一妇婴保健院,上海 200040)
Krt7和p16在宫颈病变进展中的临床意义
美丽古丽·莫合买提1,彭书敏1,詹光熙1,郭晓青2*
(1石河子大学医学院,新疆 石河子 832000;2同济大学附属第一妇婴保健院,上海 200040)
为探讨Krt7和p16在宫颈病变进展和临床诊治中的意义。收集慢性宫颈炎、宫颈低级别鳞状上皮内病变(Low-grade Squamous Intraepithelial Lesion,LSIL)、宫颈高级别鳞状上皮内病变(High-grade Squamous Intraepithelial Lesion,HSIL)和宫颈癌的石蜡标本及临床资料,免疫组织化学法检测石蜡组织中Krt7和p16的表达,统计分析Krt7和p16的表达与慢性宫颈炎、LSIL、HSIL和宫颈癌的相关性。结果显示,Krt7在慢性宫颈炎、LSIL、HSIL和宫颈癌中的阳性表达率呈逐渐递增的趋势,依次为 24%(10/41)、13%(4/30)、71%(31/44)、88%(22/25),差异具有统计学意义(P<0.05);Krt7 阳性表达率在LSIL与HSIL、LSIL与宫颈癌、HSIL与宫颈癌之间存在统计学差异(P<0.001),但在宫颈炎与LSIL之间没统计 学差异(P=0.251);p16在慢性宫颈炎、LSIL、HSIL和宫颈癌中的阳性表达率呈现逐渐递增的趋势,依次为39%(16/41)、60%(18/30)、88.6%(39/44)、100%(25/25),差异具有统计学意义(P<0.05);p16阳性表达率在慢性宫颈炎与 LSIL,LSIL与 HSIL,LSIL与宫颈癌,HSIL与宫颈癌之间均存在统计学差异(P<0.001);Krt7和p16均阳性表达者在慢性宫颈炎、LSIL、HSIL、宫颈癌中的比例分别为 2.44%(1/41)、3%(3/30)、68.18%(30/44)、88.00%(22/25),差异具有统计学意义(P<0.05)。Krt7、p16、联合检测 Krt7和p16诊断宫颈病变的ROC曲线下面积分别为0.67、0.72、0.23(P<0.01)。结论:Krt7表达阴性的LSIL,进展为HSIL或宫颈癌的风险可能较低,无需临床过多干预治疗;Krt7表达阳性的LSIL进展成HSIL或宫颈癌的风险可能较高,应当引起临床重视;联合检测Krt7和p16,可能在临床中能更有效的筛选出进展为HSIL的高危人群。
宫颈病变;Krt7;p16;宫颈癌;治疗随访
宫颈癌是最常见的妇科恶性肿瘤之一,发病率位于女性恶性肿瘤第二位,高危型人乳头瘤病毒(HR-HPV)持续感染是其主要病因[1]。近10年来,由于宫颈防癌筛查的普及,癌前病变的检出率呈现上升趋势,我国 LSIL的发病率约为 3.1%,HSIL为2.5%[1]。目前认为HSIL是宫颈癌的癌前病变,LSIL多会自然消退,但亦有高达13%的LSIL可进展为HSIL[2-6]。如何有效预测筛选LSIL进展为HSIL、HSIL进展为宫颈癌的高危人群,有针对性的实施手术治疗,是目前临床较为棘手的问题。
宫颈病变和宫颈癌的发生与HR-HPV感染相关,其主要通过干扰细胞的正常周期监测机制,使细胞获得异常增殖能力而发生恶性转化[7]。p16属于cyclin-CDK复合物的特异性抑制剂,作为关键因子参与调控细胞周期进程[8];在宫颈病变中其异常表达常与HPV感染密切相关,已作为目前病理诊断HPV感染的标记物;p16在HSIL和宫颈癌中几乎普遍异常表达,但在LSIL中也有较高表达,因此对诊断宫颈病变缺乏特异性[9-10]。临床发现,有高达90%宫颈癌发生于宫颈鳞柱交界形成的转化区[11-12],有研究发现在胚胎期Krt7蛋白表达遍布于整个宫颈上皮细胞,到成人期其表达仅局限于宫颈鳞柱交界区内一些连续的单层立方样上皮细胞,推测Krt7可能是宫颈表面上皮的胚胎起源标记物[13]。研究还发现,随着宫颈病变程度的加重Krt7的表达呈现递增趋势,预示Krt7的表达与HSIL和宫颈癌的发生、进展密切相关[14]。因此,本研究拟通过免疫组化检测并分析Krt7和 p16在慢性宫颈炎、LSIL、HSIL及宫颈癌中的表达,探讨Krt7和p16作为标记物预测LSIL进展为HSIL、HSIL进展为宫颈癌的有效性。
1 材料与方法
1.1 材料来源
随机选取石河子大学医学院第一附属医院2013年 1月至2015年9月送检的手术标本,其中慢性宫颈炎41例,LSIL 30例,HSIL 44例,宫颈癌25例(其中鳞癌22例,腺癌3例)。所有患者年龄为20~76岁,平均48岁。以上病例均无其他恶性肿瘤疾病史,临床资料及病理资料完整。
鼠单克隆抗体 Krt7(美国,Abcam,ab68459)和兔单克隆抗体 p16(美国,Abcam,ab151303),抗体稀释液、TBST 及二抗(上海,基因科技),DAB 显色剂(美国,Cell Signaling)。
1.2 免疫组化染色
采用EnVision二步法检测。常规脱蜡,放入枸橼酸缓冲液(10 mmol/L,pH值为 6.0),微波炉加热16 min抗原修复。分别滴加抗体,4℃过夜。磷酸盐缓冲液(PBS,pH 值为 7.4)漂洗 10 min,EnVision二抗(1∶100),37 ℃孵育 30 min,二氨基联苯胺(DAB)显色,苏木精复染,常规脱水,透明,封片。用已知前列腺癌和直肠癌作Krt7和p16的阳性对照,用子宫内膜癌肉瘤作Krt7的阴性对照。
1.3 结果判定
Krt7表达于胞浆,阳性表达呈浅棕、深棕色,p16表达于胞浆和/或胞核 ,呈浅棕、深棕色。采用半定量积分判定结果,光镜下按每高倍镜(×400)视野阳性细胞百分比计分:阳性细胞数<5% 为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。根据细胞染色强度将结果分为:淡黄色为1分,棕黄色为2分,棕褐色为3分;两种计分的乘积即为阳性强度:0分为阴性 (-),1~4分为弱阳性 (+),5~8分为中度阳性 (++),9~12分为强阳性 (+++),其中 (-)为阴性组,(+),(++)和 (+++)为阳性组。所有切片均由两位病理学医师阅片,两位医师意见不一致时请第三位病理学专家阅片,最终确定结果。
1.4 统计学方法
所有数据的统计分析使用SPSS20.0,计算各组阳性率,计数资料用率、百分比表示,两两比较的数据校正使用非参数检验分析,进行各组间差异性比较;不同组间间的差异性分析使用χ2检验。
2 结果
2.1 慢性宫颈炎、LSIL、HSIL、宫颈癌中Krt7的表达情况
通过免疫组化分别检测慢性宫颈炎、LSIL、HSIL、宫颈癌中Krt7的表达情况(图1)。Krt7在慢性宫颈炎、LSIL、HSIL和宫颈癌中的阳性表达率呈现逐渐递增的趋势,依次为 24%(10/41)、13%(4/30)、71%(31/44)、88%(22/25),各组间具有统计学差异(P<0.05);Krt7阳性表达率在 LSIL与 HSIL,LSIL与宫颈癌,HSIL与宫颈癌之间存在统计学差异(P<0.001)(表 1)。
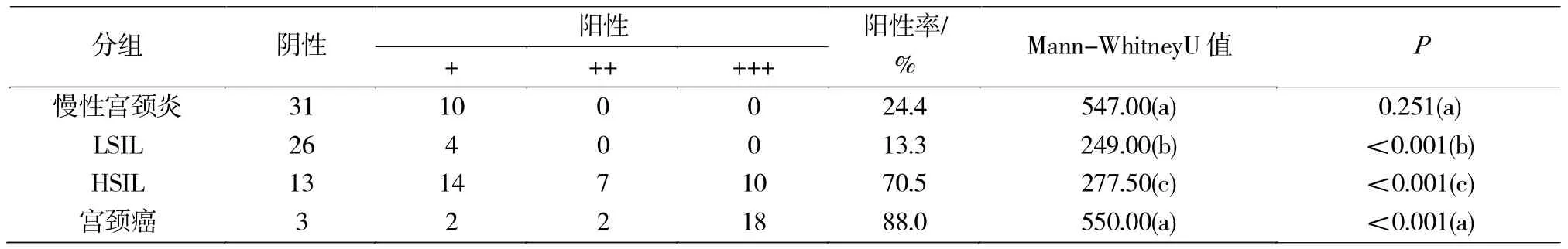
表1 Krt7在慢性宫颈炎、LSIL、HSIL、宫颈癌中的表达情况Tab.1 Expression of Krt7 in chronic cervicitis,LSIL,HSIL,cervical cancer

图1 IHC检测 Krt7在慢性宫颈炎、LSIL、HSIL、宫颈癌中的表达×400Fig.1 The expression of Krt7 was detected by IHC
2.2 慢性宫颈炎、LSIL、HSIL、宫颈癌中p16的表达情况
通过免疫组化分别检测慢性宫颈炎、LSIL、HSIL、宫颈癌中 p16的表达情况(图 2),p16在慢性宫颈炎、LSIL、HSIL和宫颈癌中的阳性表达率呈现逐渐递增的趋势,依次为39%(16/41)、60%(18/30)、88.6%(39/44)、100%(25/25),各组间具有统计学差异(P<0.05);p16阳性表达率在慢性宫颈炎与 LSIL,LSIL与HSIL,LSIL与宫颈癌,HSIL与宫颈癌之间均存在统计学差异(P<0.001)(表2)。
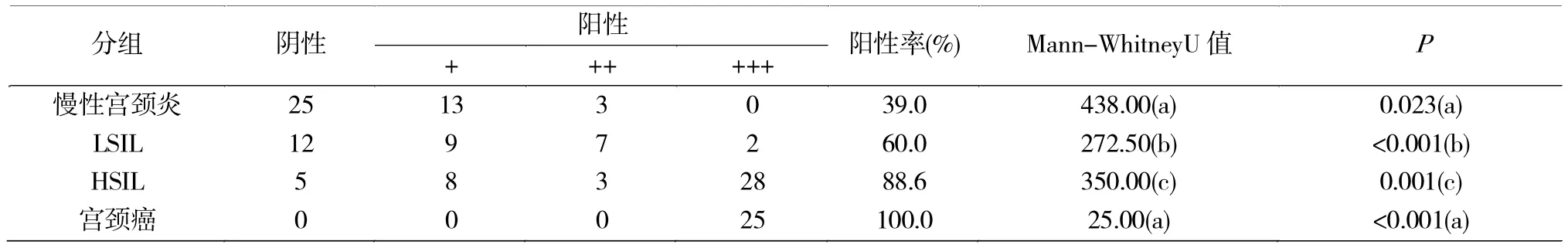
表2 P16在慢性宫颈炎、LSIL、HSIL、宫颈癌中的表达情况Tab.2 Expression of p16 in chronic cervicitis,LSIL,HSIL,cervical cancer

图2 p16在慢性宫颈炎、LSIL、HSIL、宫颈癌中的表达情况×400Fig.2 The expression of p16 was detected by IHC
2.3 慢性宫颈炎、LSIL、HSIL、宫颈癌中Krt7和p16共表达情况
对各组中两种蛋白表达进行分析发现,Krt7和p16共阳性在慢性宫颈炎、LSIL、HSIL、宫颈癌中的比例 分 别 为 2.44%(1/41)、3%(3/30)、68.18%(30/44)、88.00%(22/25),阳性表达率呈现逐渐递增的趋势,各组间的差异具有统计学意义(P<0.05)(表3)。

表3 Krt7和p16均阳性在慢性宫颈炎、LSIL、HSIL、宫颈癌中的阳性表达率Tab.3 The positive rates of both Krt7 and p16
3 讨论
近年来,随着我国宫颈防癌筛查的普及和癌前病变的早期治疗,使得宫颈癌发病率呈下降趋势,但越来越多的年轻妇女检出不同程度的宫颈病变。美国病理学会 (CAP)和美国阴道镜和病理协会(ASCCP)联合发表共识,将宫颈病变采用两级命名法分为LSIL和HSIL,宫颈病变的精准分级对于临床治疗决策至关重要[15]。LSIL具有自限性,其中60%-85%会自然消退,故目前以随访观察作为其主要的治疗方法,但最终有约13%的LSIL会进展为HSIL;HSIL进展为宫颈癌的几率约为5%,但由于缺乏有效的分流指标,临床常对HSIL均进行干预治疗,手术切除部分宫颈 (LEEP或CKC)将导致术后流产和早产风险升高[16]。因此,目前临床亟需找出有效筛选并能预测进展为HSIL和宫颈癌的可靠标记物。
肿瘤干细胞学说是目前肿瘤研究中的重要学说之一,该学说认为肿瘤由异质性的细胞群体构成;其中存在极少量具有干细胞特质的癌细胞亚群,具有多向分化、无限增殖及自我更新能力,是肿瘤发生、进展、转移及化疗耐药的根源[17-18]。关于肿瘤干细胞的起源目前尚存在争议,有学说认为其来源于胚胎源性干细胞的致瘤性突变,有学说认为其来源于已经分化成熟的体细胞重新去分化,获得了类似干细胞的特性并发生恶变[19-20]。
角蛋白7(Krt7)是角蛋白基因家族的成员,由II型细胞角蛋白由碱基或中性蛋白组成,在上皮组织分化期的异型角蛋白链表达。Krt7具有重要的生物学功能,包括细胞骨架重构、DNA复制、细胞周期调控及基因表达的调节。Michael Herfs等[13-14]发现Krt7在胚胎时期遍布于整个宫颈上皮,到成人期其表达仅局限于宫颈鳞柱交界区内一些连续的单层立方样上皮细胞,推测Krt7可能是宫颈表面上皮胚胎源性干细胞标记物,进一步研究发现Krt7的表达与HSIL和宫颈癌的发生、进展密切相关。本研究发现Krt7在慢性宫颈炎、LSIL、HSIL、宫颈癌中的阳性表达率呈逐渐递增趋势,这与Michael Herfs的研究结果相符;此外,统计分析发现Krt7在慢性宫颈炎与LSIL的阳性率没有统计学差异,而在LSIL与HSIL,LSIL与宫颈癌、HSIL与宫颈癌之间具有统计学差异;由此推测Krt7表达阳性的LSIL进展成HSIL或宫颈癌的风险可能较高。因此,我们推测Krt7表达阳性的细胞一旦发生病变,最终进展为宫颈癌前病变甚至宫颈癌的可能性较高。但本研究中Krt7在3例宫颈腺癌中均不表达,由于入组病例较少,需进一步扩大样本量,以判断该标记物在预测宫颈腺癌进展中的作用。
在宫颈病变中,HPV主要通过干扰正常细胞周期的监测机制,使细胞获得异常增殖能力而发生恶性转化。研究发现,转化期HPV整合入宿主的DNA后,能特异性地结合并使Rb通路失活,pRb的失活导致细胞中肿瘤抑制因子p16的表达增加,细胞周期监控作用受到抑制,使得细胞呈现病理性增殖,最终发生瘤变,因此p16在绝大多数的宫颈癌前病变和宫颈癌中高表达[21]。目前已广泛用于临床病理诊断HPV感染的标记物,但其在LSIL、HSIL和宫颈癌中几乎普遍表达,对宫颈病变的诊断缺乏特异性[7]。本研究发现p16在慢性宫颈炎、LSIL、HSIL和宫颈癌中的阳性表达率呈逐渐递增趋势,且在慢性宫颈炎与 LSIL,在 LSIL与 HSIL,LSIL与宫颈癌、HSIL与宫颈癌均具有统计学差异。结合Krt7结果进行统计分析发现,Krt7和p16均为阳性在慢性宫颈炎和LSIL中比例仅为2.44%和10%,而在HSIL和宫颈癌中比例高达68.18%和88.00%,由此推测,Krt7和p16均为阳性今后进展为HSIL及宫颈癌的风险可能较大。
综上所述,Krt7表达阴性的LSIL,进展为HSIL或宫颈癌的风险可能较低,可能无需临床干预;Krt7表达阳性的LSIL进展成HSIL或宫颈癌的风险可能较高,应当引起临床重视;联合检测Krt7和p16的表达,可能在临床中能更有效的筛选出进展为HSIL的高危人群。
[1]Zhao F H.Prevalence of human papillomavirus and cervical intraepithelial neoplasia in China:a pooled analysis of 17 population-based studies[J].Int J Cancer,2012,131(12):2929-2938.
[2]Bansal N.Natural history of established low grade cervical intraepithelial (CIN 1)lesions[J].Anticancer Res,2008,28(3):1763-1766.
[3]Chen E Y.Histological'progression'from low(LSIL)to high(HSIL)squamous intraepithelial lesion is an uncommon event and an indication for quality assurance review[J].Mod Pathol,2010,23(8):1045-1051.
[4]Cox J T.Prospective follow-up suggests similar risk of subsequent cervical intraepithelial neoplasia grade 2 or 3 among women with cervical intraepithelial neoplasia grade 1 or negative colposcopy and directed biopsy[J].Am J Obstet Gynecol,2003,188(6):1406-1412.
[5]HolowatyP.Naturalhistoryofdysplasiaoftheuterine cervix[J].J Natl Cancer Inst,1999,91(3):252-258.
[6]Schlecht N F.Human papillomavirus infection and time to progression and regression of cervical intraepithelial neoplasia[J].J Natl Cancer Inst,2003,95(17):1336-1343.
[7]Negri G.p16INK4a expression and progression risk of lowgrade intraepithelial neoplasia of the cervix uteri[J].Virchows Arch,2004,445(6):616-620.
[8]Khoo C M.Ink4a/Arf tumor suppressor does not modulate the degenerative conditions or tumor spectrum of the telomerasedeficient mouse[J].Proc Natl Acad Sci USA,2007,104(10):3931-3936.
[9]Galgano M T,et al.Using biomarkers as objective standards in the diagnosis of cervical biopsies.Am J Surg Pathol,2010,34(8):1077-1087.
[10]Keating J T.Ki-67,cyclin E,and p16INK4 are complimentary surrogate biomarkers for human papilloma virusrelated cervical neoplasia[J].Am J Surg Pathol,2001,25(7):884-891.
[11]Marsh M.Original site of cervical carcinoma topographical relationship of carcinoma of the cervix to the external os and to the squamocolumnar junction[J].Obstet Gynecol,1956,7(4):444-452.
[12]Richart R M.Cervical intraepithelial neoplasia[J].Pathol Annu,1973(8):301-328.
[13]Herfs M.A discrete population of squamocolumnar junction cells implicated in the pathogenesis of cervical cancer[J].Proc Natl Acad Sci USA,2012,109(26):10516-10521.
[14]Herfs M.Cervical squamocolumnar junctionspecific markers define distinct,clinically relevant subsets of lowgrade squamous intraepithelial lesions[J].Am J Surg Pathol,2013,37(9):1311-1318.
[15]Nasierowska-Guttmejer A.Polish recommendations regarding diagnostics and treatment of cervical squamous intraepithelial lesions according to the CAP/ASCCP guidelines[J].Ginekol Pol,2016,87(9):676-682.
[16]Kyrgiou M.Obstetric outcomes after conservative treatment for intraepithelial or early invasive cervical lesions:systematic review and metaanalysis[J].Lancet,2006,367(9509):489-498.
[17]Visvader J E,Lindeman G J.Cancer stem cells in solid tumours:accumulating evidence and unresolved questions[J].Nat Rev Cancer,2008,8(10):755-768.
[18]Lobo N A.The biology of cancer stem cells[J].Annu Rev Cell Dev Biol,2007,23:675-699.
[19]Podberezin M J,Chang C C,Cancer stem cells:a review of potential clinical applications[J].Arch Pathol Lab Med,2013,137(8):1111-1116.
[20]Nguyen L V.Cancer stem cells:an evolving concept[J].Nat Rev Cancer,2012,12(2):133-143.
[21]Gupta N R S,Rajwanshi A.Functional biomarkers in cervical precancer:an overview[J].Diagn Cytopathol,2010,38(8):618-623.
The clinical significance of Krt7 and p16 in the progression of cervical lesions
Meiliguli Mohemaiti1,Peng Shumin1,Zhan Guangxi1,Guo Xiaoqing2*
(1 School of Medicine,Shihezi University,Shihezi,Xinjiang 832000,China;2 First maternity and infant hospital affiliated to Tongji University,Shanghai 200040,China)
To explore the clinical diagnosis and treatment significance of Krt7 and p16 in cervical lesions progression.Paraffin specimens and clinical data of chronic cervicitis tissues,cervical low grade squamous intraepithelial lesion(LSIL)tissues,cervical high grade squamous intraepithelial lesion(HSIL)tissues and cervical cancer tissues were collected,immunohistochemical staining(IHC)was used to detect the expression of Krt7 and p16 in these specimens.Statistical analysis was performed to evaluate the expression levels of Krt7 and p16,and their correlation with chronic cervicitis,LSIL,HSIL and cervical cancer.The positive expression rates of Krt7 in chronic cervicitis,LSIL,HSIL and cervical cancer were gradually increased by 24%(10/41),13%(4/30),71%(31/44),88% (22/25),the differences were statistically significant(P<0.05);and the positive expression rate of Krt7 was statistically different between LSIL and HSIL,LSIL and cervical cancer,HSIL and cervical cancer(P<0.001),however,there was no significant difference between cervicitis and LSIL(P=0.251);The positive expression rates of p16 in chronic cervicitis,LSIL,HSIL and cervical cancer were gradually increased by 39%(16/41),60%(18/30),88.6%(39/44),100%(25/25)(P<0.05),and the difference was statistically significant (P<0.05);The positive rate of chronic cervicitis and LSIL,LSIL and HSIL,LSIL and cervical cancer,HSIL and cervical cancer were statistically different(P<0.001);The positive rates of both Krt7 and p16 were 2.44%(1/41),3%(3/30),68.18%(30/44)and 88.00%(22/25)in chronic cervicitis,LSIL,HSIL and cervical cancer,the difference was statistically significant(P<0.05).The risk of Krt7-negativeprogressing to HISL or cervical cancer was low,while the risk of Krt7-positive developing to HISL or cervical cancer was high.Moreover,Krt7-positive should get clinical attention.Compared with Krt7 or P16 alone,the combined detection of Krt7 and p16 may helpful to patients for clinical screening in potential progressing to HSIL.
cervical lesion;Krt7;p16;cervical cancer;follow-up and treatment
R711.74
A
10.13880/j.cnki.65-1174/n.2017.05.011
1007-7383(2017)05-0585-08
2017-03-24
上海市卫生和计划生育委员会科研课题重点项目(201540386)
美丽古丽·莫合买提(1984-),女,硕士研究生,专业方向为妇产科学。
*通信作者:郭晓青(1966-),女,教授,从事妇科肿瘤研究,e-mail:Xiaoqing_Guo@163.com。

