辛伐他汀增强阿司匹林对胶原诱导的血小板活化抑制作用的研究
都虹 郝杰 呼海娟 鲁静朝 杨秀春 崔炜 刘凡
辛伐他汀增强阿司匹林对胶原诱导的血小板活化抑制作用的研究
都虹 郝杰 呼海娟 鲁静朝 杨秀春 崔炜 刘凡
目的 探讨他汀类药物联合阿司匹林体外孵育对胶原诱导的血小板活化的影响。方法 采集河北医科大学第二医院门诊健康成人志愿者外周静脉血,制备血小板悬液,应用全血阻抗法、流式细胞术、Elisa等方法测定不同浓度辛伐他汀或普伐他汀单独或联合阿司匹林共同孵育对血小板聚集及活化的影响。结果 辛伐他汀体外孵育可降低胶原诱导的血小板聚集率,联合阿司匹林,可进一步降低胶原诱导的血小板活化标志物表达及血栓素TXB2合成。结论 辛伐他汀体外孵育可抑制胶原诱导的血小板活化,与阿司匹林联合,可进一步增强后者对血小板聚集的抑制作用。
辛伐他汀;普伐他汀;胶原;血小板聚集;血小板活化
羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂(简称他汀类药物)是临床常用的调脂类药物。目前研究证实,他汀类药物具有多种疗效显著的抗动脉粥样硬化作用,称之为他汀类药物的“多效性”,其中包括抗血小板作用。已有研究表明,血脂水平特别是低密度脂蛋白水平增高与血小板活化密切相关,因此,高脂血症患者处于易栓状态,其血栓发生概率明显增加[1]。他汀类药物可通过降低胆固醇水平抑制血小板活化,此外还可通过直接作用抑制血小板功能[2],然而,所涉及的相关机制尚不十分明确。
阿司匹林是传统的抗血小板药物,可通过抑制环氧化酶而减少血栓素A2(TXA2)的产生从而发挥抗血小板作用。目前阿司匹林作为抗血小板的一线用药,广泛应用于临床。本研究通过探讨辛伐他汀或普伐他汀联合阿司匹林体外孵育对胶原诱导的血小板活化的作用及对血栓素生成的影响,力求从新的角度阐述此类药物对血小板功能的影响。
1 材料与方法
1.1 药品仪器 辛伐他汀(Simvastatin)、普伐他汀(Pravastatin)及阿司匹林(Asprin)购自 Sigma公司,全血血小板聚集仪(MODEL-590)及胶原购自CHRONO-LOG公司,单克隆抗体anti-CD61/Per-CP、anti-CD62/PE及PAC-1/FITC购自美国Becton Dickinson 公司,血栓素 B2(TXB2)Elisa试剂盒购自上海凯博生化试剂有限公司,血细胞计数仪(MEK-2-7226)购自日本SYSMEX公司,FACSCalibur流式细胞仪购自上海灿溪经贸有限公司。
1.2 方法
1.2.1 血小板悬液制备 采集60例健康志愿者(男性37例,女性23例,平均年龄32.4岁)空腹外周静脉血10 ml,置于3.8%枸橼酸钠抗凝管(静脉血与抗凝剂体积比9∶1),轻轻颠倒1~2次混匀。于室温下以150×g离心10 min,收集上层富血小板血浆(platelet-rich plasma,PRP)。余下血液再以 800×g离心10 min获得贫血小板血浆(platelet-poor plasma,PPP)。用MEK-2-7226血细胞计数仪以PPP调整PRP浓度为3.0×108/ml制备成血小板悬液。
1.2.2 实验分组 采用两种不同种类他汀进行实验,其中辛伐他汀为脂溶性、普伐他汀为水溶性。将制备的血小板悬液与等量不同种类、不同浓度他汀类药物在37℃孵育10 min,再联合或不联合阿司匹林(50 μM/L)37 ℃孵育 5 min,随后测定胶原(2 μg/ml)诱导的血小板聚集、血小板活化标志物表达(CD62P 和 PAC-1)及血栓素 B2(TXB2)的合成。具体实验分组如下:①空白对照组,无他汀类药物及阿司匹林干预;②无阿司匹林组,血小板与不同种类、不同浓度他汀类药物孵育10 min,再加入等量对照孵育5 min;③阿司匹林处理组,血小板与不同种类、不同浓度他汀类药物孵育10 min,再加入阿司匹林孵育5 min。
1.2.3 血小板聚集率 取血小板悬液500 μl分别与10 μl不同浓度辛伐他汀、普伐他汀(浓度范围0~30 μM/L)37 ℃孵育 10 min,再加入 10 μl PBS或阿司匹林(50 μM/L)37℃孵育5 min。采用血小板聚集仪,利用全血阻抗法测定胶原(2 μg/ml)诱导的血小板聚集率,设定磁棒转速为1200 r/min,反应时间>15 min。
1.2.4 流式细胞术 在流式上样管中加入待测血小板悬液 5 μl,按 1∶10 比例用超滤 PBS 稀释(PBS 50 μl),再加入PerCP标记的抗CD61单抗5 μl(标记血小板),以及PE标记的抗CD62P单抗5 μl和FITC标记的抗PAC-1单抗5 μl,轻轻摇动混匀,室温避光孵育20 min,同时做空白对照及同种型阴性对照。加入预冷的1%多聚甲醛200 μl避光固定,4℃放置2 h,用FACS-Calibur流式细胞仪进行检测。
1.2.5 TXB2的测定 用酶联免疫试剂盒测定各组血小板悬液的血栓素B2(TXB2)水平,过程严格按照说明书操作。由于TXA2可迅速降解为TXB2,目前公认的可通过测定后者水平,反映TXA2的生成。
1.3 统计学方法 所有资料应用SPSS 13.0软件包进行分析。用±s表示,采用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 辛伐他汀和普伐他汀对血小板聚集的影响 5 μM/L、15 μM/L、30 μM/L 辛伐他汀体外孵育后胶原诱导的血小板聚集率分别为(57.20±6.01)%、(40.00±5.65)%和(32.00±7.98)%,较无他汀组(65.00±7.46)%明显降低并呈剂量依赖关系(P<0.05)。相同剂量普伐他汀体外恒温孵育后胶原诱导的血小板聚集率分别为(66.00±8.11)%、(64.00±7.54)%和(61.80±6.98)%,与无他汀组比较无显著差异(P>0.05)。联合 5 μM/L、15 μM/L、30 μM/L辛伐他汀及阿司匹林(50 μM/L)共同孵育血小板后胶原诱导的血小板聚集率分别为(41.10±6.22)%、(32.40±6.65)%和(29.20±7.28)%,其中15 μM/L、30 μM/L 辛伐他汀联合阿司匹林组较单纯阿司匹林[(45.00±6.46)%]组血小板聚集率显著降低(P<0.05),而相同剂量普伐他汀与阿司匹林共同孵育血小板后胶原诱导的血小板聚集率分别为(43.30±8.11)%、(47.40±7.25)%和(41.20±7.88)%,较单纯阿司匹林组血小板聚集率未见明显下降(P>0.05)。见图1。
2.2 辛伐他汀和普伐他汀对血小板活化标志物的影响 胶原可引起血小板表面P-选择素(CD62P)及 PAC-1 表达增高 [(82.20±2.77)%和(92.00±3.44)%比阴性对照组(6.45±0.97)%和(7.00±1.12)%,P<0.05],阿司匹林(50 μM/L)体外恒温孵育可降低胶原诱导的血小板表面CD62P及PAC-1表达[(62.30±2.78)%和(63.30±3.44)%比(82.20±2.77)%和(92.00±3.44)%,P<0.05],联合 10 μM/L和30 μM/L辛伐他汀及阿司匹林共同孵育血小板,可进一步降低胶原诱导的血小板CD62P及PAC-1 表达[(53.20±3.47)%比(45.10±2.35)%比(62.30±2.78)%;(50.40±4.23)%比(42.20±3.47)%比(63.30±3.44)%,P<0.05],相同剂量普伐他汀联合阿司匹林共同孵育对CD62P及PAC-1表达无明显 影 响 [(60.40 ±2.35)% 比(63.20 ±3.26)% 比(62.30±2.78)%;(60.10±4.22)%比(58.50±2.79)%比(63.30±3.44)%,P>0.05]。见图2。
2.3 辛伐他汀和普伐他汀对血栓素TXB2合成的影响 辛伐他汀体外孵育可降低胶原诱导的TXB2合成 [(69.7±8.9)ng/ml比阴性对照组(96.4±10.5)ng/ml,P<0.05]。而相同剂量普伐他汀对胶原诱导的血小板内TXB2合成无明显影响[(98.5±9.1)ng/ml 比阴性 对照组(96.4±10.5)ng/ml,P>0.05]。阿司匹林体外孵育血小板可降低胶原诱导的 TXB2 合成 [(74.9±11.2)ng/ml比阴性对照组(96.4±10.5)ng/ml,P<0.05],辛伐他汀联合阿司匹林共同孵育血小板可进一步降低TXB2水平[(58.4±10.3)ng/ml比阿司匹林组(74.9±11.2)ng/ml,P<0.05],而普伐他汀联合阿司匹林共同孵育未观察到类似作用[(72.7±12.4)ng/ml比阿司匹林组(74.9±11.2)ng/ml,P>0.05]。见表1。
表1 他汀联合或非联合阿司匹林体外孵育对胶原诱导的血小板 TXB2 合成的影响(±s)
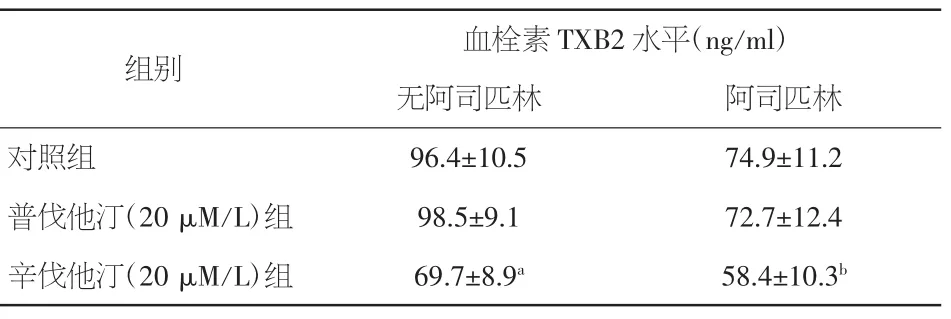
表1 他汀联合或非联合阿司匹林体外孵育对胶原诱导的血小板 TXB2 合成的影响(±s)
注:与对照组比较,aP<0.05;与无阿司匹林组比较,bP<0.05
组别 血栓素 TXB2 水平(ng/ml)无阿司匹林 阿司匹林对照组 96.4±10.5 74.9±11.2普伐他汀(20 μM/L)组 98.5±9.1 72.7±12.4辛伐他汀(20 μM/L)组 69.7±8.9a 58.4±10.3b
3 讨论
他汀类药物是目前临床治疗血脂异常及冠心病等疾病的常用药物。它可以通过抑制脂质合成限速步骤中的β-羟基-β-甲基戊二酰辅酶A(HMGCoA)还原酶,减少甲基戊酸的合成,从而发挥降低胆固醇的作用[3]。目前越来越多的研究证实,他汀类药物除具有调脂作用外,还具有多种抗动脉粥样硬化作用,即所谓他汀类药物的多效性。其中引起广泛关注的,包括近年来发现的他汀类药物具有显著地体内体外抑制血小板活化的作用[4,5]。一方面,他汀类药物可通过调控血小板膜脂质构成影响血小板功能[6];另一方面,他汀类药物应用早期即可对血栓及凝血过程产生影响[7]。因此目前认为,他汀类药物药物具有独立于降脂作用之外的抗血小板作用。
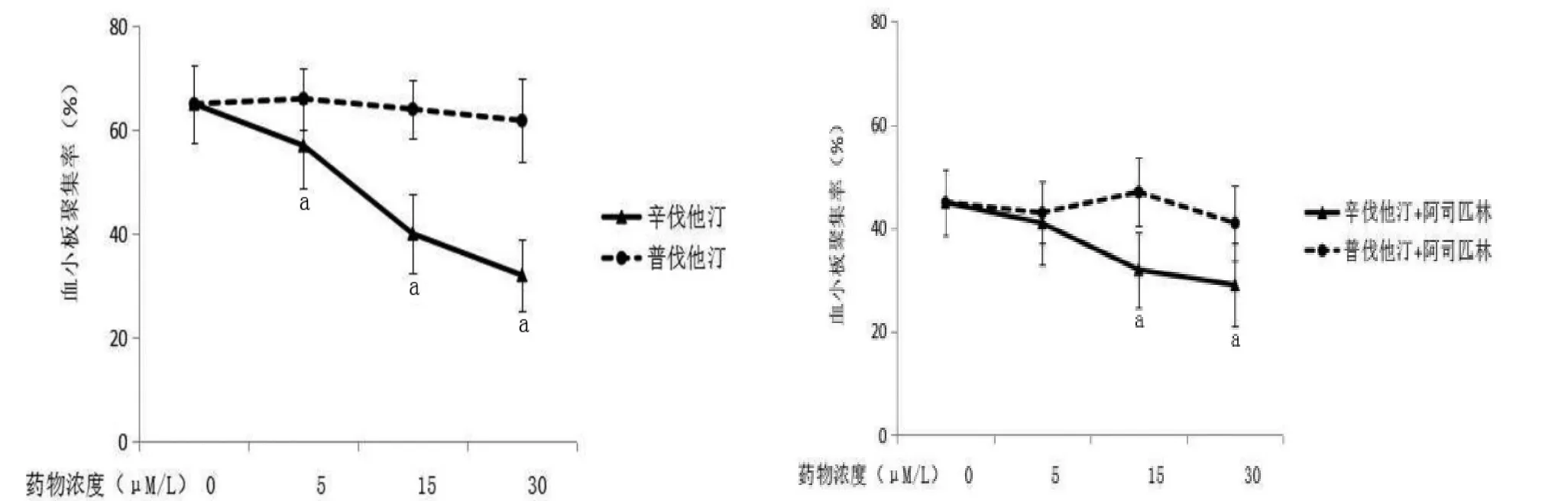
图1 他汀联合或非联合阿司匹林体外孵育对胶原诱导的血小板聚集的影响
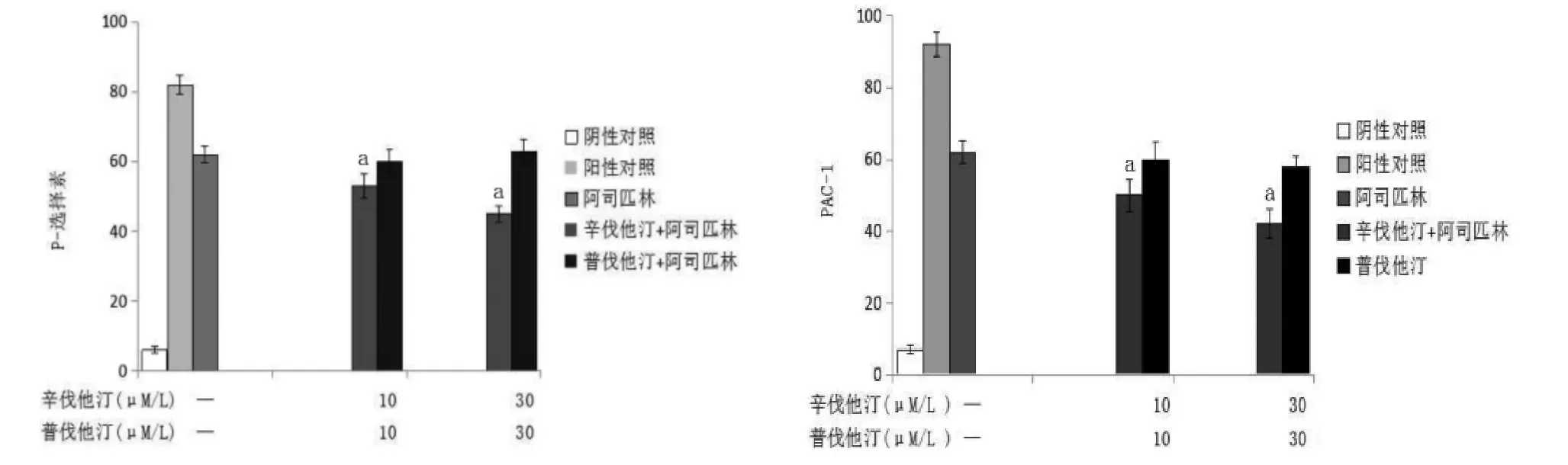
图2 他汀联合阿司匹林体外孵育对胶原诱导的血小板活化标志物表达的影响
胶原是目前公认的血小板聚集诱导剂,当内皮损伤时,细胞外基质蛋白胶原暴露,可通过激活血小板表面胶原受体,最终引起血小板活化,因此在血管损伤局部血小板聚集过程中具有重要作用。通过我们的研究发现,辛伐他汀与普伐他汀相比,能够显著抑制胶原诱导的血小板聚集,这与之前报道的脂溶性他汀具有抗血小板作用一致[8]。并且,通过对血小板活化标志物的测定发现,辛伐他汀与阿司匹林共同孵育可在一定程度上降低胶原诱导的血小板P-选择素(CD62P)表达及血小板PAC-1的水平。血小板活化后,引起脱颗粒反应,使其表面P-选择素表达增高,同时引起GPⅡb/Ⅲa构象改变,进而促进血小板聚集,PAC-1单克隆抗体可直接结合活化血小板中GPⅡb/Ⅲa构象变化所暴露出的纤维蛋白原结合位点[9],因此,P-选择素及PAC-1表达水平反映血小板活化程度。进一步,通过对血小板TXB2水平测定也证实,辛伐他汀可增强阿司匹林对血小板血栓素B2生成的抑制作用,而后者反映血小板血栓素A2的合成。相关临床研究也有类似报道。Santos等[10]报道,接受阿托伐他汀联合阿司匹林治疗的患者较单用阿司匹林治疗者,胶原诱导的血小板聚集及血栓素A2合成明显降低。结合我们的研究发现,脂溶性他汀可通过直接作用影响血小板功能。
此外我们还发现,不同种类他汀对血小板功能可产生不同影响。普伐他汀与辛伐他汀的一个重要区别是,普伐他汀的化学结构中羟基与疏水基相连,从而具有高度亲水性。通过我们的实验发现,普伐他汀体外孵育对血小板聚集无显著抑制作用。此外,普伐他汀与阿司匹林共同孵育也未观察到对胶原诱导的血小板表面活化标志物及TXB2水平的影响。文献报道[11,12],脂溶性他汀,如辛伐他汀及阿托伐他汀等,可通过主动或被动转运进入细胞,而水溶性他汀无法通过被动转运进入细胞。因此,不同种类他汀对血小板功能的不同作用,可能与其分子结构及具有不同的细胞膜渗透性有关,相关机制仍需进一步探讨。
综上所述,本研究发现,辛伐他汀体外孵育可抑制胶原诱导的血小板活化,联合阿司匹林共同孵育,可增强后者对血小板活化的抑制作用。其机制涉及进一步降低血小板表面活化标志物表达及降低血小板血栓素A2的合成。这从一个新的角度阐述了脂溶性他汀对血小板功能的影响,为了解他汀类药物的多效性提供了理论依据。他汀类药物与阿司匹林联合治疗,是否最终通过影响血小板功能使患者临床获益,以及所涉及的具体机制,尚需进一步研究。
[1]Wang N,Tall AR.Cholesterol in platelet biogenesis and activation.Blood,2016,127:1949-1953.
[2]Ali FY,Armstrong PC,Dhanji AR,et al.Antiplatelet actions of statins and fibrates are mediated by PPARs.Arterioscler Thromb Vasc Biol,2009,29:706-711.
[3]Allan GM,Lindbald AJ,Comeau A,et al.Simplified lipid guidelines:Prevention and management of cardiovascular disease in primary care.Can Fam Physician,2015,61:e439-450.
[4]Kitrou P,Katsanos K,Kamabatidis D,et al.Current Evidence and future perspectives on Anti-Platelet and Statin Pharmacotherapy for Patients with Symptomatic Peripheral Arterial Disease.Curr Vasc Pharmacol,2017,4:74-85.
[5]Kessinger CW,Kim JW,Henke PK,et al.Statins improve the resolution of established murine venous thrombosis:reductions in thrombus burden and vein wall scarring.PLoS One,2015,10:e0116621.
[6]Osamah H,Mira R,Sorina S,et al.Reduced platelet aggregation after fluvastatin therapy is associated with altered platelet lipid composition and drug binding to the platelets.Br J Clin Pharmacol,1997,44:77-83.
[7]Smith NL,Harrington LB,Blondon M,et al.The association of statin therapy with the risk of recurrent venous thrombosis.Thromb Haemost,2016,14:1384-1392.
[8]Pawelczyk M,Chmielewski H,Kaczorowska B,et al.The influence of statin therapy on platelet activity markers in hyperlipidemic patients after ischemic stroke.Arch Med Sci,2015,11:115-121.
[9]Lu Q,Malinauskas RA.Comparison of two platelet activation markers using flow cytometry after in vitro shear stress exposure of whole human blood.Artif Organs,2011,35:137-144.
[10]Santos MT,Fuset MP,Ruano M,et al.Effect of atorvastatin on platelet thromboxane A(2) synthesis in aspirin-treated patientswith acute myocardialinfarction.Am J Cardiol,2009,104:1618-1623.
[11] Satoh M,Takahashi Y,Tabuchi T,et al.Cellular and molecular mechanisms of statins:an update on pleiotropic effects.Clin Sci,2015,129:93-105.
[12] Hussner J,Begunk R,Boettcher K,et al.Expression of OATP2B1 as determinant of drug effects in the microcompartment of the coronary artery.Vascul Pharmacol,2015,72:25-34.
Simvastatin improves Aspirin-mediated in vitro blood platelet inhibition
DU Hong,HAO Jie,HU Hai-juan,et al.Department of Cardiology,Second Hospital of Hebei Medical University,Shijiazhuang 050000,China
HAO Jie,E-mail:haojiemed@163.com
ObjectiveTo examine the effects of Simvastatin and Pravastatin on the platelet aggregation stimulated by collagen under in vitro conditions,and analyze the influence of statins on Aspirin-mediated platelet inhibition under such conditions.MethodsBlood samples were donated from healthy volunteers in order to prepare human platelet suspensions.The effects of statins on collagen-induced platelet aggregation,the expression of platelet activation landmarks and the activity of thromboxane B2 were measured by impedance aggregometry,flow cytometric analysis and Elisa.ResultsSimvastatin inhibited the platelet aggregation induced by collagen in vitro conditions.Additionally,Simvastatin improved the inhibition of Aspirin on platelet aggregation,the expression of platelet activation landmarks and the activity of thromboxane B2.ConclusionSimvastatin inhibits the platelet aggregation induced by collagen and improves in vitro Aspirin-mediated platelet inhibition.
Simvastatin;Pravastatin;Collagen;Platelet aggregation;Platelet activation
河北省卫生厅医学科学研究重点课题(项目编号:20130195)
050000 河北省石家庄市,河北医科大学第二医院心内科
郝杰,E-mail:haojiemed@163.com
10.3969/j.issn.1672-5301.2017.11.021
R54
A
1672-5301(2017)11-1040-04
2017-07-07)

