高考电化学解题方法突破
北京 李宏华
高考电化学解题方法突破

电化学知识是历年高考命题必考的考点,这部分知识比较独立,与其他知识的关联比较少,因此希望考生对这部分知识要熟练掌握。高考命题主要以原电池的工作原理、化学电源、电解原理以及应用、电解计算和化学腐蚀等角度进行命题。
一、原电池的工作原理
原电池工作原理中四个常见失分点的规避
(1)只有放热的氧化还原反应才能通过设计成原电池将化学能转化为电能。
(2)电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成了一个完整的闭合回路。
(3)无论在原电池中还是在电解池中,电子均不能通过电解质溶液。
(4)原电池的负极失去电子的总数等于正极得到电子的总数。
【例1】下图是某校实验小组设计的一套原电池装置,下列有关描述不正确的是
( )


B.此装置能将化学能转变为电能
C.电子由Cu电极经导线流向石墨电极


【答案】A
二、原电池原理的应用——化学电源
1.易错探究
(1)原电池反应中,电极材料本身一定发生反应吗?
【提示】不一定。如燃料电池,电极是铂电极,本身不参与反应,参与反应的是H2和O2。
(2)可充电电池充电时电极与外接电源的正负极如何连接?
【提示】应将可充电电池的负极接外电源的负极,正极接外电源的正极。
(3)依据铅蓄电池充、放电原理,说明在放电时电解液中H2SO4的浓度将如何改变?

(4)氢氧燃料电池以KOH溶液作电解质溶液时,工作一段时间后,电解质溶液的浓度如何变化?溶液的pH如何变化?当氢氧燃料电池以H2SO4溶液作电解质溶液时,又会如何变化?

2.“加减法”书写电极反应式
(1)先确定原电池的正负极,列出正负极上的反应物质,并标出相同数目电子的得失。
(2)根据氧化还原反应原理写出电极反应式。
①负极反应
负极失去电子发生氧化反应。注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。若不共存,则该电解质溶液中的阴离子应写入负极反应式。
②正极反应

(3)写出电池总反应方程式。
结合电子守恒将正负极电极反应式相加即得到电池总反应方程式。
(4)若已知电池反应的总反应式,可先写出较易书写的一极的电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的一极的电极反应式,即得到较难写出的另一极的电极反应式。
3.“3步”突破燃料电池电极反应式的书写
第一步:写出电池的总反应式。
燃料电池的总反应与燃料的燃烧反应一致,若产物能和电解质反应则总反应为加和后的反应。
如甲烷燃料电池(电解质为NaOH溶液)的反应式为



第二步:写出电池的正极反应式。
根据燃料电池的特点,一般在正极上发生还原反应的物质是O2,随着电解质溶液的不同,其电极反应式有所不同,大致有以下四种情况:
(1)酸性电解质溶液环境下电极反应式:



(4)熔融碳酸盐(如熔融K2CO3)环境下电极反应式:

第三步:根据电池总反应式和正极反应式,写出负极反应式。
电池反应的总反应式-电池正极反应式=电池负极反应式。因为O2不是负极反应物,因此两个反应式相减时要彻底消除O2。
【例2】交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用。灯塔可用镁海水电池提供能源,其装置如图所示。下列有关海水电池的说法正确的是
( )

A.X可为铁、铜、石墨等电极
11月2日,在第七届绿色农药博览会开幕式上,农业农村部农药检定所党委书记吴国强在致辞中说:“落实中央绿色发展的总体部署和发展绿色农业的要求,农药行业责任重大,必须顺应时代潮流,积极研发、生产、宣传、推广高效、低毒、低残留的环境友好型农药和施药机械,大力发展绿色农药。”
B.每转移2 mol电子,2 mol H+由交换膜左侧向右侧迁移

D.该电池能将化学能全部转化成电能

【答案】C
【方法点拨】电极类型的判断要在明确属于电解池还是原电池基础上来分析的,原电池对应的是正、负两极,电解池对应的是阴、阳两极,根据元素价态变化找出氧化剂与还原产物即可解答。该海水电池的负极材料是金属镁,发生失电子的氧化反应,正极材料的金属活泼性比金属镁差,该电极上发生得电子的还原反应,原电池是将化学能转化为电能的装置。
三、电解原理
1.易错探究
(1)电解时电子通过电解质溶液吗?
【提示】电解质溶液通电电解时,在外电路中有电流(电子)通过,而溶液中是依靠离子定向移动,形成了闭合电路。
(2)电解过程中放H2生碱型和放O2生酸型的实质是什么?
【提示】放H2生碱型的实质是水电离出的H+放电,破坏了水的电离平衡,使OH-浓度增大,放O2生酸型的实质是水电离出的OH-放电,破坏了水的电离平衡,使H+浓度增大。
(3)①要使用惰性电极电解后的NaCl溶液复原,滴加盐酸可以吗?
②要使用惰性电极电解后的CuSO4溶液复原,加入Cu(OH)2固体可以吗?
【提示】电解质溶液的复原应遵循“从溶液中析出什么补什么”的原则,即从溶液中析出哪种元素的原子,则应按比例补入哪些原子。
①电解NaCl溶液时析出的是等物质的量的Cl2和H2,所以应通入氯化氢气体,加入盐酸会引入过多的水。
②同理,使CuSO4溶液复原应加入CuO或CuCO3,而加入Cu(OH)2会使溶液的浓度降低。
2.电解池中方程式书写四个常见失分点的规避
(1)书写电解池中电极反应式时,要以实际放电的离子表示,但书写总电解反应方程式时,弱电解质要写成分子式。
(2)阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。
(3)要确保两极电子转移数目相同,且注明条件“电解”。
(4)电解物质的水溶液时,应注意放电顺序中H+、OH-之后的离子一般不参与放电。
【例3】利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列说法正确的是
( )

A.a为直流电源的负极

D.电解时,H+由阴极室通过阳离子交换膜进入阳极室

【答案】C
四、电解原理的应用
1.电解精炼铜时,阳极泥是怎样形成的?
【提示】粗铜中往往含有锌、铁、镍、银、金等多种金属杂质,当含杂质的铜在阳极不断溶解时,金属活动性位于铜之前的金属杂质,如Zn、Fe、Ni等也会同时失去电子。金属活动性位于铜之后的银、金等杂质,因为失去电子的能力比铜弱,难以在阳极失去电子变成阳离子而溶解,所以当阳极的铜等失去电子变成阳离子溶解之后,银、金等杂质以金属单质的形式沉积在电解槽底部,形成阳极泥。
2.比较下列两种装置有哪些不同?
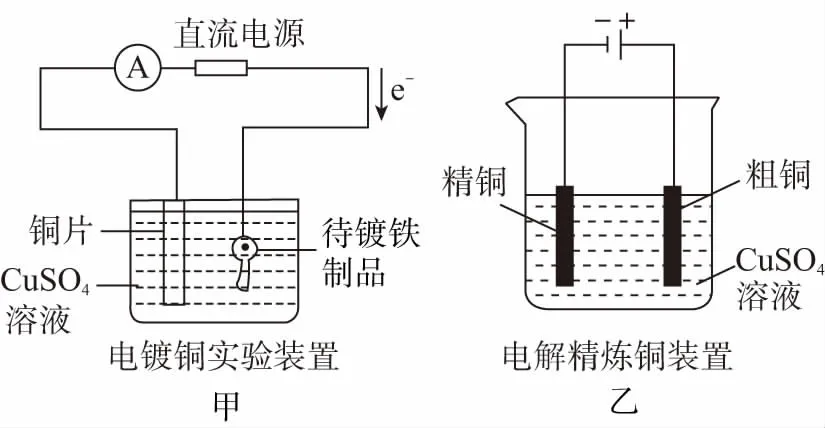
(1)请分析两装置中各电极的质量变化。
(2)请分析两装置中电解质溶液浓度的变化。
【提示】(1)甲图中铜片质量减小,铁制品质量增加;乙图中粗铜质量减小,精铜质量增加。
(2)甲图中CuSO4溶液浓度几乎未变化,因为阳极溶解多少铜,阴极增加多少铜;乙图中CuSO4溶液浓度逐渐变小,因为粗铜中混有Zn、Fe等杂质,放电后转化成Zn2+、Fe2+等离子,此时Cu2+会转化为Cu,造成CuSO4溶液浓度减小。
【例4】水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好而著称,其生产原理示意图如下。下列说法不正确的是
( )


B.解汞室中产生氢气的电极为阴极
C.当阳极产生3.36L(标准状况)气体时,解汞室中生成NaOH的质量为12g
D.在直流电作用下,电解器中的Na+变成金属钠,与水银形成钠汞合金,从而与Cl2分开

【答案】D
五、电解的计算
电化学的综合计算包括:两极产物的定量计算、溶液pH的计算、相对原子质量和阿伏加德罗常数测定的计算、根据电荷量求产物的量、根据产物的量求电荷量等。
【例5】如图装置中X和Y均为石墨电极,电解液为500 mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6 g。下列有关说法中错误的是
( )

A.X电极是阴极
B.Y电极产生气体的体积为0.224 L
C.电解后溶液的pH=1
D.要使电解后溶液恢复到电解前的状态,需加入一定量的CuO或CuCO3


北京市顺义区第八中学)

