外源亚精胺对不同干旱胁迫程度下红椿幼苗生理功能的修复调节
刘 球 ,李志辉 ,吴际友 ,杨硕知 ,吴志华
(1.中南林业科技大学 林学院,湖南 长沙 410004;2.湖南省林业科学院 珍贵树种研究所,湖南 长沙410004;3.国家林业局 桉树研究开发中心,广东 湛江 524022)
外源亚精胺对不同干旱胁迫程度下红椿幼苗生理功能的修复调节
刘 球1,2,李志辉1,吴际友2,杨硕知2,吴志华3
(1.中南林业科技大学 林学院,湖南 长沙 410004;2.湖南省林业科学院 珍贵树种研究所,湖南 长沙410004;3.国家林业局 桉树研究开发中心,广东 湛江 524022)
本研究旨在探讨持续干旱胁迫下外源亚精胺对红椿幼苗生理功能的修复调节效应。以2年生红椿家系盆栽幼苗为试验对象,采取持续干旱和土壤水分测定相结合的方法,在人工遮雨棚中开展干旱胁迫及外源亚精胺调节试验,包括4个处理,即对照处理(土壤相对含水率45%~50%)、轻度干旱胁迫及调节(土壤相对含水率30%~38% +1 mmol/L外源Spd调节)、中度干旱胁迫及调节(土壤相对含水率25%~30% +1 mmol/L外源Spd调节)和重度干旱胁迫及调节(土壤相对含水率20%~25% +1 mmol/L外源Spd调节)。结果表明:(1)在对照、干旱胁迫(轻度、中度和重度)以及喷施外源Spd调节三者之间,红椿幼苗叶片相对电导率、叶绿素含量、相对含水量、MDA含量、POD活性以及游离脯氨酸含量均出现了极显著(p<0.01)差异。(2) 1 mmol/L外源Spd喷施修复重度干旱胁迫下植株形态损伤的速度远低于轻度和中度干旱胁迫植株;(3)喷施1 mmol/L Spd可迅速修复红椿的轻度和中度干旱胁迫损伤并提高植株的持续抗旱能力,但其修复重度干旱胁迫损伤作用效果稍弱,但仍具有较强的胁迫指示响应。在干旱胁迫下,1 mmol/L Spd通过提高叶片保水能力和叶绿素含量,激发抗氧化酶活性,减少细胞内物质的外渗,从而增强了红椿幼苗植株抵抗干旱胁迫的能力。
外源亚精胺;生理调节;红椿;干旱胁迫;抗旱能力
多胺(Polyamines, PAs)是一种高生物活性的低分子量脂肪族含氮碱,常见的多胺包括腐胺(Putrescine,Put)、尸胺(Cadaverine,Cad)、亚精胺(Spermidine,Spd)和精胺(Spermine,Spm)等,普遍存在于植物体中,具有调节植物生长发育、延缓细胞衰老等功能[1-2]。近年来,多项研究表明多胺有抵抗逆境胁迫、延缓叶片衰老等明显作用。张凤[3]等对外源亚精胺可产生的生物抗逆性影响做了较为系统的总结,包括抗高温氧化[4-5]、抗低氧胁迫[6-7]、抗硝酸钙胁迫[8]、抗盐性和生理代谢调节[9]、抗干旱胁迫[10-11]以及抗重金属胁迫[12],亚精胺是植物生长过程中一种至关重要的生物活性物质。作为植物体内一种非常重要的多胺,亚精胺被研究证明其与植物抗逆的关系较其他多胺种类更为密切[13]。
红椿Toona cilliate,楝科香椿属半常绿乔木,是国家II级重点保护植物。红椿是我国热带、亚热带地区所特有的珍贵速生用材树种,其木材红褐色,具有质地坚硬、密度高、花纹美丽等特点,属上等家具用材,素有“中国桃花心木”之美誉。湖南省是红椿天然林分分布省份之一,虽然呈零星分布的状态,但发展潜力巨大[14-16]。近些年来,湖南省林业科学院红椿研究团队针对红椿开展了系统的水分生理研究,吴际友等[17]研究了干旱胁迫对红椿幼苗叶片相对含水量以及叶绿素含量的影响;刘球等[18,15]探讨了干旱胁迫对红椿土壤含水率以及植株受伤害程度的影响,还用典型相关分析的方法分析了红椿幼苗的干旱胁迫和复水响应;陈彩霞等[19-20]系统研究了红椿幼苗的持续干旱胁迫响应和淹水胁迫响应。研究发现,红椿幼苗具有一定的抗旱和抗涝能力,但随着胁迫程度越重,其抵抗能力也越弱;同时也发现,红椿是在经历旱灾和水淹后仍有较大恢复可能性的树种,其干旱和水淹生理恢复调节方面具有很高的研究价值,因此,本研究在现有科研基础上,深入探索外源Spd对红椿抗旱修复调节的影响,为系统研究适合红椿的干旱伤害修复措施提供参考,最终服务于极端气候下的红椿林栽培,服务于红椿人工林高效培育事业。
1 材料与方法
1.1 试验地概况
试验地设在湖南省林业科学院苗圃,海拔为110 m,地理坐标为 112°59′E、28°05′N,年平均气温16.8 ℃,年降水量1 400~1 900 mm,平均日照时数1 496~1 850 h,无霜期达264 d,属于中亚热带季风湿润气候区,雨量丰沛,光照充足;土壤为红壤,土层厚达60 cm以上,肥力中等,pH值为6.2[15]。
1.2 试验材料
本试验材料为2年生红椿家系盆栽苗。2012年3月,课题组开展田间育苗。2014年3月,选择苗高1.0 m、胸径1.8 cm的长势均匀、无病虫害的健康红椿幼苗装盆,盆钵口径25 cm、深20 cm,每盆装土5 kg,比例为黄心土∶泥炭土=2∶1,统一配盆垫,进行正常浇水管护。2014年6—7月,在入盆植株中筛选出长势均匀的红椿幼苗进行干旱胁迫及外源Spd调控试验[15]。
1.3 试验设计
试验采用完全随机设计,4个处理,3次重复,共12盆。以课题组对红椿幼苗实施的预备试验结果为参照,本试验采取持续干旱和土壤水分测定相结合的方法,设置了4个处理的持续干旱胁迫:1)对照处理(CK),即土壤相对含水率45%~50%(每天浇水至饱和状态);2)轻度干旱胁迫,即土壤相对含水率30%~38%(持续自然干旱7 d后所测得土壤相对含水率);3)中度干旱胁迫,即土壤相对含水率25%~30%(持续自然干旱14 d后所测得土壤相对含水率);4)重度干旱胁迫,即土壤相对含水率20%~25%(持续自然干旱21 d后所测得土壤相对含水率);于每天傍晚18:00采用美国便携式土壤含水率测定仪FIELD SCOUT TDR 200的200 mm探针进行盆栽土壤含水率测定;第2天09:00记录植株伤害等级,并采取叶片样品回实验室进行指标测定。本试验设置了不同干旱胁迫程度的外源Spd调节处理:1)轻度干旱外源Spd调节,即轻度干旱结束日起,连续3天傍晚18:00对中度干旱胁迫对象喷施浓度为1 mmol/L的外源Spd水溶液,然后恢复日常生长管护5天(即每天每株保证100mL浇水量);2)中度干旱外源Spd调节,即中度干旱结束日起,连续3天傍晚18:00对中度干旱胁迫对象喷施浓度为1 mmol/L的外源Spd水溶液,然后恢复日常生长管护5天;3)重度干旱外源Spd调节,即重度干旱结束日起,连续3天傍晚18:00对中度干旱胁迫对象喷施浓度为1 mmol/L的外源Spd水溶液,然后恢复日常生长管护5天;处理结束后第2天09:00记录植株伤害等级,并采取叶片样品回实验室进行指标测定。
2014年6月10日正式开始干旱胁迫处理,2014年7月1日干旱胁迫结束;2014年6月17日正式开始外源Spd调节处理,2014年7月4日外源Spd调节处理结束。试验在人工搭建的遮雨棚中进行,以保证植株所需的正常光照和空气条件,同时避免雨水进入,保证棚内外温度一致。
1.4 测定指标及方法
1.4.1 植株伤害等级测定
本研究共将植株叶片伤害指数分为5个等级,即0级(健康)、1级(少数叶片出现萎蔫泛黄)、2级(半数叶片出现萎蔫泛黄)、3级(半数以上叶片出现萎蔫泛黄)和4级(整株萎蔫泛黄并开始凋落)。试验过程中采用肉眼观测判断的方式进行植株伤害程度测定。
1.4.2 叶片生理指标测定
质膜相对透性测定采用电导率法、叶片相对含水率测定采用烘干法、叶绿素含量测定采用浸提法、过氧化物酶(Peroxidase,POD)活性测定采用愈创木酚法、丙二醛(Malonaldehyde,MDA)含量测定采用硫代巴比妥酸法、游离脯氨酸(Free proline,Pro)含量测定采用酸性茚三酮法[21-22]。
1.5 数据分析与处理
数据采用Excel 2007 进行处理、 SPSS 17.0进行方差分析,采用Duncan’s进行多重比较。
2 结果与分析
2.1 外源Spd对干旱胁迫下红椿幼苗植株形态的修复调节
随着干旱胁迫的加剧,红椿幼苗叶片受损升级。轻度干旱和中度干旱对植株叶片损害非常轻微,均处于1级及以下状态(即少数叶片出现萎蔫、泛黄),但中度向重度干旱转变的过程中,植株叶片损害明显加剧,较短的时间迅速升为3级(半数以上叶片出现萎蔫、泛黄)。对各个干旱胁迫植株进行外源Spd喷施调节后,继续对植株叶片损害程度进行跟踪观测和登记,结果显示,伤害得到了缓解和修复,但相比而言重度干旱胁迫下受伤植株修复更慢。
2.2 外源Spd对干旱胁迫下红椿幼苗叶片相对含水量的修复调节
在对照、轻度干旱以及喷施外源Spd调节3个处理之间,红椿幼苗叶片相对含水量呈现极显著差异(p<0.01),由高到低顺序为:喷施外源Spd调节>轻度干旱>对照,相对含水量在喷施外源Spd调节处理下比轻度胁迫高出6.49%。在对照、中度干旱以及喷施外源Spd调节3个处理之间呈现极显著差异(p<0.01),由高到低顺序为:中度干旱>对照>喷施外源Spd调节,相对含水量在喷施外源Spd调节处理下与对照几乎相等。在对照、重度干旱以及喷施外源Spd调节3个处理之间,红椿幼苗叶片相对含水量呈现出极显著差异(p<0.01),由高到低顺序为:喷施外源Spd调节>对照>重度干旱,相对含水量在喷施外源Spd调节处理下比对照高出2.4%,比重度胁迫高出52.15%。说明喷施外源Spd调节对轻度和重度胁迫下植株叶片相对含水量的修复作用明显,尤其是重度胁迫;相反,其对中度胁迫下相对含水量的修复作用弱(见图1)。
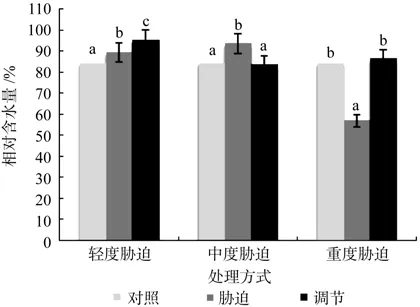
图1 干旱胁迫下外源亚精胺对叶片相对含水量的影响Fig.1 Effects of exogenous Spd on leaf relative water content in Toona ciliata under drought stress
2.3 外源Spd对干旱胁迫下红椿幼苗叶片质膜透性的修复调节
在对照、轻度干旱以及喷施外源Spd调节3个处理之间,红椿幼苗叶片相对电导率呈现极显著差异(p<0.01),由高到低顺序为:喷施外源Spd调节>轻度干旱>对照,相对电导率在喷施外源Spd调节处理下比轻度胁迫高出7.02%。在对照、中度干旱以及喷施外源Spd调节3个处理之间,红椿幼苗叶片相对电导率呈现极显著差异(p<0.01),由高到低顺序为:喷施外源Spd调节>中度干旱>对照,相对电导率在喷施外源Spd调节处理下比中度胁迫高出8.32%,说明轻度、中度胁迫构成的胁迫压力是有限的,外源Spd调节作用并不明显。在对照、重度干旱以及喷施外源Spd调节3个处理之间,红椿幼苗叶片相对电导率呈现极显著差异(p<0.01),由高到低顺序为:重度干旱>喷施外源Spd调节>对照,相对电导率在喷施外源Spd调节处理下比重度胁迫低27.43%,说明重度胁迫下喷施外源Spd能显著降低植株叶片相对电导率,减少细胞内水溶液外渗,修复细胞膜结构(见图2)。
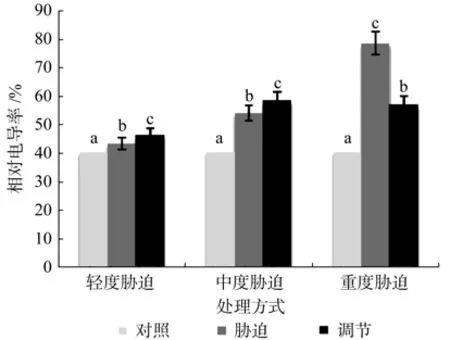
图2 干旱胁迫下外源亚精胺对叶片相对电导率的影响Fig.2 Effects of exogenous Spd on cell membrane permeability of leaf in Toona ciliata under drought stress
2.4 外源Spd对干旱胁迫下红椿幼苗叶片叶绿素含量的修复调节
在对照、轻度干旱以及喷施外源Spd调节3个处理之间,红椿幼苗叶片叶绿素含量存在极显著性差异(p<0.01),由高到低顺序为:对照>喷施外源Spd调节>轻度干旱,叶绿素含量在喷施外源Spd调节处理下比轻度胁迫高出56.52%。在对照、中度干旱以及喷施外源Spd调节3个处理间,红椿幼苗叶片的叶绿素含量存在极显著性差异(p<0.01),由高到低顺序为:对照>中度干旱>喷施外源Spd调节,叶绿素含量在喷施外源Spd调节处理下比中度胁迫低7.51%。在对照、重度干旱以及喷施外源Spd调节3个处理之间,红椿幼苗叶片叶绿素含量存在极显著性差异(p<0.01),由高到低顺序为:对照>喷施外源Spd调节>重度干旱,叶绿素含量在喷施外源Spd调节处理下比重度胁迫高出30.8%。说明喷施外源Spd对红椿幼苗轻度、重度干旱胁迫下叶片叶绿素含量调节作用明显(见图3)。
2.5 外源Spd对干旱胁迫下红椿幼苗叶片过氧化物酶(POD)的修复调节
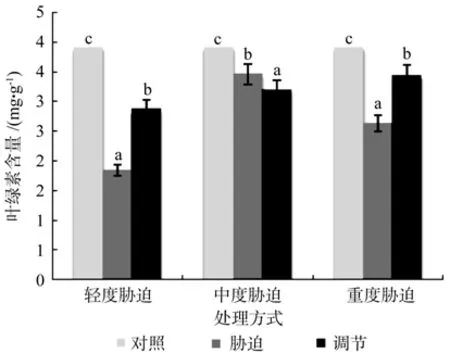
图3 干旱胁迫下外源亚精胺对叶绿素含量的影响Fig.3 Effects of exogenous Spd on leaf chlorophyll content in Toona ciliata under drought stress
在对照、轻度干旱以及喷施外源Spd调节3个处理之间,红椿幼苗叶片POD含量存在极显著性差异(p<0.01),由高到低顺序为:喷施外源Spd调节>轻度干旱>对照,POD含量在喷施外源Spd调节处理下比轻度胁迫高出45.5%。在对照、中度干旱以及喷施外源Spd调节3个处理之间,红椿幼苗叶片POD含量存在极显著性差异(p<0.01),由高到低顺序为:喷施外源Spd调节>对照>中度干旱,POD含量在喷施外源Spd调节处理下比中度胁迫高出55%。在对照、重度干旱以及喷施外源Spd调节3个处理之间,红椿幼苗叶片POD含量极显著性差异(p<0.01),由高到低顺序为:喷施外源Spd调节>重度干旱>对照,POD含量在喷施外源Spd调节处理下比重度胁迫高出25.19%。说明在轻度、中度和重度干旱胁迫下喷施外源Spd调节均促进了红椿幼苗体内产生了大量POD,以较大力度地保护幼苗少受伤害,从而提高了植株的适应性和抗旱性(见图4)。
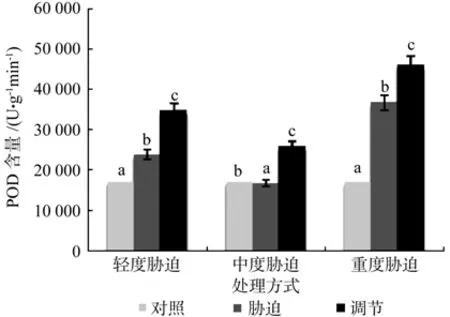
图4 干旱胁迫下外源亚精胺对叶片POD含量的影响Fig.4 Effects of exogenous Spd on leaf POD activity in Toona ciliata under drought stress
2.6 外源Spd对干旱胁迫下红椿幼苗叶片游离脯氨酸含量的修复调节
在对照、轻度干旱以及喷施外源Spd调节3个处理间,红椿幼苗叶片的游离脯氨酸含量存在极显著性差异(p<0.01),由高到低顺序为:轻度干旱>喷施外源Spd调节>对照,游离脯氨酸含量在喷施外源Spd调节处理下比轻度胁迫低了27.66%。在对照、中度干旱以及喷施外源Spd调节3个处理之间,红椿幼苗叶片游离脯氨酸含量极显著性差异(p<0.01),由高到低顺序为:喷施外源Spd调节>中度干旱>对照,游离脯氨酸含量在喷施外源Spd调节处理下比中度胁迫高了4.6%。在对照、重度干旱以及喷施外源Spd调节3个处理之间,红椿幼苗叶片游离脯氨酸含量呈现极显著差异(p<0.01),由高到低顺序为:重度干旱>喷施外源Spd调节>对照,游离脯氨酸含量在喷施外源Spd调节处理下比重度胁迫低了94.84%,且重度干旱下游离脯氨酸含量几乎达到喷施外源Spd调节和对照条件下19倍。说明在轻度干旱胁迫和重度干旱胁迫下,尤其是重度干旱胁迫激发了红椿幼苗植株渗透调节能力,远远超过喷施外源Spd所起的渗透调节作用(见图5)。
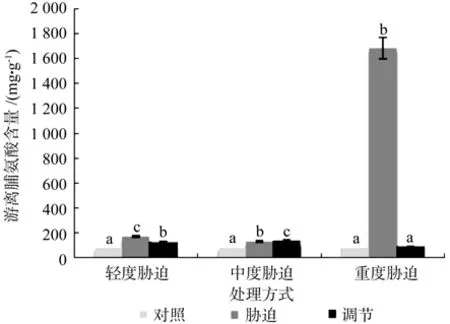
图5 干旱胁迫下外源亚精胺对叶片游离脯氨酸含量的影响Fig.5 Effects of exogenous Spd on leaf proline content in Toona ciliata under drought stress
2.7 外源Spd对干旱胁迫下红椿幼苗叶片MDA含量的修复调节
在对照、轻度干旱以及喷施外源Spd调节3个处理之间,红椿幼苗叶片MDA含量存在极显著性差异(p<0.01),由高到低顺序为:轻度干旱>喷施外源Spd调节>对照,MDA含量在喷施外源Spd调节处理下比轻度胁迫低了36.84%。在对照、中度干旱以及喷施外源Spd调节3个处理之间,红椿幼苗叶片MDA含量呈现极显著性差异(p<0.01),由高到低顺序为:中度干旱>喷施外源Spd调节>对照MDA含量在喷施外源Spd调节处理下比中度胁迫低了32.91%。在对照、重度干旱以及喷施外源Spd调节3个处理之间,红椿幼苗叶片MDA含量呈现极显著差异(p<0.01),由高到低顺序为:喷施外源Spd调节>重度干旱>对照,MDA含量在喷施外源Spd调节处理下比重度胁迫高出52.46%。说明轻度、中度胁迫下喷施外源Spd能显著降低植株体内MDA的积累,缓解胁迫损伤;经历过重度干旱胁迫后的红椿幼苗,在喷施外源Spd调节后,仍显示出较重的胁迫压力,原因是重度干旱给植株造成了很大的伤害,跟轻度、中度干旱胁迫相比,修复难度要大很多(见图6)。
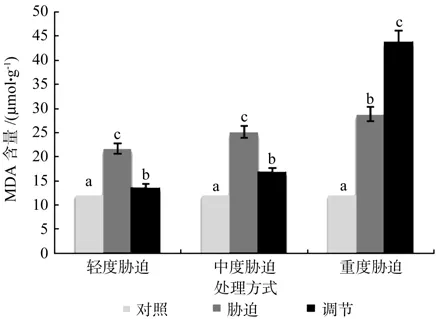
图6 干旱胁迫下外源亚精胺对叶片MDA含量的影响Fig.6 Effects of exogenous Spd on leaf MDA content in Toona ciliata under drought stress
3 讨 论
3.1 喷施外源Spd对红椿叶片相对含水量和叶绿素含量的影响
植株叶片相对含水量的变化幅度取决于植物细胞壁的弹性,细胞壁弹性较强,则收缩力度较大,叶片相对含水量的变化幅度也就越大[23]。然而,在特定的时间条件下,叶片相对含水量的下降幅度越大,则说明其保水能力越弱,耐旱性越差[24]。本试验中,重度干旱胁迫下红椿叶片相对含水量下降幅度较大,喷施外源Spd的调节作用明显,说明喷施外源Spd有助于提高红椿叶片细胞壁的收缩力,增强其保水能力。
叶绿素是植物进行光合作用的主要色素,其含量可反应植物叶片光合能力。干旱胁迫对叶绿素含量的影响是造成植物光合作用降低的重要原因[25]。有研究结果表明,植物在遭受干旱胁迫时,叶绿素含量会随干旱胁迫程度的加重而降低,与本研究结论一致[26-28]。本试验中,轻度干旱胁迫导致叶片叶绿素含量下降幅度最大,其次是重度胁迫,这其中存在不同干旱胁迫处理间试验材料的个体差异,因各干旱胁迫处理的设置是发生在各自独立植株上,因而没有比较性。喷施后叶片叶绿素含量超过轻度胁迫56.5%,超过重度胁迫30.8%;说明喷施外源Spd对调节轻度干旱胁迫下红椿幼苗叶片叶绿素含量的效果最强,其次是重度干旱胁迫。李丽杰等[29]发现,0.1 mmol/L的亚精胺可显著提高20%聚乙二醇(PEG-6000)模拟的干旱胁迫下玉米叶片的叶绿素含量。
3.2 喷施外源Spd对红椿叶片抗氧化酶活性的影响
在干旱胁迫下,植株体内因脱水而产生活性氧等有害物质,使得植株体内活性氧失衡,POD是植物细胞清除活性氧的酶系统重要指标之一,通过清除活性氧以防御逆境对植株细胞膜造成损害[19]。然而,随着胁迫时间的延长或胁迫程度的加剧,POD的活性会降低。本研究中,3种干旱胁迫程度下,以重度胁迫导致植株叶片产生的POD含量最高;喷施外源Spd对3种干旱胁迫处理均有调节作用,喷施后POD 含量均显著高于胁迫状态,说明外源Spd能大幅度提高红椿在重度干旱胁迫下的POD活性氧清除能力的阈值,增强红椿植株面临抗旱逆境的自我保护能力。这个结论与其他学者研究发现的亚精胺能提高植株体内POD活性的结论一致[10,30]。
3.3 喷施外源Spd对红椿叶片膜系统的影响
逆境胁迫一般会导致植株细胞膜功能受损,从而使细胞膜透性增大,细胞内包括电解质在内的各种水溶液外渗,因此,测定相对电导率可掌握细胞膜的受损程度[31]。随着胁迫程度加深,外渗物质增多,质膜透性变大,相对电导率也增高[32]。研究表明,红椿家系幼苗的受到持续干旱伤害时,植物的细胞膜结构受损,细胞内的各种水溶液外渗,从而导致相对电导率增大[19]。本研究中,随着干旱胁迫程度的加重,叶片相对电导率显著增高,重度干旱胁迫下叶片相对电导率比对照高出92.8%,结论与其他研究文献相类似[32]。轻度和中度干旱胁迫后进行外源Spd喷施处理,相对电导率仍有轻微上升;在重度胁迫后进行外源Spd喷施处理,叶片相对电导率比重度干旱胁迫下降低,但仍明显高于对照。外源Spd喷施缓解了重度干旱胁迫导致的细胞液外渗,有效降低了质膜透性。研究人员对玉米的研究发现,外源亚精胺处理可有效进行渗透调节[33]。
MDA是逆境胁迫下膜脂过氧化的主要产物之一,其含量常用来指示植物细胞的膜脂过氧化程度,也是鉴定植物抗旱性强弱的常用指标之一[19]。通常MDA增幅越小的植株其抗逆性越强。本研究中,重度干旱胁迫条件下,红椿叶片MDA含量的增幅相对更大;喷施外源Spd后,轻度干旱胁迫和中度干旱胁迫植株叶片MDA含量显著降低,仅重度干旱胁迫下植株叶片MDA含量仍然处于升高状态,说明喷施外源Spd后,轻度干旱胁迫和中度干旱胁迫植株的胁迫状态MDA指征消失,而重度干旱胁迫下植株仍然存在巨大的胁迫压力。同类研究证明,外源亚精胺处理可有效缓解植株干旱条件下叶片MDA含量的上升幅度[10,30]。
3.4 喷施外源Spd对红椿叶片渗透调节功能的影响
植物的渗透调节是适应逆境胁迫的一种重要的生理机制[34]。植株在逆境下积累的渗透调节物质越多,则表示其调节抗旱的能力越强[35]。本研究中,各干旱胁迫条件下,红椿幼苗叶片游离脯氨酸含量都有增高,但以重度干旱胁迫下增高最为显著,为对照条件下的20倍;喷施外源Spd后,叶片游离脯氨酸含量立刻回到了对照水平,说明外源Spd能大幅度缓解干旱胁迫给植株叶片渗透调节系统所造成的压力,此结论同有关学者提出的精胺处理对植物响应逆境的内容一致[36]。
4 结 论
综合各项指标的分析表明,不同干旱胁迫程度对红椿幼苗造成的影响差别显著。轻度干旱胁迫(土壤相对含水率30%~38%)和中度干旱胁迫(土壤相对含水率25%~30%)对红椿植株造成的损害较轻,喷施外源1 mmol/L Spd后修复迅速;重度干旱胁迫(土壤相对含水率20%~25%)对红椿植株造成的损害较为明显,喷施外源1 mmol/L Spd后修复较慢。在干旱胁迫下,1 mmol/L Spd通过提高抗氧化酶活性,如POD活性,减少了细胞内物质的外渗,调节了细胞膨压,提高了叶片保水能力和叶绿素含量,从而增强了红椿幼苗植株抵抗干旱胁迫的能力。
[1]Evans PT, Malmberg RL. Do polyamines have roles in plant development[J]. Annu. Rev. Plant Physiol Plant Mol. Biol., 1989,40: 235-269.
[2]Smith TA . Polyamines[J]. Annu. Rev. Plant Physiol., Biochem.J.,1985, 249:33-36.
[3]张 凤,何恩鹏,王国元,等. 外源亚精胺对生物抗逆性影响的研究进展[J]. 化学与生物工程, 2015,32(7):1-4.
[4]田 婧,郭世荣,刘香娥,等. 外源亚精胺对高温下黄瓜幼苗叶片抗氧化系统的影响[J], 西北植物学报,2009,29(11):2261-2267.
[5]田 婧,郭世荣,孙锦,等. 外源亚精胺对高温胁迫下黄瓜幼苗氮素代谢的影响[J].生态学杂志, 2011,30(10):2197-2202.
[6]李 璟,胡晓辉,郭世荣,等.外源亚精胺对根际低氧胁迫下黄瓜幼苗根系多胺含量和抗氧化酶活性的影响[J].植物生态学报, 2006,30(1):118-123.
[7]贾永霞,郭世荣,王素平,等.根际低氧胁迫下外源亚精胺对黄瓜幼苗多胺和抗氧化系统的影响[J]. 园艺学报,2007,34(6):1547-1550.
[8]周晨楠,施晓梦,袁颖辉,等. 外源亚精胺对Ca(NO3)2胁迫下番茄幼苗光合特性和抗氧化酶活性的影响[J]. 西北植物学报. 2012,32(3):498-504.
[9]李 军,高新昊,郭世荣,等. 外源亚精胺对盐胁迫下黄瓜幼苗光合作用的影响[J]. 生态学杂志,2007,26(10):1595-1599.
[10]张春梅,邹志荣,张志新. 外源亚精胺对模拟干旱胁迫下番茄幼苗活性氧水平和抗氧化系统的影响[J]. 应用与环境生物学报, 2009,15(3):301-307.
[11]闫 刚,张春梅,邹志荣. 外源亚精胺对干旱胁迫下番茄幼苗碳水化合物代谢及相关酶活性的影响[J].干旱地区农业研究,2012, 30(1):143-148.
[12]李 阳,施国新,王红霞,等. 外源亚精胺可缓解荇菜镉毒害[J]. 植物学报,2009,44(5):571-577.
[13]Roy P, Niyogi K, Sengupta DN. Spermindine treatment to rice seedlings recovers salinity stress-induced damage of plasma membrane and PM-bound H+-ATPase in salt-tolerant and saltsensitive rice cultivar[J]. Plant Science, 2005,168:583-591.
[14]中国树木志编委会. 中国主要树种造林技术[M]. 北京:中国林业出版社, 1981:613-615.
[15]刘 球,李志辉,吴际友,等. 红椿幼苗对干旱胁迫及复水生理响应的典型相关分析[J]. 西北农林科技大学学报(自然科学版),2015,43(10):1-10.
[16]湛 欣,鲁好君,赵 帅,等. 红椿SSR-PCR体系建立和多态性引物筛选[J]. 林业科学研究,2016,29(4):565-570.
[17]吴际友, 李志辉, 刘 球, 等.干旱胁迫对红椿无性系幼苗叶片相对含水量和叶绿素含量的影响[J].中国农学通报,2013,29(4): 19-22.
[18]刘 球, 李志辉, 吴际友, 等.干旱胁迫对红椿盆栽土壤含水率与植株伤害程度的影响[J].湖南林业科技,2014,41(6):40-43.
[19]陈彩霞, 王瑞辉, 吴际友, 等.持续干旱条件下红椿无性系幼苗的生理响应[J].中南林业科技大学学报,2013, 33(9): 46-49.
[20]陈彩霞, 王瑞辉, 吴际友, 等.淹水胁迫对红椿家系幼苗几种生理生化指标的影响[J]. 西北林学院学报,2014,29(3): 21-26.
[21]张志良,瞿伟菁. 植物生理学实验指导[M]. 北京:高等教育出版社, 2003.
[22]陈建勋,王晓峰. 植物生理学实验指导[M]. 广州:华南理工大学出版社,2010:135-137.
[23]方向文,李凤民,张海娜,等. 树锦鸡儿、柠条锦鸡儿、小叶锦鸡儿和鹰嘴豆干旱适应能力比较[J]. 生态学报, 2011,31(9):2437-2443.
[24]张 斌,张桃林,柳建国,等. 植物的水容特征与其耐旱性的关系[J]. 植物资源与环境, 1996,5(2):23-27.
[25]An YY, Liang ZS, Han RL, et al. Effect of soil drought on seedling growth and water metabolism of three tree species in Loess Plateau[J]. Acta Botanica Boreali-Occidentalia Sinica.2007,27(1): 91-97.
[26]Bindi M, Bellesi S, Orlandini S. Influence of water deficit stress on leaf area development and transpiration of sangiovese grapevines grown in pots[J]. American Journal of enology and Viticulture, 2005,56(1): 68-72.
[27]王新建,何 威,杨淑红,等.干旱胁迫下4种楸树嫁接苗叶绿素含量的变化[J].经济林研究,2008,26(1):20-24.
[28]李娟娟,许晓研,朱文旭,等.淹水胁迫对丁香叶绿素含量及荧光特性的影响[J].经济林研究,2012,30(2):43-47.
[29]李丽杰,顾万荣,张 倩,等. 外源亚精胺对干旱胁迫下玉米幼苗叶片生理及根系特征参数的影响[J]. 农药学学报,2015,17(13): 291-299.
[30]程明明,杜红阳,刘怀攀. 外源亚精胺对涝胁迫下玉米幼苗根的氧化伤害缓解效应[J]. 南方农业学报,2015,46(1):36-41.
[31]刘天峰,何 威. 水涝胁迫对豫楸1号嫁接苗MDA和质膜相对透性的影响[J]. 河南林业科技,2011,31(2):10-12.
[32]钟雪花,杨万年,吕应堂. 淹水胁迫下对烟草、油菜某些生理指标的比较研究[J]. 武汉植物学研究,2002,20(5):395-398.
[33]宋维贤,杜红阳,刘怀攀,等. 亚精胺对渗透胁迫下玉米幼苗生长和有机渗透调节物质的影响[J]. 西北农业学报,2010,19(7): 66-70.
[34]Ghaderi N, Siosemandeh A. Response to drought stress of two strawberry cultivars (cv.Kurdistan and Selva) [J]. Horticulture,Environment, and Biotechnology,2011,65:407-408.
[35]Silva E, Ferreiraa S, Viegas R. The role of organic and inorganic solutes in the osmotic adjustment of drought-stressed Jatropha curcas plants[J]. Environmental and Experimental Botany,2010,69: 279-285.
[36]尤东玲,张 星,于康珂,等. 亚精胺对淹水胁迫下玉米幼苗生长和生理特性的影响[J].玉米科学, 2016,24(1):74-80,87.
Repair regulation of exogenous Spd on physiological function of Toona ciliata seedlings under drought stress with different levels
LIU Qiu1,2, LI Zhihui1, WU Jiyou2, YANG Shuozhi2, WU Zhihua3
(1.College of Forestry, Central South University of Forestry &Technology, Changsha 410004, Hunan, China;2.Precious Tree Species Research Institute, Hunan Academy of Forestry, Changsha 410004, Hunan, China;3.China Eucalypt Research Centre, Zhanjiang 524022, Guangdong, China)
The study was carried out to find out the repair regulation effects of exogenous Spd on physiological function of Toona ciliata family seedlings under drought stress. 2a potted seedlings of Toona cilliate adoppted as experimental materials, the drought stress and exogenous Spd regulation experiment was carried out in the arti fi cial-rain-shelter by combining persistent drought stress with soil moisture measurement. The experiment contained 4 treatments as CK (Relative Soil Water Content 45%~50%), mild drought stress and regulation (Relative Soil Water Content 30%~38%+1 mmol/L exogenous Spd), moderate drought stress and regulation (Relative Soil Water Content 25%~30%+1 mmol/L exogenous Spd) and severe drought stress and regulation (Relative Soil Water Content 20%~25%+1 mmol/L exogenous Spd). (1)There was extremely signi fi cant (p<0.01) difference in leaf relative water content, leaf cell membrane permeability, chlorophyll content, POD content, proline content and MDA content among CK, drought stress(mild, moderate and severe drought stress) and exogenous Spd regulation treatment. (2)The repair effect of 1 mmol/L exogenous Spd on morphologic damage in plants under severe drought stress was much greater than those under mild and moderate drought stress.(3) 1 mmol/L exogenous Spd treatment could quickly repair damage of plants from mild (Relative Soil Water Content 30%~38%) and moderate (Relative Soil Water Content 25%~30%) drought stress and promote the persistent drought resistance ability, while there was relatively gentle effect on recovery of damage from severe drought stress (Relative Soil Water Content 20%~25%). 1 mmol/L exogenous Spd treatment could strengthen the drought resistance ability of Toona ciliata seedlings by promote leaf water retaining capacity and chlorophyll content,activating antioxidant enzyme activity and weakening the leakage from cells.
exogenous Spd; physiological regulation; Toona cilliate; drought stress; drought resistance ability
S792.99
A
1673-923X(2017)07-0066-07
10.14067/j.cnki.1673-923x.2017.07.010
2017-01-23
国家林业公益性行业科研专项(201504301)
刘 球,助理研究员,博士研究生
吴际友,研究员,博士;E-mail:hnforestry@sina.com
刘 球,李志辉,吴际友,等. 外源亚精胺对不同干旱胁迫程度下红椿幼苗生理功能的修复调节[J].中南林业科技大学学报,2017, 37(7): 66-72.
[本文编校:吴 毅]

