Galectin-3促进甲状腺乳头状癌细胞转移机制的研究
陆伟辉,王 聪,李 宸,艾志龙
复旦大学附属中山医院普外科,上海 200032
Galectin-3促进甲状腺乳头状癌细胞转移机制的研究
陆伟辉,王 聪,李 宸,艾志龙
复旦大学附属中山医院普外科,上海 200032
背景与目的:甲状腺乳头状癌(papillary thyroid cancer,PTC)是人体常见的肿瘤之一。半乳凝集素-3(Galectin-3)是一种参与调控肿瘤发生、发展的多功能蛋白。Galectin-3广泛表达于多种肿瘤组织及肿瘤患者的血清中。该研究旨在探索Galectin-3调控PTC细胞转移的相关机制。方法:对40例PTC组织切片进行Galectin-3染色及评分。对PTC细胞B-cpap行无血清培养后分别检测细胞内外的Galectin-3的表达水平。用两种不同方法抑制Galectin-3在细胞内外的表达后利用CCK8法及细胞划痕法检测细胞功能的改变。利用免疫荧光及共聚焦摄像技术观察在细胞内敲低Galectin-3表达后细胞形态的改变。结果:颈部淋巴结转移患者组织切片的Galectin-3染色评分显著高于临床无转移者(P<0.05)。抑制细胞内外Galectin-3的表达均能抑制PTC细胞迁移,但对于增殖的影响不同。敲低细胞内Galectin-3表达后,PTC细胞形态发生改变。结论:PTC患者组织中的Galectin-3表达与肿瘤转移相关。抑制细胞内外的Galectin-3表达均能显著降低肿瘤细胞的迁移。
甲状腺肿瘤;半乳凝集素-3;细胞迁移实验
甲状腺癌是一种常见的恶性肿瘤,约占所有恶性肿瘤的1%[1]。甲状腺癌同时也是近20年来全球发病率增长最快的恶性肿瘤,美国的数据显示,自1975—2009年,甲状腺癌的发病率增长了近3倍[2-3]。甲状腺癌最常见的病理类型是甲状腺乳头状癌(papillary thyroid cancer,PTC),占全部甲状腺癌的70%~96%[4-5],同时PTC也是预后最好的恶性肿瘤之一,20年生存率超过90%[1]。但也有相当一部分局部进展或者早期远处转移的乳头状癌患者预后不佳[7]。
半乳糖凝集素-3(Galectin-3)是半乳糖凝集素家族一员,其功能性糖结合区能特异性地识别并结合β-半乳糖苷[8]。目前国内外对于Galectin-3的研究很多,已证实其参与调控包括肿瘤分化[9]、黏附[10]、侵袭[9]、迁徙[11]及血管新生[12]等肿瘤发生、发展的多个环节。在乳腺癌、结直肠癌、胰腺癌、肺癌及胃癌等多种肿瘤细胞与组织中,Galectin-3都有不同程度的表达[11,13-15]。在甲状腺疾病中,Galectin-3常被用于术前细针穿刺或手术后病理检查中对于甲状腺结节的良恶性诊断[1,16-17]。本研究旨在探索细胞内外Galectin-3的表达对于PTC转移的联系与影响。
1 材料和方法
1.1 组织切片的收集及免疫组织化学染色
40例原发性PTC患者病理切片由复旦大学附属中山医院病理科提供。其中20例为无颈部淋巴结转移的患者,另20例为PTC经术后病理证实有颈侧区淋巴结转移的患者。将所有患者的病理切片脱蜡至水,采用微波修复法抗原修复。将切片移入3%双氧水中,室温20 min,TBS漂洗3次。用阻水笔在组织周围画封闭圈,在圈内加入10%山羊血清温育30 min。滴加500 μL的Galectin-3抗体(1∶100,购自美国BD公司),4 ℃过夜反应,然后用TBS漂洗3次。滴加500 μL HRP标记的羊抗IgG抗体,室温温育30 min,用TBS漂洗3次。滴加500 μL新鲜配制的DAB显色液。苏木精染色20 s。切片梯度酒精脱水干燥后使用中性树脂封片,显微镜下观察并拍照。免疫组织化学评分标准如下:无阳性细胞为0分;阳性细胞百分比小于等于10%为1分;阳性细胞百分比10%~25%为2分;阳性细胞百分比25%~50%为3分;阳性细胞百分比50%~75%为4分;阳性细胞百分比大于75%为5分。
1.2 细胞培养及处理
PTC细胞系B-cpap购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库。使用培养基为RPMI-1640(购自美国Gibco公司)添加10%胎牛血清(购自美国Gibco公司),并添加终浓度为100 U/mL青霉素和100 μg/mL链霉素(购自美国Invitrogen公司)。细胞置于37 ℃、CO2体积分数为5%的恒温培养箱中常规培养。用0.25%胰酶-EDTA消化传代。无血清培养时则单用RPMI-1640(购自美国Gibco公司)进行培养。24 h后收集上层培养液及细胞分别进行ELISA法及蛋白[质]印迹法(Western blot)检测。其中上层培液收集自6个相同处理的培养皿,所有样品采用复孔检测。
1.3 Galectin-3敲低及抑制
采用慢病毒转染方法敲低Galectin-3在细胞内的表达,实验所用慢病毒由复旦医学院生化系江建海教授课题组提供。干扰序列如下:
Gal-3-shRNA:5’-CCCACGCTTCAATGAGAAC-3’;Lacz-shRNA:5’-GCAAACAGAATTGCTTTAG-3’。转染方法为培养细胞生长至60%~70%汇合度时,以35 mm直径培养皿中加入培养液2 mL为例,向慢病毒中加入polybrene(购自上海吉凯基因化学技术有限公司),使其在培液终浓度为8 μg/mL,再将混合液加入培养皿中,混匀,放入37 ℃、CO2体积分数为5%的恒温培养箱中培养中,48 h后传代。实验采用购自美国圣特莱公司的低分子柑橘果胶(low-molecular-weight citrus pectin,LCP)抑制细胞外Galectin-3。以2 mg/mL为终浓度将粉末状的LCP加入培液中放入37 ℃、CO2体积分数为5%的恒温培养箱中培养12~24 h。
1.4 CCK8实验
收集对数期的细胞,以3 000个细胞每孔接种于96孔板中,每孔200 μL,另用含10%FBS的培养基200 μL加入96孔板中作为空白对照,边缘孔用PBS填充。培养24和48 h后,在同一时间向试验孔及空白对照空加入每孔10 μL的CCK8试剂(购自日本株式会社同仁化学研究所)。37 ℃培养箱温育2 h后用酶标仪(购自美国BioTek公司)测定吸光度(D450nm)值。
1.5 细胞划痕实验
收集对数期的细胞,传代于6孔板中。待细胞密度长至90%的聚合度,用200 μL规格的移液器吸头在孔板直径最大的地方垂直于标记的横线划过。用PBS洗涤2次,换上无血清的培养基,在镜下观察并拍照。然后分别培养12和24 h后,在镜下找到同一区域观察并拍照。
1.6 Western blot检测
当细胞密度生长至90%聚合度时,用预冷的PBS洗涤细胞3次,用细胞刮板刮下细胞后,加入适量2×SDS裂解液裂解,4 ℃、15 290×g离心5 min。上清液保存于-20 ℃条件下。采用BCA法(购自上海碧云天生物技术有限公司)测定蛋白浓度。电泳、转膜。5%脱脂奶粉中37 ℃封闭90 min,加鼠抗Galectin-3一抗(1∶1 000,购自美国BD公司),4 ℃温育过夜,洗膜缓冲液漂洗6次后,加入二抗,37 ℃温育1 h,洗膜缓冲液漂洗6次后加入增强化学发光底物,显影。
1.7 免疫荧光实验
将细胞转入有盖玻片的6孔板内,待细胞贴壁后,弃去培养液,PBS漂洗1次,加入4%多聚甲醛2 mL,室温固定30~40 min,PBS漂洗3次。用含5%荧光二抗来源的血清,0.3%TritonX-100的PBS于室温封闭标本90 min。按照抗体说明书稀释鬼笔环肽(购自上海拜力生物科技有限公司),室温温育2 h。然后PBS漂洗3次。在盖玻片和载玻片间滴加抗荧光猝灭封片剂,封片后在显微镜下观察。
1.8 统计学处理
所有数据采用SPSS 21.0统计软件进行统计学分析。组间数据之间的差异采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 PTC患者组织中Galectin-3表达增高
对所收集的40例患者的石蜡切片进行Galectin-3染色后发现,PTC组织和颈部淋巴结染色灶均有Galectin-3阳性表达(图1)。进行评分后发现,Galectin-3在有颈部淋巴结转移患者组织中的表达显著高于无颈部淋巴结转移患者(4.3±0.93 vs 2.5 ±1.01,P<0.05,图2)。
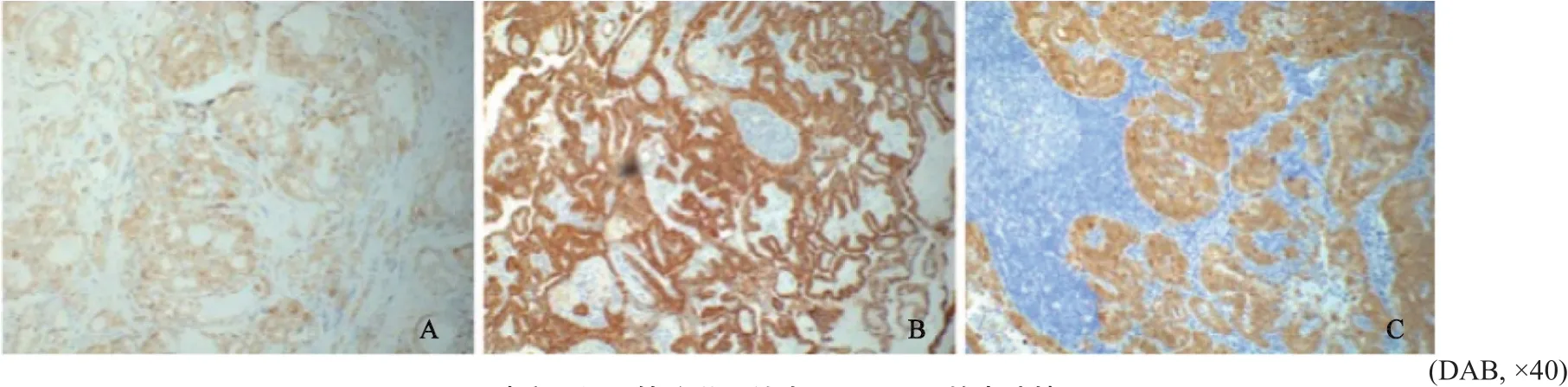
图 1 PTC肿瘤组织及转移淋巴结中Galectin-3的表达情况Fig. 1 Expression of Galectin-3 in PTC tissues(A-B) and metastatic lymph nodes (C)
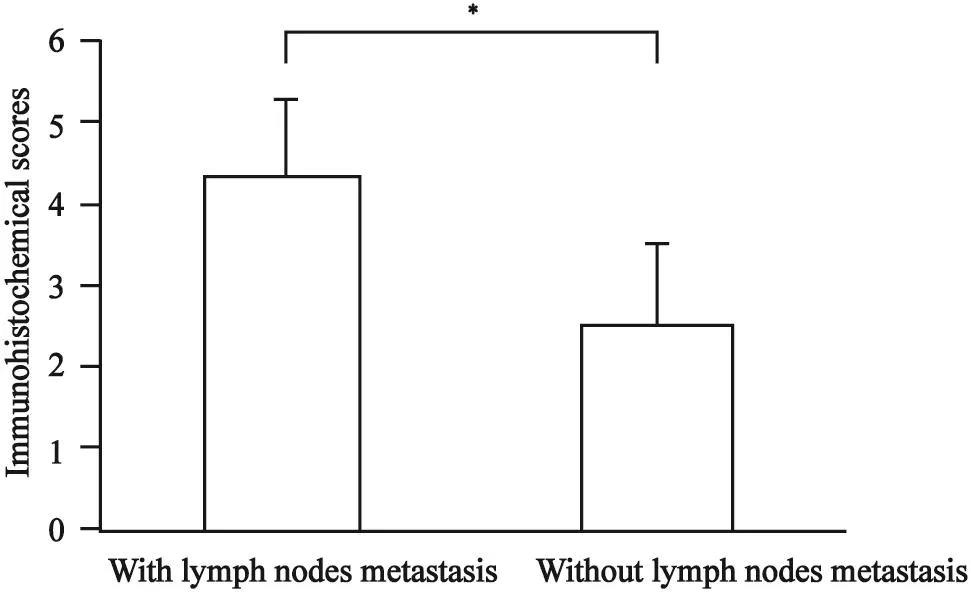
图 2 在无颈侧区淋巴结转移及有颈侧区淋巴结转移的PTC患者组织中Galectin-3的组织化学评分比较Fig. 2 Comparisons of immunohistochemical scores of Galectin-3 between PTC patients with or without cervical lymph nodes metastasis
2.2 抑制细胞内外Galectin-3的表达抑制PTC肿瘤转移
通过Western blot检测及ELISA检测我们证实PTC细胞B-cpap表达Galectin-3且Galectin-3可被分泌至上层培养液中,而经无血清处理24 h后细胞内蛋白水平及分泌至细胞外的Galectin-3表达均有所增多(图3、4)。
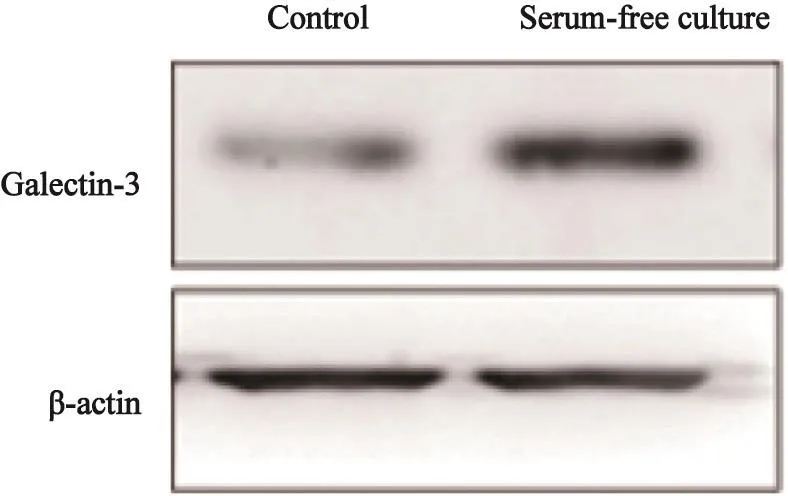
图 3 在无血清培养后B-cpap细胞的Galectin-3表达情况Fig. 3 The expression of Galectin-3 in B-cpap cells after cultured with serum-free culture
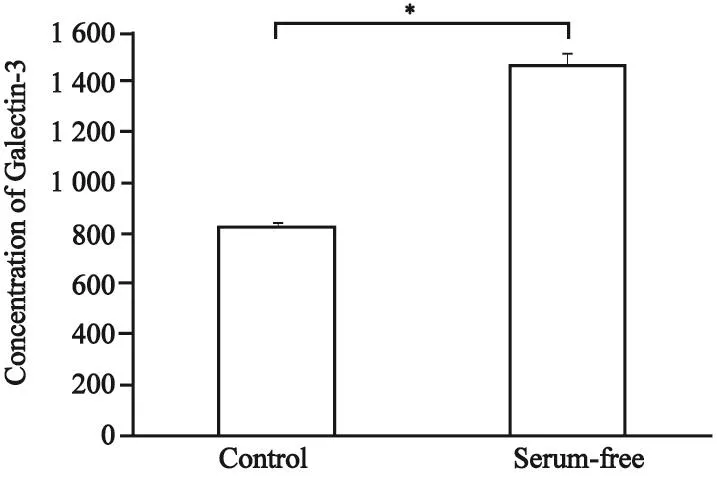
图 4 在有血清或无血清培养24 h后Galectin-3在细胞培养基中的浓度比较Fig. 4 Comparisons of Galectin-3 concentration in culture medium after cultured with or without serum for 24 h
为了验证抑制Galectin-3表达对于PTC细胞迁移及增殖的影响,我们分别利用慢病毒转染敲低了Galectin-3在乳头状癌细胞内的表达(图5),以及利用Galectin-3受体特异性拮抗剂LCP(2 mg/mL)抑制细胞外Galectin-3与其受体的结合。结果显示,在无血清条件下,无论是抑制细胞内Galectin-3表达抑或阻断细胞外Galectin-3与其受体结合,均能显著降低PTC细胞的迁移能力(图6)。而对于增殖的影响则不同,敲低细胞内Galecitn-3表达并未引起48 h后细胞增殖能力的改变,而利用LCP阻断Galectin-3结合则能显著降低PTC细胞的增殖能力(图7)。
2.3 抑制细胞内Galectin-3表达引起PTC细胞骨架改变
进一步利用免疫荧光技术对无血清处理后的PTC细胞进了细胞骨架染色,结果发现,与对照组相比,敲低了Galectin-3表达的细胞其形态更为平整。而对照组细胞的微丝的分布更趋于细胞两端,提示对照组细胞可能具有更高的活动性(图8)。
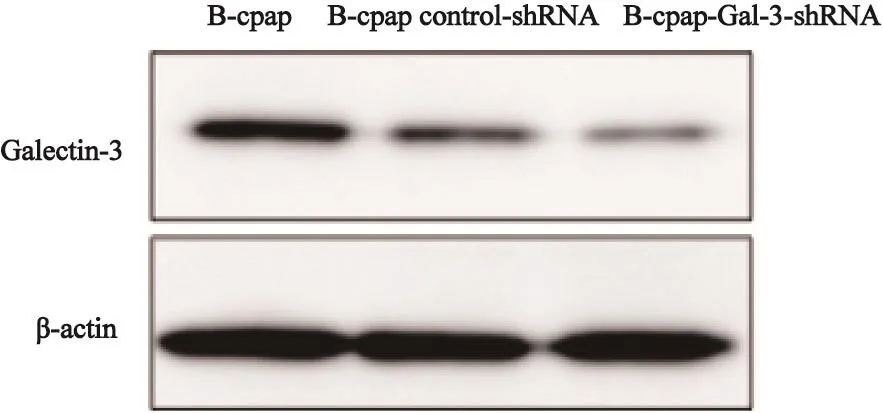
图 5 用慢病毒转染敲低Galectin-3的效果Fig. 5 Inhibition of Galectin-3 after the transfection with control or Gal-3-shRNA lentivirus
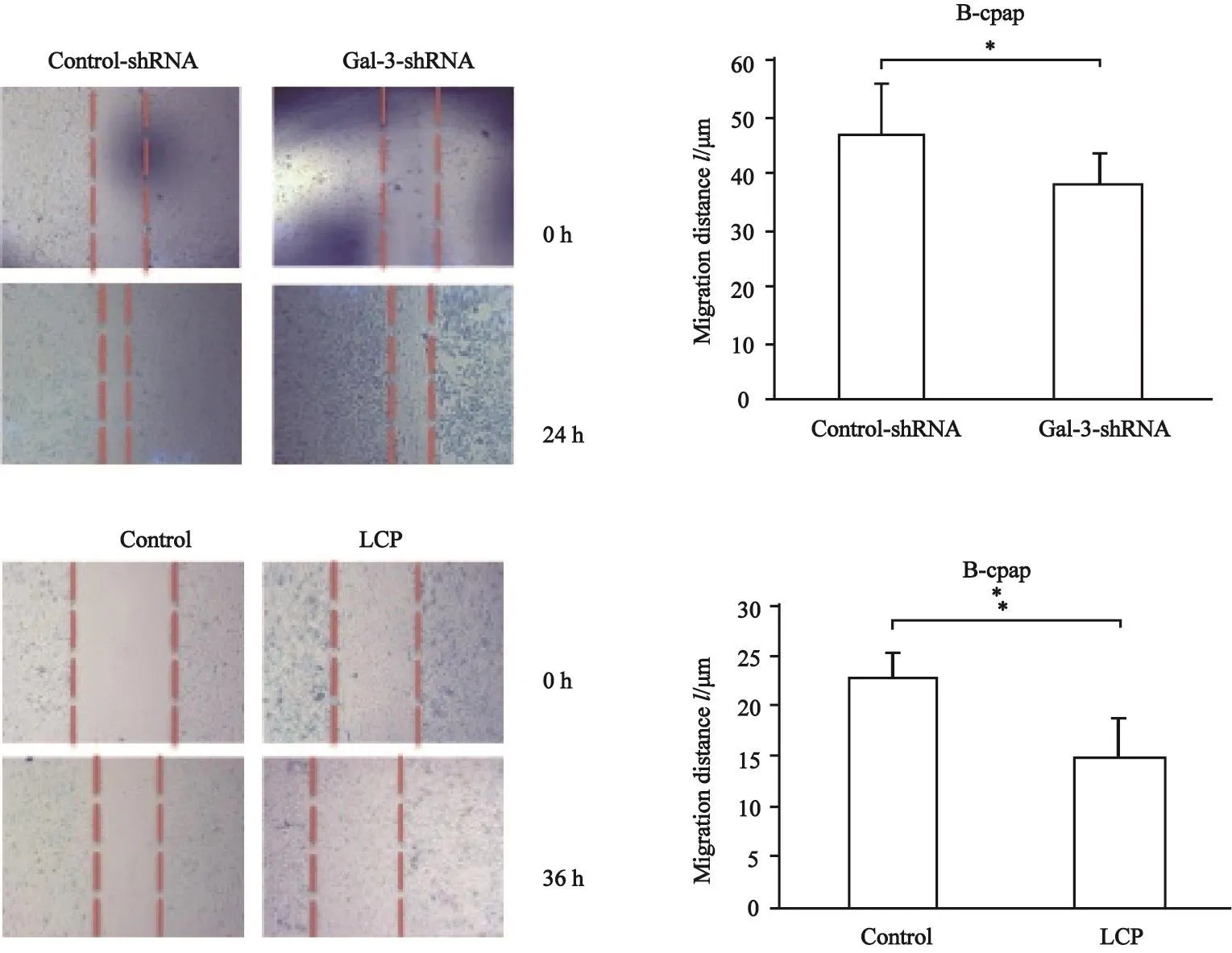
图 6 在细胞内外抑制Galectin-3作用抑制B-cpap细胞迁移Fig. 6 Inhibition of extra and intracellular Galectin-3 inhibited B-cpap cell migration
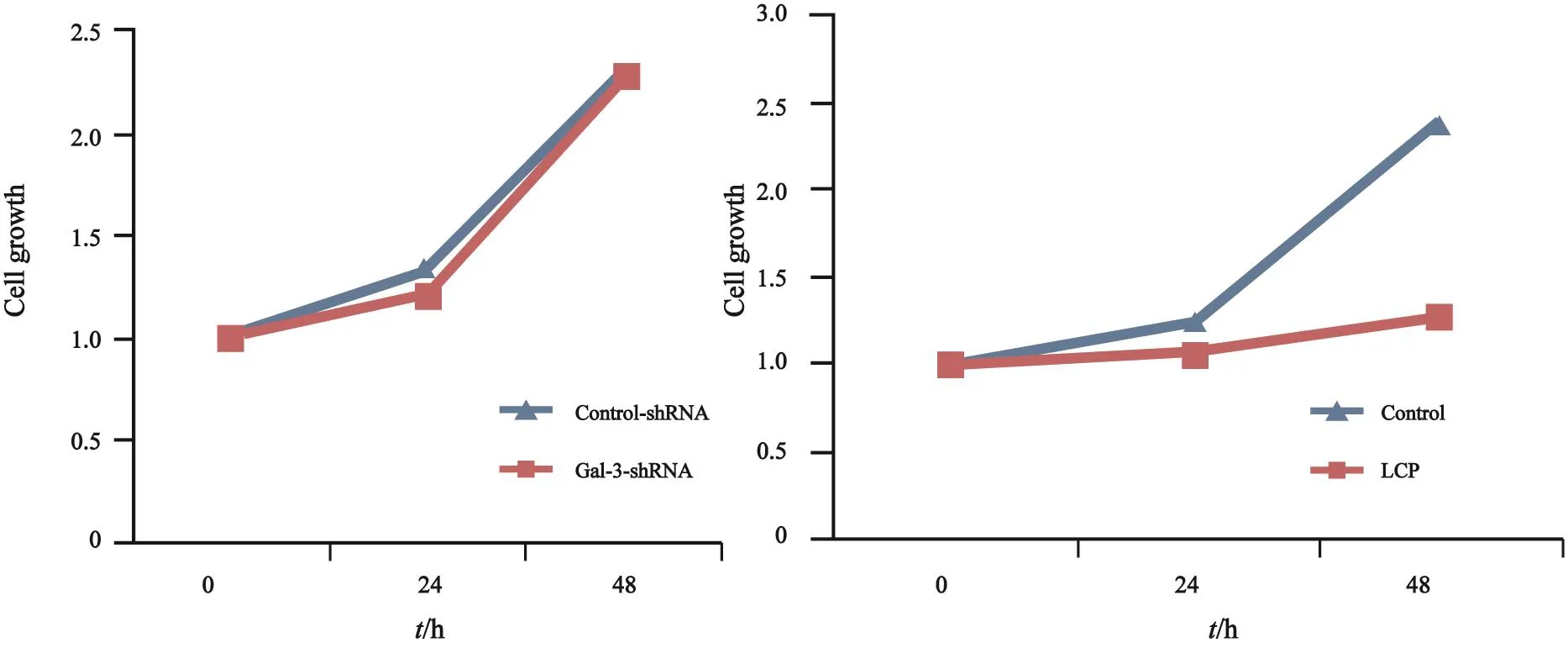
图 7 在细胞内外抑制Galectin-3作用对于B-cpap细胞增殖的影响不同Fig. 7 Inhibition of extra and intracellular Galectin-3 had different pact on B-cpap cell proliferation
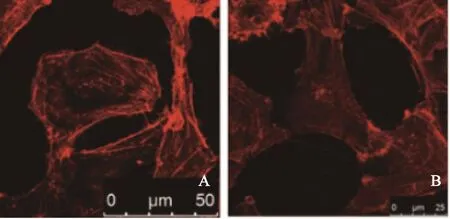
图 8 对于B-cpap对照组细胞(A)及Galectin-3敲低细胞(B)的免疫荧光染色Fig. 8 Immunofluorescence assay of B-cpap control-shRNA cells (A) and B-cpap Gal-3-shRNA cells (B)
3 讨 论
Galectin-3广泛分布于细胞核、细胞质以及正常细胞及肿瘤细胞的细胞外基质中[18-19]。对于Galectin-3分泌到外周血的途径目前研究并不十分清楚,但有证据表明可能与外泌体相关[20]。在甲状腺肿瘤的研究中,Galectin-3一直是一个热门领域。在一些既往的研究中,Galectin-3在PTC组织中表达都显著高于甲状腺良性结节,在转移性PTC中的表达更高[21]。这与我们对于PTC患者组织切片的研究所得出的结论一致。然而也有部分研究结果表明Galectin-3在有无淋巴结转移的PTC组织中的表达并无显著差异[22-23]。因此,Galectin-3的表达与PTC淋巴结转移的关系尚待进一步的研究证实。
在不同的研究中,Galectin-3参与调控包括肿瘤迁移侵袭、细胞黏附、恶性转化、细胞增殖、凋亡与抗凋亡及血管新生等多个肿瘤发生、发展的环节[24]。本研究发现,无血清培养下PTC细胞的Galectin-3表达增多,其分泌至上层培养液的Galectin-3也随之增多。这可能是肿瘤细胞在不利环境下的保护机制之一,Galectin-3参与调控肿瘤细胞在该类环境下的适应性改变[25]。
Galectin-3对于肿瘤细胞迁移的调节已在多种肿瘤中有所报道[26-27]。细胞内外的Galectin-3通过不同机制调控肿瘤细胞的迁移。在细胞内,Galectin-3通过调控其配体如整合素、黏液素等影响肿瘤细胞与肿瘤细胞间以及肿瘤细胞与细胞外基质间的黏附[28-29]。存在于细胞外基质的糖复合物如层黏连蛋白、弹性蛋白等也是Galectin-3作用的受体[30-31]。与细胞内Galectin-3不同,细胞外的Galectin-3在不同浓度下分别具有化学趋化和促进细胞无定向运动的作用[32]。在合适的浓度下,外源性的Galectin-3可通过活化FAK及PI3K、招募活化的α5β1-整合素至纤维状黏连处及增加肌动蛋白的转化来增加Mgat5+/+细胞的迁移能力[33]。我们利用慢病毒和Galectin-3的特异性受体拮抗剂低分子柑橘果胶分别抑制细胞内Galectin-3的表达和细胞外Galectin-3与其受体结合,发现PTC细胞迁移能力下降。
Galectin-3对于细胞增殖的调控在不同研究中结论不同,在本研究中,利用慢病毒敲低Galectin-3的表达后乳头状癌细胞的增殖能力无明显下降,这与Zheng等[27]的研究结果类似。而在加入了低分子柑橘果胶后,PTC细胞的增殖出现了下降,这可能与低分子柑橘果胶具有诱导肿瘤细胞凋亡的能力有关[34]。
PTC患者组织中的Galectin-3表达与肿瘤转移相关。抑制细胞内外的Galectin-3表达均能显著降低PTC细胞的迁移。因此,Galectin-3在今后PTC局部或远处转移的治疗中具有潜在价值。
[1] SETHI K, SARKAR S, DAS S, et al. Biomarkers for the diagnosis of thyroid cancer[J]. J Exp Ther Oncol, 2010,8(4): 341-352.
[2] VIGNERI R, MALANDRINO P, VIGNERI P. The changing epidemiology of thyroid cancer: why is incidence increasing?[J]. Curr Opin Oncol, 2015, 27(1): 1-7.
[3] DAVIES L, WELCH H G. Current thyroid cancer trends in the United States[J]. JAMA Otolaryngol Head Neck Surg,2014, 140(4): 317-322.
[4] DAVIES L, WELCH H G. Increasing incidence of thyroid cancer in the United States, 1973-2002[J]. JAMA, 2006,295(18): 2164-2167.
[5] ZHANG Y, DAI J, WU T, et al. The study of the coexistence of Hashimoto’s thyroiditis with papillary thyroid carcinoma[J].J Cancer Res Clin Oncol, 2014, 140(6): 1021-1026.
[6] BRENNER H. Long-term survival rates of cancer patients achieved by the end of the 20thcentury: a period analysis[J].Lancet, 2002, 360(9340): 1131-1135.
[7] BHATTACHARYYA N. A population-based analysis of survival factors in differentiated and medullary thyroid carcinoma[J]. Otolaryngol Head Neck Surg, 2003, 128(1):115-123.
[8] BOSCHER C, DENNIS J W, NABI I R. Glycosylation,galectins and cellular signaling[J]. Curr Opin Cell Biol,2011, 23(4): 383-392.
[9] TAKENAKA Y, INOHARA H, YOSHII T, et al. Malignant transformation of thyroid follicular cells by galectin-3[J].Cancer Lett, 2003, 195(1): 111-119.
[10] DUDAS S P, YUNKER C K, STERNBERG L R, et al.Expression of human intestinal mucin is modulated by the beta-galactoside binding protein galectin-3 in colon cancer[J]. Gastroenterology, 2002, 123(3): 817-826.
[11] KIM S J, SHIN J Y, LEE K D, et al. Galectin-3 facilitates cell motility in gastric cancer by up-regulating protease-activated receptor-1 (PAR-1) and matrix metalloproteinase-1 (MMP-1)[J]. PLoS One, 2011, 6(9): e25103.
[12] DOS S S, SHELDON H, PEREIRA J X, et al. Galectin-3 acts as an angiogenic switch to induce tumor angiogenesis via Jagged-1/Notch activation[J]. Oncotarget, 2017, 8(30):49484-49501.
[13] ZHAO Q, BARCLAY M, HILKENS J, et al. Interaction between circulating galectin-3 and cancer-associated MUC1 enhances tumour cell homotypic aggregation and prevents anoikis[J]. Mol Cancer, 2010, 9(1): 154.
[14] KOBAYASHI T, SHIMURA T, YAJIMA T, et al. Transient gene silencing of galectin-3 suppresses pancreatic cancer cell migration and invasion through degradation of β-catenin[J]. Int J Cancer, 2011, 129(12): 2775-2786.
[15] 刘美燕, 杜 冰, 李春红, 等. 半乳凝素-3在非小细胞肺癌中的表达及相关性研究[J]. 中国肺癌杂志, 2013, 16(8):417-421.
[16] YIP L. Molecular diagnostic testing and the indeterminate thyroid nodule[J]. Curr Opin Oncol, 2014, 26(1): 8-13.
[17] BARUT F, ONAK K N, BEKTAS S, et al. Universal markers of thyroid malignancies: galectin-3, HBME-1, and cytokeratin-19[J]. Endocr Pathol, 2010, 21(2): 80-89.
[18] FUNASAKA T, RAZ A, NANGIA-MAKKER P. Nuclear transport of galectin-3 and its therapeutic implications[J].Semin Cancer Biol, 2014, 27: 30-38.
[19] FORTUNA-COSTA A, GOMES A M, KOZLOWSKI E O,et al. Extracellular galectin-3 in tumor progression and metastasis[J]. Front Oncol, 2014, 4: 138.
[20] RECORD M. Intercellular communication by exosomes in placenta: a possible role in cell fusion?[J]. Placenta, 2014,35(5): 297-302.
[21] TANG W, HUANG C, TANG C, et al. Galectin-3 may serve as a potential marker for diagnosis and prognosis in papillary thyroid carcinoma: a meta-analysis[J]. Onco Targets Ther,2016, 9: 455-460.
[22] GWEON H M, KIM J A, YOUK J H, et al. Can galectin-3 be a useful marker for conventional papillary thyroid microcarcinoma?[J]. Diagn Cytopathol, 2016, 44(2): 103-107.
[23] CHIU C G, STRUGNELL S S, GRIFFITH O L, et al.Diagnostic utility of galectin-3 in thyroid cancer[J]. Am J Pathol, 2010, 176(5): 2067-2081.
[24] CALIFICE S, CASTRONOVO V, VAN DEN BRULE F.Galectin-3 and cancer (Review)[J]. Int J Oncol, 2004,25(4): 983-992.
[25] CARDOSO A C F, ANDRADE L N D S, BUSTOS S O, et al. Galectin-3 determines tumor cell adaptive strategies in stressed tumor microenvironments[J]. Front Oncol, 2016, 6:127.
[26] SHETTY P, BARGALE A, PATIL B R, et al. Cell surface interaction of annexin A2 and galectin-3 modulates epidermal growth factor receptor signaling in Her-2 negative breast cancer cells[J]. Mol Cell Biochem, 2016, 411(1-2): 221-233.
[27] ZHENG D, HU Z, HE F, et al. Downregulation of galectin-3 causes a decrease in uPAR levels and inhibits the proliferation,migration and invasion of hepatocellular carcinoma cells[J].Oncol Rep, 2014, 32(1): 411-418.
[28] MARGADANT C, VAN DEN BOUT I, VAN BOXTEL A L,et al. Epigenetic regulation of galectin-3 expression by β1 integrins promotes cell adhesion and migration[J]. J Biol Chem, 2012, 287(53): 44684-44693.
[29] OCHIENG J, FURTAK V, LUKYANOV P. Extracellular functions of galectin-3[J]. Glycoconj J, 2004, 19(7-9):527-535.
[30] HSIEH W C, MACKINNON A C, LU W Y, et al. Galectin-3 regulates hepatic progenitor cell expansion during liver injury[J]. Gut, 2015, 64(2): 312-321.
[31] TOUPANCE S, BRASSART B, RABENOELINA F, et al.Elastin-derived peptides increase invasive capacities of lung cancer cells by post-transcriptional regulation of MMP-2 and uPA[J]. Clin Exp Metastasis, 2012, 29(5): 511-522.
[32] SANO H, HSU D K, YU L, et al. Human galectin-3 is a novel chemoattractant for monocytes and macrophages[J]. J Immunol, 2000, 165(4): 2156-2164.
[33] LAGANA A, GOETZ J G, CHEUNG P, et al. Galectin binding to Mgat5-modified N-glycans regulates fibronectin matrix remodeling in tumor cells[J]. Mol Cell Biol, 2006, 26(8):3181-3193.
[34] JACKSON C L, DREADEN T M, THEOBALD L K, et al.Pectin induces apoptosis in human prostate cancer cells:correlation of apoptotic function with pectin structure[J].Glycobiology, 2007, 17(8): 805-819.
The role of Galectin-3 in promoting metastasis of papillary thyroid carcinoma
LU Weihui, WANG Cong, LI Chen, AI Zhilong (Department of General Surgery, Zhongshan Hospital of Fudan University,Shanghai 200032, China)
AI Zhilong E-mail: ai.zhilong@zs-hospital.sh.cn
Background and purpose:Papillary thyroid cancer (PTC) is one of the most common carcinomas in humans. Galectin-3 is a multifunctional protein which regulates different process of tumorigenesis. Galectin-3 is widely distributed in various cancer tissues and the sera of cancer patients. The aim of this study was to explore the role of Galectin-3 in promoting PTC cells migration.Methods:Immunohistochemical analyses were performed on 40 PTC tissues and scores were calculated. PTC B-cpap cells were harvested after serum-free culture, and the extracellular and intracellular levels of Galectin-3 were measured. CCK-8 assay and wound healing assay were conducted after inhibition of Galectin-3 with two different methods. The transformation of cell morphology after inhibition of intracellular Galectin-3 was analyzed using immunofluorescence and confocal laser scanning.Results:Compared with those PTC patients without cervical lymph node metastasis, immunohistochemical scores of Galectin-3 were signif i cantly higher in those with cervical lymph node metastases (P<0.05). The inhibition of extracellular and intracellular Galectin-3 attenuated the migration ability of cancer cells, but had different impact on cell proliferation.Transformation of cell morphology was also observed after inhibition of intracellular Galectin-3.Conclusion:Galectin-3 expression in tumor tissues was related to PTC metastasis. Inhibition of extracellular and intracellular galectin-3 could signif i cantly decrease PTC cell migration.
Thyroid neoplasm; Galectin-3; Cell migration assay
10.19401/j.cnki.1007-3639.2017.10.003
R739.91
A
1007-3639(2017)10-0775-07
中山医院2015优秀骨干计划(2015ZSYXGG12)。
艾志龙 E-mail:ai.zhilong@zs-hospital.sh.cn
2017-04-15
2017-08-20)

