HMGB1/TLR4通路参与Fibulin-5对肺癌细胞增殖和转移的抑制作用
张晓娟,王慧娟,张米娜,张国伟
郑州大学附属肿瘤医院/河南省肿瘤医院肿瘤内科,河南 郑州 450008
HMGB1/TLR4通路参与Fibulin-5对肺癌细胞增殖和转移的抑制作用
张晓娟,王慧娟,张米娜,张国伟
郑州大学附属肿瘤医院/河南省肿瘤医院肿瘤内科,河南 郑州 450008
背景与目的:Fibulin-5在肺癌组织中低表达,具有抑癌作用。高迁移率族蛋白B1(high mobility group box 1,HMGB1)在肺癌中高表达,能够促进肿瘤的侵袭转移。该研究旨在探讨Fibulin-5抑制肺癌细胞增殖和转移的分子机制。方法:该研究首先检测了肺上皮细胞和肺癌细胞中Fibulin-5和HMGB1的表达,然后利用转染试剂将Fibulin-5过表达质粒和HMGB1的siRNA转染人A549细胞。实现Fibulin-5过表达和HMGB1低表达后,采用MTT实验检测细胞增殖情况,Transwell实验检测细胞的侵袭和迁移能力。本研究采用实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测A549细胞中HMGB1 mRNA表达变化,采用酶联免疫吸附剂测定实验(enzyme-linked immunosorbent assay,ELisa)检测HMGB1蛋白的分泌;采用蛋白[质]印迹法(Western blot)检测HMGB1、cyclin D1、基质金属蛋白酶(matrix metalloproteinases,MMPs)和TLR4/NF-κB通路相关蛋白的表达变化。结果:在肺癌细胞A549中,Fibulin-5低表达,HMGB1高表达。过表达Fibulin-5和低表达HMGB1后,HMGB1、cyclin D1、MMP2、MMP7和MMP9的表达均明显降低,A549细胞的增殖、侵袭和迁移能力明显减弱(P<0.05);此外,过表达Fibulin-5下调了TLR4、MyD88、p-p65的表达,上调了IκBα的表达(P<0.05)。结论:Fibulin-5可能是通过抑制HMGB1的表达以及其下游的TLR4/NF-κB通路,抑制肺癌细胞的增殖、侵袭和迁移的过程。
Fibulin-5;高迁移率族蛋白B1;TLR4/NF-κB通路;肺癌;侵袭;迁移
肺癌是一种常见的恶性程度较高的肿瘤,近些年的发病率和死亡率明显升高,5年生存率仅为10%,其中肺腺癌最为常见[1]。目前治疗肺癌的手段主要有外科手术、化疗和免疫治疗等,但因癌细胞转移和耐药的限制,治疗效果较差。Fibulin-5,又称FBLN-5、DANCE或EVEC,属于Fibulin家族,是细胞外基质蛋白,其参与正常或恶性肿瘤细胞的增殖、运动、侵袭和血管再生等过程的调控[2-3]。有文献报道,Fibulin-5在卵巢癌[4]、乳腺癌[5]、肝癌[6]和肺癌[7]中低表达,上调其表达能够通过调控基质金属蛋白酶(matrix metalloproteinases,MMPs)、Ki-67、整合素和Wnt/β-catenin信号通路蛋白的表达,抑制癌细胞的迁移和侵袭。然而,关于Fibulin-5抑制肺癌发生、发展的具体机制并不明确。高迁移率族蛋白B1(high mobility group protein box 1,HMGB1)是一种存在于真核细胞中的高度保守的非组蛋白核蛋白。当受到外界刺激时,HMGB1释放到细胞外,可作为晚期炎性反应递质,参与炎性反应,与多种癌症的发生、发展有密切联系[1,8]。目前的研究报道,肺癌细胞或者患者血清中HMGB1过表达能够通过调控TLR4/NF-κB信号通路,增强肿瘤细胞的迁移能力,促进肺癌的转移[9-10]。然而目前关于Fibulin-5与HMGB1之间的相互作用机制尚未明确。该研究旨在探究肺癌细胞中Fibulin-5是否通过HMGB1/TLR通路发挥其抑癌作用。
1 材料和方法
1.1 实验材料
人肺上皮细胞HBE135-E6E7(HBE)和人肺癌细胞株A549购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库;DMEM/F12培养液和胎牛血清(FBS)购自美国Hyclone公司;LightCycler SYBR Green Ⅰ购自瑞士Roche公司;RNA提取试剂盒和cDNA第一链合成试剂盒购自天根生化科技(北京)有限公司;pcDNA3.1空载体质粒购自Invitrogen公司,参照文献中的方法构建pcDNA3.1-Filulin-5质粒[11];HMGB1 siRNA和阴性对照siRNA购自上海吉凯基因化学技术有限公司;转染试剂LipofectamineTM2000购自美国LifeTech公司;HMGB1 ELISA试剂盒购自瑞士Tecan公司;Matrigel基质胶购自美国BD公司。
兔多克隆抗体MMP2、MMP7、Fibulin-5和鼠单克隆抗体MMP9购自Santa Cruz Biotechnology公司;兔单克隆抗体MyD88、β-actin购自美国Cell Signaling Technology公司;兔单克隆抗体HMGB1、兔多克隆抗体Toll样受体(toll-like receptor,TLR)-4、兔单克隆抗体IκBα、兔单克隆抗体cyclin D1和鼠单克隆抗体p-p65均购自Abcam公司;辣根过氧化物酶标记的山羊抗兔和山羊抗鼠IgG购自北京中山金桥生物技术有限公司。
1.2 细胞培养及分组
将细胞置于37 ℃、CO2体积分数为5%的培养箱中,用含10% FBS的DMEM培养液培养A549细胞和HBE细胞,选用对数生长期的细胞进行实验。首先检测两种细胞系中Fibulin-5和HMGB1的表达。然后根据实验设计,将A549细胞分成两部分,一部分分组为:无任何处理的正常培养的细胞为空白对照组(记为control),转染1 μg/mL pcDNA3.1-Filulin-5质粒的细胞为Fibulin-5组,转染1 μg/mL pcDNA3.1空载体质粒的细胞为vector组,旨在检测3组中Fibulin-5过表达对肺癌细胞的作用;另一部分分组为:无任何处理的正常培养的细胞为空白对照组(记为control),转染100 nmol/L HMGB1 siRNA的细胞为si-HMGB1组,转染100 nmol/L阴性对照siRNA的细胞为si-NC组,旨在探究3组中HMGB1低表达对肺癌细胞的作用。
1.3 细胞转染
将处于对数生长期的A549细胞接种于6孔板培养,24 h后细胞融合达80%以上时进行转染实验。将含FBS的培养液换成无血清培养基培养1 h,按照转染试剂LipofectamineTM2000的说明书分别将pcDNA3.1空载体质粒、pcDNA3.1-Filulin-5质粒、HMGB1 siRNA和阴性对照siRNA转染入细胞A549中,6 h后换成含10%FBS的DMEM培养液继续培养48 h后检测转染效率。
1.4 MTT法检测细胞增殖活性
转染48 h后,收集各组A549细胞,用含10%FBS的DMEM培养液重悬,按3×103个/孔的密度重新接种在96孔板中,于37 ℃、CO2体积分数为5%的条件下分别培养12、24、48和72 h后每孔加入20 μL浓度为5 mg/mL的MTT溶液,继续培养4 h后弃去上清液,每孔加入150 μL DMSO,震荡10 min,在490 nm波长处测定各孔的吸光度(D)值,绘制细胞生长曲线,比较细胞的增殖活性。
1.5 Transwell实验
转染48 h后,收集各组A549细胞,用无血清培养液重悬,使细胞密度为1×105个/mL。侵袭实验:将Matrigel基质胶与无血清无双抗的培养基按1∶8混合,在Transwell上室膜上加入50 μL稀释后的Matrigel基质胶,置于37 ℃培养箱1 h。取出含有包被好Matrigel基质胶小室的24孔板,在下室内加入600 μL含20%FBS的DMEM培养液,上室中按每孔2×104个细胞加入细胞悬液,并加入无血清培养基使其终体积为400 μL,置于37 ℃、CO2体积分数为5%的培养箱中继续培养24 h。取出培养板中的小室,用棉签擦去微孔膜上层的细胞,下室加入甲醇,将上室浸入室温固定10 min,PBS清洗,移去小室,风干。于每室加入700 μL 0.1% 结晶紫溶液,于37 ℃染色30 min,PBS清洗小室后,在倒置显微镜下(200×)观察拍照,每个样本取5个不同视野,计算透膜细胞数。每组设计3个平行实验。迁移实验:除去包被Matrigel基质胶的操作,其余同侵袭实验。
1.6 RNA提取和实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction, RTFQ-PCR)
使用RNA提取试剂盒提取HBE和A549细胞的总RNA,NanoDrop 2000超微量分光光度计测定RNA的浓度与纯度,琼脂糖凝胶电泳检测RNA完整性。使用反转录试剂盒将其反转录成cDNA,然后用SYBR Green Ⅰ进行RTFQ-PCR实验检测HMGB1在RNA水平的表达。以GAPDH为内参,实验所涉及的RTFQ-PCR引物均由生工生物工程(上海)股份有限公司合成。HMGB1上游引物序列为5’-TATGGCAAAAGCGGACAAGG-3’,下游引物序列为5’-CTTCGCAACATCACCAATGGA-3’;GAPDH上游引物序列为5’-GAGAGACCC TCACTGCTG-3’,下游引物序列为5’-GAT GGTACATGACAAGGTGC-3’。
1.7 酶联免疫吸附实验(enzyme-linked immunosorbent assay, ELISA)检测
收集各组A549细胞的培养上清液,3 500×g离心10 min,取上清液,按照HMGB1 ELISA试剂盒的说明书进行操作,根据标准曲线和测得的吸光度值计算HMGB1蛋白的分泌量。
1.8 蛋白[质]印迹法(Western blot)检测蛋白表达
采用RIPA全裂解液裂解各组细胞,提取细胞总蛋白,采用BCA法测定样品蛋白浓度,加入6×protein loading缓冲液后沸水浴10 min进行蛋白变性。每条泳道蛋白上样量均为50 μg,以10% SDS-PAGE凝胶进行电泳。蛋白经湿法电转转至硝酸纤维素膜上,先用5%脱脂奶粉常温封闭1.5 h,PBST洗膜,再加入Fibulin-5(比例1∶1 000)、cyclin D1(比例1∶500)、β-actin(比例1∶1 000)、MMP2(比例1∶500)、MMP7(比例1∶500)、MMP9(比例1∶500)、HMGB1(比例1∶1 000)、TLR4(比例1∶500)、MyD88(比例1∶500)、IκBα(比例1∶1 000)和p-p65(比例1∶200)等蛋白的特异度抗体于4 ℃温育过夜,次日PBST洗膜,加辣根过氧化物酶标记的二抗(比例1∶5 000)常温温育2 h,PBST洗膜,进行ECL反应。利用ImageJ2×软件分析蛋白条带,比较蛋白表达变化。
1.9 统计学处理
实验数据统一采用SPSS 15.0软件进行统计学分析。计量资料均以x±s表示,两组间比较采用Student-t检验法,多组间比较先采用单因素方差分析再用LSD-t检验进行两两比较。P<0.05为差异有统计学意义。
2 结 果
2.1 人肺上皮细胞株HBE和人肺癌细胞株A549中Fibulin-5和HMGB1的表达
为探讨Fibulin-5与HMGB1之间的相互作用,我们首先检测了HBE细胞和A549细胞中Fibulin-5与HMGB1的表达。结果如图1所示,Fibulin-5在A549细胞中的蛋白表达低于HBE细胞,差异有统计学意义(A549细胞:0.44±0.03;HBE细胞:0.98±0.06;P=0.001);HMGB1在A549细胞中的mRNA和蛋白水平均高于HBE细胞,差异有统计学意义(A549细胞:mRNA为2.99±0.07,蛋白为3.40±0.03;HBE细胞:mRNA为1.00±0.02,蛋白为0.99±0.03;P均<0.01,图1)。
2.2 过表达Fibulin-5抑制肺癌细胞的增殖
与对照组相比,pcDNA3.1空载体组中Fibulin-5表达变化差异无统计学意义(对照组0.97±0.05;pcDNA3.1组0.98±0.04;P=0.782),转染pcDNA3.1-Fibulin-5组中Fibulin-5表达明显上调,差异有统计学意义(Fibulin-5组:8.13±0.41;P=0.000);MTT检测肺癌细胞A549增殖的结果显示,与对照组相比,空载体组中细胞增殖能力的变化不明显,Fibulin-5组中细胞增殖能力减弱,24 h后差异有统计学意义(P<0.05);同时Western blot结果发现空载体组中cyclin D1表达变化较对照组不明显(对照组:0.97±0.04;pcDNA3.1组:0.98±0.05;P=0.868),Fibulin-5组中cyclin D1表达较对照组明显减少,差异有统计学意义(Fibulin-5组:0.54±0.03;P=0.000,图2)。
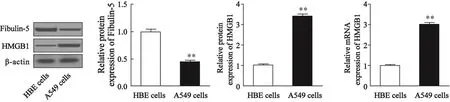
图 1 HBE细胞和A549细胞中Fibulin-5与HMGB1的表达情况分析Fig. 1 Levels of Fibulin-5 and HMGB1 in HBE cells and A549 cells
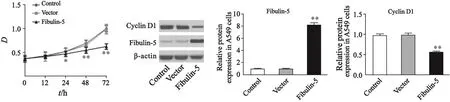
图 2 过表达Fibulin-5影响A549细胞的增殖Fig. 2 Effect of Fibulin-5 overexpression on A549 cells proliferation
2.3 过表达Fibulin-5抑制肺癌细胞的迁移和侵袭
体外Transwell实验结果显示,与对照组相比,空载体组迁移实验中由上室迁移至下室的和侵袭实验中穿过Matrigel基质胶的A549细胞数均无明显变化(迁移:对照组为0.95±0.03,pcDNA3.1组为1.00±0.04,P=0.265;侵袭:对照组为0.98±0.05,pcDNA3.1组为0.95±0.03,P=0.652),而Fibulin-5组中A549细胞数均明显减少,差异有统计学意义(迁移:0.44±0.04,P=0.000;侵袭:0.34±0.03,P=0.000);Western blot检测肿瘤侵袭转移相关蛋白MMP2、MMP7和MMP9的表达发现,与对照组相比,空载体组中MMP2、MMP7和MMP9的表达变化差异无统计学意义(MMP2:对照组为0.98±0.03,pcDNA3.1组为0.99±0.06,P=0.889;MMP7:对照组为0.98±0.05,pcDNA3.1组为0.99±0.03,P=0.653;MMP9:对照组为1.00±0.05,pcDNA3.1组为0.97±0.02,P=0.264),Fibulin-5组中MMP2/7/9的表达明显下调,差异有统计学意义(Fibulin-5组:MMP2为0.36±0.02,MMP7为0.19±0.01,MMP9为0.54±0.03;P均=0.000)(图3)。
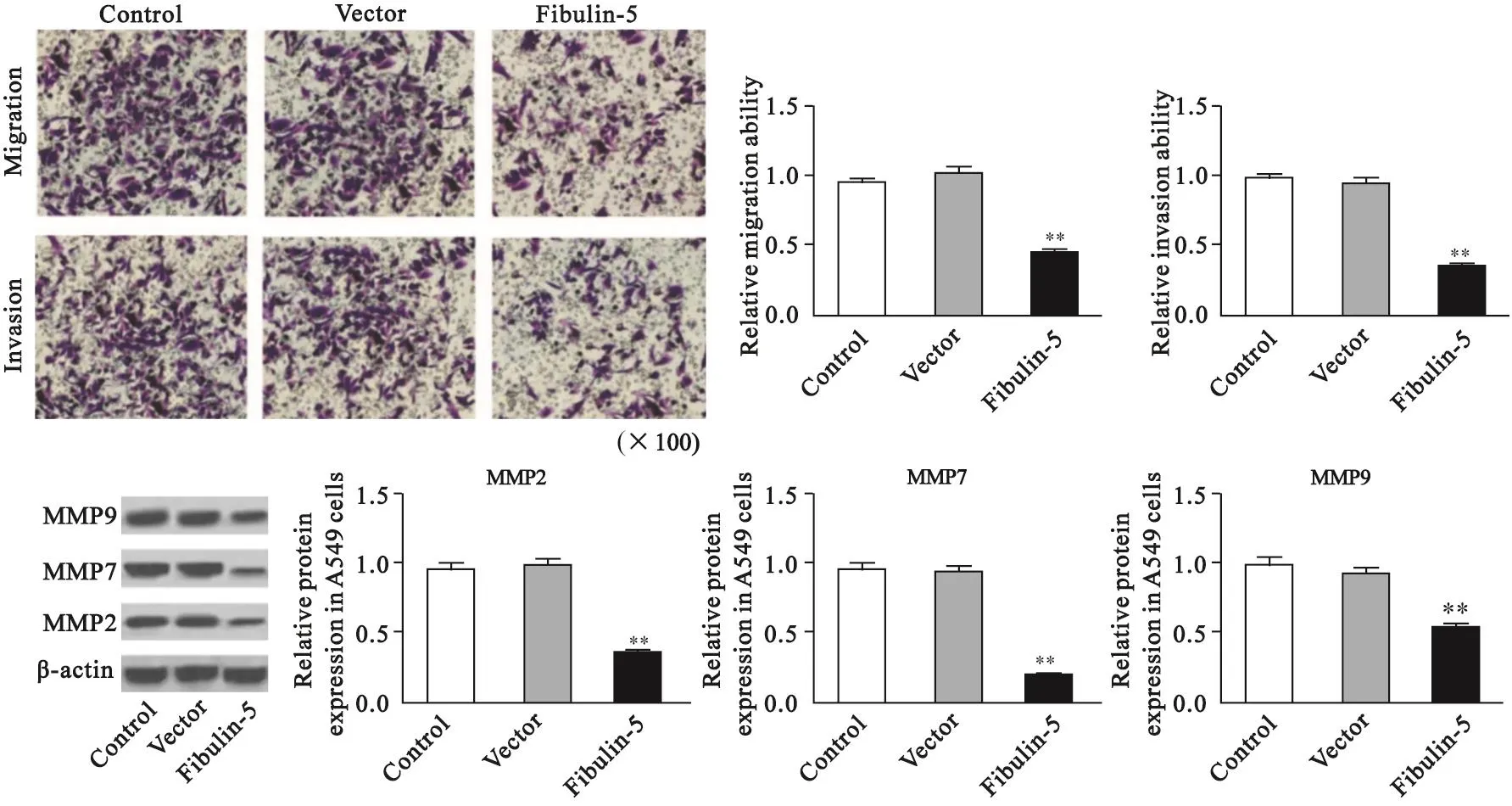
图 3 过表达Fibulin-5影响A549细胞的迁移和侵袭Fig. 3 Effect of Fibulin-5 overexpression on the migration and invasion of A549 cells
2.4 过表达Fibulin-5下调HMGB1的表达
与对照组相比,空载体组中HMGB1的mRNA和蛋白水平的表达及其分泌均无明显变化[mRNA水平:对照组为0.96±0.02,pcDNA3.1组为0.99±0.04,P=0.499;蛋白水平:对照组为0.96±0.03,pcDNA3.1组为0.96±0.05,P=0.955;分泌量:对照组为(8.06±0.58)ng/mL,pcDNA3.1组为(8.27±0.32) ng/mL,P=0.777],Fibulin-5组HMGB1的mRNA表达明显降低,A549细胞裂解液和培养液上清液中的HMGB1蛋白量均明显减少,差异有统计学意义[Fibulin-5组:mRNA水平为0.46±0.03,蛋白水平为0.42±0.03,分泌量为(3.46±0.30)ng/mL;P均=0.000,图4]。
2.5 HMGB1低表达对肺癌细胞增殖和迁移的抑制作用
与空白对照组相比,转染HMGB1 siRNA入A549细胞后,细胞裂解液和培养液上清液中的HMGB1蛋白量均明显下调,差异有统计学意义[细胞裂解液:对照组为0.97±0.05,si-HMGB1组为0.56±0.04,P=0.002;上清液:对照组为(7.60±0.31)ng/mL,si-HMGB1组为(4.43±0.32)ng/mL;P=0.003];MTT检测肺癌细胞A549增殖的结果显示,与空白对照组相比,si-HMGB1组中细胞增殖能力减弱,24 h后差异有统计学意义(P<0.05);同时Western blot检测结果发现,si-HMGB1组中cyclinD1表达较空白对照组明显减少,差异有统计学意义(对照组为1.00±0.02,si-HMGB1组为0.45±0.03,P=0.000)。体外Transwell实验结果显示,与空白对照组相比,si-HMGB1组迁移实验中由上室迁移至下室的和侵袭实验中穿过Matrigel基质胶的A549细胞数均明显减少,肿瘤侵袭转移相关蛋白MMP2、MMP7和MMP9表达均明显降低,差异有统计学意义(迁移:对照组为0.99±0.04,si-HMGB1组为0.55±0.02,P=0.000;侵袭:对照组为0.95±0.03,si-HMGB1组为0.26±0.03,P=0.000;MMP2:对照组为0.97±0.06,si-HMGB1组为0.52±0.02,P=0.001;MMP7:对照组为0.95±0.04,si-HMGB1组为0.36±0.04,P=0.000;MMP9:对照组为1.00±0.06,si-HMGB1组为0.66±0.04,P=0.007)。与空白对照组相比,阴性对照siRNA组中A549细胞的增殖、迁移、侵袭能力和相关蛋白表达均无明显变化(P均>0.05,图5)。
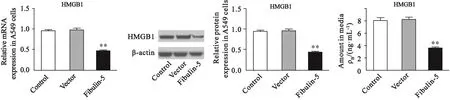
图 4 过表达Fibulin-5影响A549细胞中HMGB1的表达Fig. 4 Effect of Fibulin-5 overexpression on HMGB1 expression in A549 cells
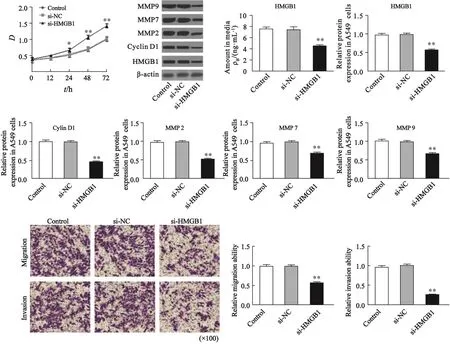
图 5 HMGB1表达降低对A549细胞的增殖、迁移和侵袭的影响Fig. 5 Effect of down-regulating HMGB1 expression on the cell proliferation, migration, and invasion of A549 cells
2.6 过表达Fibulin-5影响TLR4/NF-κB通路
与对照组相比,空载体组TLR4、MyD88、p-p65和IκBα的表达变化差异无统计学意义(TLR4:对照组为0.96±0.04,pcDNA3.1组为0.99±0.03,P=0.627;MyD88:对照组为1.0±0.02,pcDNA3.1组为1.0±0.04,P=0.401;p-p65:对照组为1.0±0.04,pcDNA3.1组为0.97±0.03,P=0.489;IκBα:对照组为1.0±0.06,pcDNA3.1组为1.0±0.05,P=0.837)。Fibulin-5组TLR4、MyD88、p-p65的表达明显降低,IκBα的表达明显升高,差异有统计学意义(Fibulin-5组:TLR4为0.43±0.04,MyD88为0.4±0.05,p-p65为0.32±0.02,IκBα为2.7±0.20;P均=0.000,图6)。
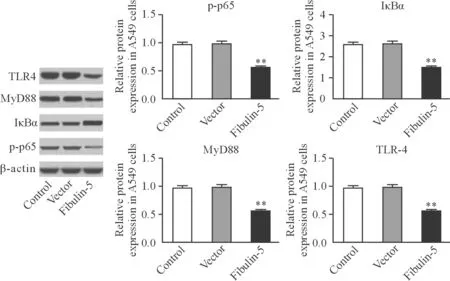
图 6 Fibulin-5过表达对TLR4/NF-κB通路的影响Fig. 6 Effect of Fibulin-5 overexpression on TLR4/NF-κB signaling pathway
3 讨 论
肺癌是全球发生率高且预后性差的恶性肿瘤之一,肿瘤转移和耐药是癌症治疗中的两大瓶颈问题[1,12]。探究转移和耐药相关蛋白及其作用机制对肺癌的预防和治疗具有重要意义。Fibulin家族属于细胞外基质蛋白,主要表达于细胞基底膜、基质和细胞外基质等,能够介导细胞与细胞、细胞与基质间的相互联系[13]。近年来的研究发现,Fibulin-5的异常表达与肿瘤发生、发展密切相关。文献显示,Fibulin-5在肺癌组织中低表达[7],但是其具体的作用机制还不清楚。本研究发现,与正常肺细胞相比,肺癌细胞中Fibulin-5低表达,与之前肺癌组织中的研究相一致[7]。本研究结果及文献均显示HMGB1在肺癌中高表达[14],因此本研究主要利用过表达Fibulin-5和低表达HMGB1来探讨两者在肺癌中的作用及联系。
Cyclin D1是细胞周期蛋白,能够调控细胞周期,其过度表达促进细胞增殖,与肿瘤的发生相关。MMPs参与细胞外基质的降解和重构过程,其中MMP2和MMP9能够诱发癌症的侵袭和转移[15],MMP7能够促进非小细胞肺癌的侵袭,影响其预后[16]。有文献报道升高Fibulin-5的表达,能够下调MMP7的表达或抑制wnt/β-catenin通路,从而抑制肝癌或肺癌细胞的侵袭和转移[7,16]。但在纤维瘤细胞和鼻咽癌中Fibulin-5表现促癌作用[16]。这表明,Fibulin-5在不同癌症中对肿瘤生长和转移的影响不同。本研究发现过表达Fibulin-5能够调控cyclin D1、MMP2、MMP7和MMP9的表达,抑制A549细胞的增殖、侵袭和迁移。
HMGB1是广泛存在于真核细胞中的DNA结合蛋白,参与稳定染色质结构、细胞分化和基因转录调控等过程。当有刺激信号时,HMGB1可进行核浆转移,作为晚期炎性反应递质,参与炎性反应、细胞分化迁移和肿瘤转移过程[17]。研究发现HMGB1能够与受体TLR以及晚期糖基化终产物受体结合,激活下游信号通路(如NF-κB),一方面促进IL-1、IL-6、TNF-α等炎性因子的表达释放,诱发炎性反应,从而促进肿瘤的发生、发展[14];另一方面激活MMPs的表达,促使细胞外基质降解,从而影响肿瘤细胞的侵袭[15,18]。文献报道,在肺癌细胞中,HMGB1能够通过调控细胞自噬和凋亡增强细胞对紫杉醇的耐药性;MiR-142-3p能够靶向HMGB1并下调其表达,进而抑制细胞增殖[19]。另外,HMGB1可通过影响ERK/c-Myc通路下调p21和上调MMP-2,促进肝癌进程[18]。本研究发现,过表达Fibulin-5抑制HMGB1在mRNA和蛋白的表达以及HMGB1的分泌。而siRNA干扰沉默HMGB1实验结果显示,HMGB1表达降低后,蛋白cyclin D1、MMP2、MMP7和MMP9的表达均明显下调,HMGB1低表达抑制肺癌细胞A549的增殖、侵袭和迁移,这与Fibulin-5过表达对A549细胞的调控作用相一致。这提示Fibulin-5有可能是通过调控HMGB1的表达抑制A549细胞增殖、侵袭和迁移的。
TLR4/NF-κB通路参与机体的免疫反应,在乳腺癌、结肠癌、胃癌、肺癌和肝癌等多种肿瘤中异常活跃。有研究表明,HMGB1与TLR4受体结合,引起受体活化,进而招募MyD88,降解IκBα,激活NF-κB,激活下游靶基因的转录表达,诱发炎性反应,促进肿瘤生长和肿瘤细胞的免疫逃逸[20]。本研究结果发现,过表达Fibulin-5后IκBα的表达明显升高,TLR4、MyD88和p-p65的表达都明显降低,说明过表达Fibulin-5抑制了TLR4/NF-κB通路。
综上研究发现,Fibulin-5与HMGB1之间存在调控作用,肺癌细胞中Fibulin-5可能是通过抑制HMGB1的表达及其下游的TLR4/NF-κB通路发挥其抑癌作用。但是Fibulin-5对HMGB1的具体调控机制仍需进一步研究。近年研究发现CD14、肿瘤坏死因子、MAPKs信号通路和JAK/STAT通路均涉及HMGB1的核浆转移及胞外释放过程[17],因此Fibulin-5对HMGB1的调控也很可能与这些因子或通路相关。
[1] PAN B, CHEN D, HUANG J, et al. HMGB1-mediated autophagy promotes docetaxel resistance in human lung adenocarcinoma [J]. Mol Cancer, 2014, 13: 165.
[2] ALBIG A R, SCHIEMANN W P. Fibulin-5 function during tumorigenesis [J]. Future Oncol, 2005, 1(1): 23-35.
[3] WANG M, TOPALOVSKI M, TOOMBS J E, et al. Fibulin-5 blocks microenvironmental ROS in pancreatic cancer [J].Cancer Res, 2015, 75(23): 5058-5069.
[4] JIN H H, SONG J, JEONG J, et al. Fibulin-5 is a tumour suppressor inhibiting cell migration and invasion in ovarian cancer [J]. J Clin Pathol, 2015, 69(2): 217-223.
[5] MOHAMEDI Y, FONTANIL T, SOLARES L, et al. Fibulin-5 downregulates Ki-67 and inhibits proliferation and invasion of breast cancer cells [J]. Int J Oncol, 2016, 48(4): 1447.
[6] TANG J C, LIU J H, LIU X L, et al. Effect of fibulin-5 on adhesion, migration and invasion of hepatocellular carcinoma cells via an integrin-dependent mechanism[J]. World J Gastroenterol, 2015, 21(39): 11127.
[7] CHEN X, SONG X, YUE W, et al. Fibulin-5 inhibits Wnt/beta-catenin signaling in lung cancer[J]. Oncotarget, 2015,6(17): 15022-15034.
[8] ZHENG H, CHEN J N, YU X, et al. HMGB1 enhances drug resistance and promotes in vivo tumor growth of lung cancer cells[J]. DNA Cell Biol, 2016, 35(10): 622-627.
[9] ZHU J, LUO J, LI Y, et al. HMGB1 induces human non-small cell lung cancer cell motility by activating integrin αvβ3/FAK through TLR4/NF-κB signaling pathway [J]. Biochem Biophysical Res Commun, 2016, 480(4): 522-527.
[10] ZHANG X, WANG H, WANG J. Expression of HMGB1 and NF-κB p65 and its significance in non-small cell lung cancer[J]. Contemp Oncol, 2013, 17(4): 350-355.
[11] NONAKA R, ONOUE S, WACHI H, et al. DANCE/fibulin-5 promotes elastic fiber formation in a tropoelastin isoformdependent manner[J]. Clin Biochem, 2009, 42(7-8): 713-721.
[12] ZHANG R, LI Y, WANG Z, et al. Interference with HMGB1 increases the sensitivity to chemotherapy drugs by inhibiting HMGB1-mediated cell autophagy and inducing cell apoptosis[J]. Tumour Biol, 2015, 36(11): 8585-8592.
[13] TANG J C, XIE A Y, CAI X J. Diverse functions of fibulin-5 in tumors[J]. Mol Biol (Mosk), 2014, 48(6): 875-880.
[14] 朱建华, 胡 娜, 赵 岚, 等. 高迁移率族蛋白B1激活NF-κB/αvβ3而增加A549细胞迁移与侵袭能力 [J]. 中国癌症杂志, 2015, 25(2): 105-111.
[15] LIU P L, TSAI J R, HWANG J J, et al. High-mobility group box 1-mediated matrix metalloproteinase-9 expression in non-small cell lung cancer contributes to tumor cell invasiveness [J]. Am J Respir Cell Mol Biol, 2010, 43(5):530-538.
[16] TU K, DOU C, ZHENG X, et al. Fibulin-5 inhibits hepatocellular carcinoma cell migration and invasion by down-regulating matrix metalloproteinase-7 expression[J]. BMC Cancer, 2014, 14: 938.
[17] XIA Q, XU J, CHEN H, et al. Association between an elevated level of HMGB1 and non-small cell lung cancer: a metaanalysis and literature review [J]. Oncotargets Ther, 2016,9: 3917-3923.
[18] CHEN Y, LIN C, YANG L, et al. HMGB1 promotes HCC progression partly by downregulating p21 via ERK/c-Myc pathway and upregulating MMP-2 [J]. Tumor Biol, 2016,37(4): 4399.
[19] XIAO P, LIU W L. MiR-142-3p functions as a potential tumor suppressor directly targeting HMGB1 in non-smallcell lung carcinoma [J]. Int J Clin Exp Pathol, 2015, 8(9):10800-10807.
[20] SO E Y, OUCHI T. The application of Toll like receptors for cancer therapy [J]. Int J Biol Sci, 2010, 6(7): 675-681.
Role of HMGB1/TLR4 pathway in the process of Fibulin-5 inhibiting lung cancer cells proliferation and metastasis
ZHANG Xiaojuan, WANG Huijuan, ZHANG Mina, ZHANG Guowei (Department of Medical Oncology, Affiliated Cancer Hospital of Zhengzhou University, Zhengzhou 450008, Henan Province, China)
ZHANG Xiaojuan E-mail: yanhansunv521@163.com
Background and purpose:The expression of Fibulin-5, a tumor suppressor, is reduced in lung cancer tissues. High mobility group box 1 (HMGB1), overexpressed in lung cancer, can promote the invasion and metastasis of the tumor. This study aimed to investigate the molecular mechanism of Fibulin-5 inhibiting the proliferation and metastasis of lung cancer cells.Method:Firstly the expressions of Fibulin-5 and HMGB1 in lung epithelial cells and lung cancer cells were detected. Then transfection reagents were used to transfect Fibulin-5 plasmid and HMGB1 siRNA into A549 cells, which achieved Fibulin-5 overexpression and HMGB1 down-regulation. MTT was used to detect the cell proliferation. Transwell was used to examine the ability of cell invasion and migration. HMGB1 mRNA expression was detected by real-time fl uorescence quantitative polymerase chain reaction (RTFQ-PCR). The secretion of HMGB1 protein was analyzed by enzyme-linked immunosorbent assay (ELISA). Western blot was used to detect the levels of HMGB1, cyclin D1, matrix metalloproteinases (MMPs), and TLR4/NF-κB pathway related proteins.Results:In A549 cell, Fibulin-5 expression was down-regulated and HMGB1 expression was up-regulated. After overexpression of Fibulin-5 or knockdown of HMGB1 in A549 cells, the levels of HMGB1, cyclin D1, MMP2, MMP7 and MMP9 were significantly reduced; the abilities of lung cancer cell proliferation, invasion and migration were notably suppressed (P<0.05). In addition, Fibulin-5 overexpression decreased the protein expressions of TLR4, MyD88,p-p65, increased the expression of IκBα (P<0.05).Conclusion:Fibulin-5 may inhibit lung cancer cell proliferation,invasion and migration via inhibiting the expression of HMGB1 and its downstream TLR4/NF-κB pathway.
Fibulin 5; High mobility group box 1; TLR4/NF-κB pathway; Lung cancer; Invasion; Migration
10.19401/j.cnki.1007-3639.2017.10.001
R734.2
A
1007-3639(2017)10-0761-09
张晓娟 E-mail:yanhansunv521@163.com
2017-04-01
2017-07-02)

