菊花脑总黄酮提取工艺研究
王亚博,都宏霞,陶劲强,刘宴秀
(南京科技职业学院化工与材料学院,江苏 南京 210048)
菊花脑总黄酮提取工艺研究
王亚博,都宏霞,陶劲强,刘宴秀
(南京科技职业学院化工与材料学院,江苏 南京 210048)
本文以菊花脑为原料,采用水提、醇提、冻融、超声波提取及微波提取等5种技术对菊花脑黄酮进行提取,结果表明,微波提取的提取率最高。因此,选取微波提取为主要方法,乙醇水溶液为溶剂,以微波功率、乙醇体积分数、料液比、微波时间为变量进行单因素实验,得到黄酮的最佳提取工艺为:微波功率400W,料液比1∶30,时间60s,乙醇体积分数70%,在此条件下提取得率为10.646mg·g-1。
菊花脑;黄酮;提取
菊花脑是生活中一种常见的野菜,具有清热解毒的功效,对预防“三高”也有显著效果。菊花脑中主要的营养物质为脂肪、维生素、纤维素和蛋白质,主要的活性物质为黄酮物质及挥发油[1-3]。
黄酮类化合物是植物中主要的药理活性成分,具有抗肿瘤、降血糖、降血脂及增强机体免疫力等功能。有关菊花脑的研究仅有少量报道。翁德宝等[4]对菊花脑茎叶的甲醇提取物进行特征测定,并测定菊花脑干品中总黄酮含量为0.203%。章莺鸿[5]发现菊花脑提取液对DPPH的清除能力较高。纪丽莲[6]研究南京地区的菊花脑,发现了20种峰并确定其中的16种物质。张丽娜等[7]对菊花脑中的挥发油进行了研究。本文采用5种技术对菊花脑黄酮进行提取,确定最佳提取技术,进而通过单因素实验对提取工艺进行优化,以期为菊花脑在相关领域的应用提供更好的理论依据。
1 材料与方法
1.1 材料、试剂与仪器
菊花脑(产于五月份江苏南京六合),芦丁标准样品,其它试剂为分析纯。
ME204E/02型电子天平,7600型紫外分光光度计。
2 实验部分
2.1 总黄酮标准曲线的建立
1)以芦丁作为标准对照品,通过测量其在紫外分光光度计的吸光度,建立芦丁标准曲线,测定菊花脑黄酮的含量[8-10]。
准确称取芦丁标准品5.0mg,用浓度为50%的乙醇定容至25.0mL。
准确称取芦丁标准品(0.2mg·mL-1)0.5、1.0、2.0、3.0、4.0、5.0mL于6只比色管中,分别加入50%乙醇5.0mL、0.1M的AlCl3溶液3.0mL和1M的醋酸钾溶液5.0mL,摇匀,同法制成空白对照。静置反应40min,充分接触混合,并在波长415nm处检测其吸光度值。
2)菊花脑黄酮提取得率计算公式:
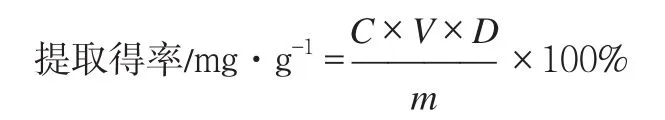
式中:C为试样的测定质量浓度;mg·mL-1;V为滤液体积,mL;D为稀释倍数;m为试样质量,g。
2.2 总黄酮提取方法的比较[11-13]
2.2.1 水浸法
精确称取菊花脑粉20g,料液比1∶20(g∶mL),在纯水中静置8h。抽滤,以4000r·min-1的转速离心5min。为了去除少部分杂质,将离心后的溶液静置,用移液枪取上层清液,按2.1的方法测其吸光度,计算得出菊花脑总黄酮含量。
2.2.2 冻融法
精确称取菊花脑粉20g,料液比1∶20(g∶mL),充分混合,放置于容器中,静置放于冷冻箱中12h,反复冻融3次。抽滤,以4000r·min-1的转速离心5min。为了去除少部分杂质,将离心后的溶液静置,用移液枪取上层清液,按2.1的方法测其吸光度,计算得出菊花脑总黄酮含量。
2.2.3 醇提法
精确称取菊花脑粉20g,料液比1∶20(g∶mL),在70%乙醇中静置8h。抽滤,以转速4000r·min-1离心5min,将离心后的溶液静置。为了去除少部分杂质,取上层清液,按2.1的方法测其吸光度,计算得出菊花脑总黄酮含量。
2.2.4 超声波提取法
精确称取菊花脑粉20g,料液比1∶20(g∶mL),将菊花脑粉放置于纯水中,超声波150W,反应30s。抽滤,以4000r·min-1的转速离心5min,将离心后的溶液静置。为了去除少部分杂质,用移液枪取上层清液,按2.1的方法测其吸光度,计算得出菊花脑总黄酮含量。
2.2.5 微波提取法
精确称取菊花脑粉20g,料液比1∶20(g∶mL),将菊花脑粉放置于纯水中,进行微波提取,微波功率640W,时间30s。抽滤,以4000r·min-1的转速离心5min,为了去除少部分杂质,将离心后的溶液静置,用移液枪取上层清液,按2.1的方法测其吸光度,计算得出菊花脑总黄酮含量。
2.3 总黄酮提取的单因素试验[14-16]
对微波功率、乙醇体积分数、料液比及微波时间等因素进行单因素试验。对提取液进行抽滤,在转速4000r·min-1、时间5min的条件下进行离心,取上层清液,按2.1的方法测其吸光度,计算得出菊花脑总黄酮含量。
3 结果与分析
3.1 标准曲线建立
按照2.1的方法进行实验,将得到的实验结果进行线性回归,得到总黄酮的标准曲线方程:Y=32.86824X+0.13764,相关系数R2=0.99969(Y为吸光度值,X为总黄酮的质量浓度,mg·mL-1),表明芦丁溶液在0.008~0.076mg·mL-1范围内具有良好的线性关系。
3.2 影响菊花脑黄酮提取方法比较
如图1所示,比较几种方法的提取率,提取率从高到低依次为:微波提取法>超声波提取法>醇提法>冻融提取法>水提法。微波提取法效果最好,提取得率最高为6.512mg·g-1。
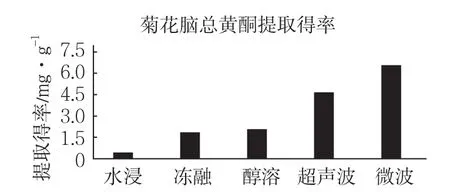
图1 5种提取方式比较
3.3 影响总黄酮提取率的单因素试验
本实验采用微波提取与有机溶剂结合的方法进行提取,选择乙醇为菊花脑总黄酮的提取剂。为了得到最佳的工艺条件,将微波功率、料液比、乙醇体积分数、微波时间作为变量进行单因素分析。
3.3.1 微波功率对菊花脑总黄酮提取率的影响
准确称取预处理过的菊花脑粉20g,固定料液比为1∶10(g∶mL),提取时间为30s,乙醇体积分数为70%,考察微波功率分别为80、160、240、400、640、800W时,对菊花脑总黄酮提取率的影响,结果见图2。

图2 微波功率对菊花脑总黄酮提取率的影响
结果表明,起始阶段微波功率升高,CNF提取率持续增加,当温度达到400W后,提取率几乎呈直线下降。因此最佳提取微波功率应该在400W左右。可能是微波功率的增加可以使体系的温度升高,促进菊花脑细胞破壁,使内溶物溢出率增加,但当功率大到一定程度时,可能会发生局部温度过高的现象,导致菊花脑部分被分解。
3.3.2 乙醇体积分数对总黄酮提取率的影响
精确称取预处理过的菊花脑粉20g,固定料液比为1∶10(g∶mL),提取时间为30s,微波功率400W,考察乙醇体积分数分别为40%、50%、60%、70%、80%时对菊花脑总黄酮提取率的影响,结果见图3。
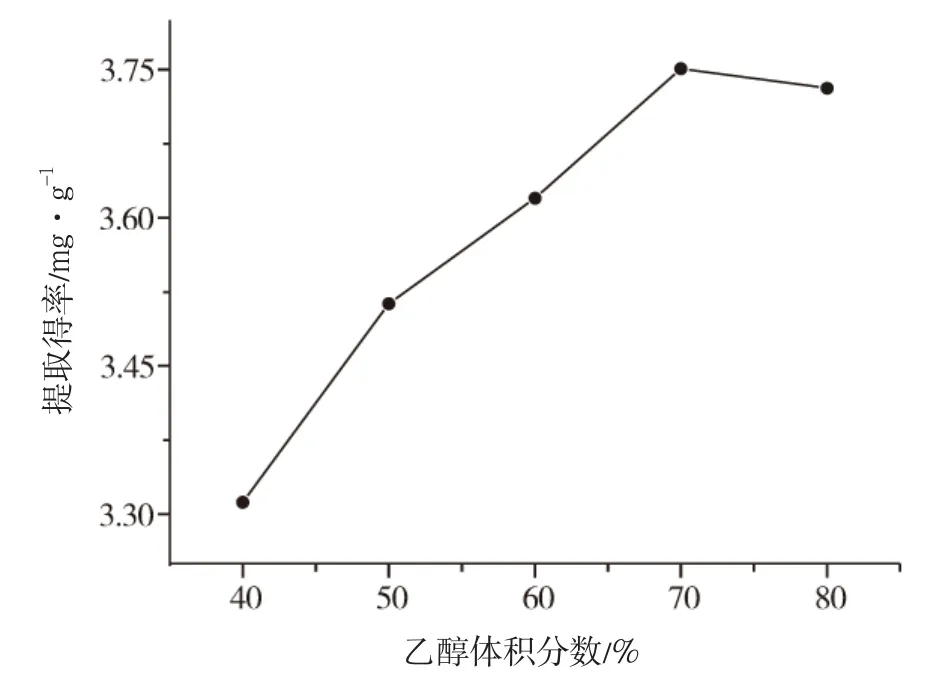
图3 乙醇体积分数对菊花脑总黄酮提取率影响
结果表明,乙醇体积分数增大,菊花脑总黄酮的提取率增加,当乙醇体积分数达到70%,菊花脑总黄酮的提取率最大,因此最佳提取浓度为70%。菊花脑总黄酮提取率随着乙醇体积分数的增加而增大,继续增加乙醇体积分数会使得黄酮提取得率下降。这可能是由于不同体积分数的乙醇极性不同,黄酮具有较高的极性,根据相似相容原理,70%的乙醇体积分数对细胞膜的破坏较大,溶出物增多,对菊花脑黄酮溶解量最大,提取率增大。
3.3.3 料液比对总黄酮提取率的影响
精确称取预处理过的菊花脑粉20g,微波功率400W,提取时间为30s,乙醇体积分数为 70%,考察料液比分别为1∶10、1∶15、1∶20、1∶25、1∶30时对菊花脑总黄酮提取率的影响,结果见图4。
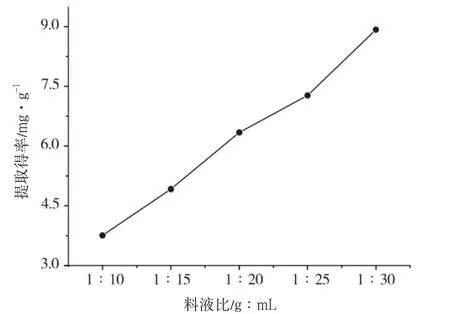
图4 料液比对菊花脑总黄酮提取率影响
结果表明,料液比增加,菊花脑总黄酮提取率持续增加,料液比为1∶30时,菊花脑总黄酮提取率最大。随着提取溶剂的增加,提取得率也随之增加。这可能是由于溶剂体积增大时,菊花脑粉与提取溶剂接触面的浓度差增大,进而使得黄酮物质更易渗透出来。因此提取的最佳料液比为1∶30。
3.3.4 微波时间对总黄酮提取率的影响
精确称取预处理过的菊花脑粉20g,固定料液比为1∶30(g∶mL),微波功率400W,乙醇体积分数为 70%,考察微波时间分别为20s、30s、40s、50s、60s、80s、120s时对菊花脑黄酮提取率的影响(图5)。
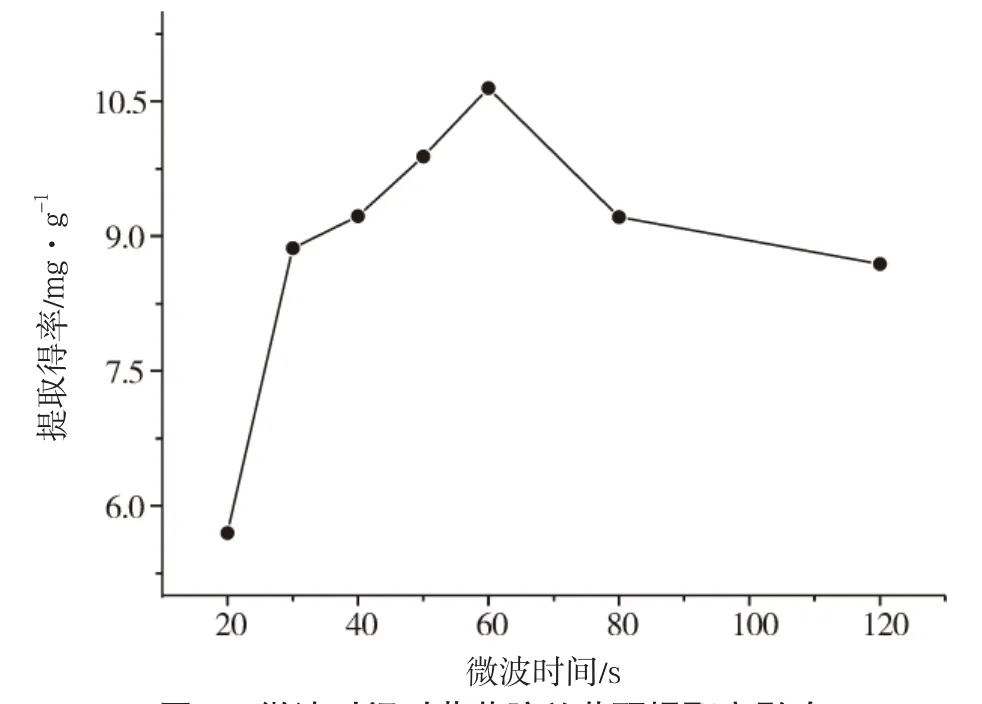
图5 微波时间对菊花脑总黄酮提取率影响
结果表明,随着微波时间增大,菊花脑总黄酮的提取率呈上下波动,当微波时间为60s时,菊花脑总黄酮的提取得率最大,所以最佳微波时间为60s。这可能是由于微波时间60s对细胞膜的破坏较大,增加了溶出物,提取率增高。60s之后提取得率会随着提取时间的增加反而降低,可能是因为菊花脑中某些黄酮物质被破坏。
4 结论
对上述5种提取方式进行比较发现,醇提、超声波提取、微波提取都能较大程度地对菊花脑总黄酮进行有效的提取利用,其中微波提取的得率最大,可达到10.646mg·g-1。考虑到绿色环保,并能对菊花脑总黄酮进行最大程度的利用开发,我们确定了醇提与微波提取相结合的方法。通过单因素试验结果的比较,确定提取菊花脑总黄酮的最优提取条件为:料液比1∶30、乙醇浓度 70%、微波功率400W、微波时间60s,此时黄酮提取得率为10.646mg·g-1。研究有助于了解菊花脑的成分功效,开发其潜在价值,研发出新的产品,将菊花脑的潜在市场扩大,并以此带动传统农产品和中药材的附加价值再利用。
[1] 杨念云,任爱农,胡万春,等.菊花脑嫩茎叶的化学成分[J].中国药科大学学报,2005,36(5):402-404.
[2] 刘晶晶,赵泓筠,韩平,等.响应面法优化菊花脑黄酮的提取工艺[J].食品科学,2012,33(16):68-71.
[3] 杨立刚,李莉华,林丽凤,等.南京菊花脑部分成分分析及挥发油的提取研究[J].现代食品科技,2010,26(2):212-214.
[4] 翁德宝,周丽娜.菊花脑多糖及黄酮类化合物分离提取的研究[J].湖南中医药大学学报,2007,27(8):349-351.
[5] 章莺鸿.菊花脑花70%乙醇提取物的抗氧化活性评价[J].化工时刊,2011,25(12):31-33.
[6] 纪丽莲.菊花脑茎叶挥发油的化学成分与抗霉菌活性的研究[J].食品科学,2005,26(10):91-94.
[7] 张丽娜,吕金顺,朱晓研,等. 淮安产菊花脑花精油化学成分及其抗氧化活性[J].常州大学学报,2011,23(3):69-73.
[8] 王华,张雄, 张国涛.荞麦中黄酮类化合物的分析方法研究进展[J].应用化工,2013,42(7):1331-1334.
[9] 陈丛瑾,黄克瀛.AlCl3显色分光光度法测定香椿叶中总黄酮[J].分析试验室,2006,25(12):91-94.
[10] 张荣泉,王莲,吕方.比色法测定果蔬纤维颗粒中总黄酮的含量[J].食品研究与开发,2008,29(10):95-97.
[11] 戴余军,江德安,肖前清.溶液提取银杏叶总黄酮方法的研究[J].广东农业科学,2010(1):102-104.
[12] 杨奕博.大豆异黄酮制备及提纯方法的研究[J].中国石油和化工标准与质量,2013(2):25.
[13] 赵永敢,石晓,刁静雯,等.微波辅助提取菊花脑多酚工艺研究[J].贵州农业科学,2010,38(5):212-214.[14] 李怡彬,郑明初,郑宝东.竹叶黄酮微波提取工艺的研究[J].农产品加工,2006,52(1):48-50.
[15] 李娜,毛永强.苦丁茶冬青叶总黄酮微波提取工艺[J].贵州农业科学,2011,39(5):212-214.
[16] 韩雪梅,许效群,王缘,等.苦荞中总黄酮提取优化工艺研究[J].山西农业大学学报,2017,37(2):134.
Extraction of Flavonoids from Chrysanthemum Nankingense
WANG Yabo, DU Hongxia, TAO Jinqiang, LIU Yanxiu
(School of Chemical Engineering and Materials Science, Nanjing Polytechnic Institute, Nanjing 210048, China)
Chrysanthemum nankingense fl avonoid (CNF) was extracted by microwave-extraction technology with the highest yield from chrysanthemum nankingense, compared with water-extraction, alcohol-extraction, freezing-thawing and ultrasonic-wave extraction technology. The optimal extraction conditions of CNF were: microwave power of 400W, alcohol concentration of 70%,material - liquid ratio of 1:30, time of 60s. Under these conditions, the maximum yield of was 10.646mg/g.
chrysanthemum nankingense; fl avonoids;extraction
Q 946
A
1671-9905(2017)12-0006-04
江苏高校品牌专业建设工程资助项目(PPZY2015B179); 2016年度江苏高校“青蓝工程”;南京科技职业学院科研课题(NHKY-2017-09)
都宏霞(1981-),女,吉林白山人,博士,主要研究方向:天然产物提取,催化动力学。E-mail:hxdu@mail.ustc.edu.cn
2017-09-18

