GATA3蛋白在小鼠胚胎发育中的表达研究
朱雨荷,李胜华,郑东旺,薛 靖,樊治宏,温丽星,王宇英
(1. 杭州师范大学生命与环境科学学院,浙江 杭州 310036; 2. 嘉兴市第一医院皮肤科,浙江 嘉兴 314001;3. 邯郸市中心医院神经内二科,河北 邯郸 056001)
GATA3蛋白在小鼠胚胎发育中的表达研究
朱雨荷1,李胜华2,郑东旺1,薛 靖3,樊治宏1,温丽星1,王宇英1
(1. 杭州师范大学生命与环境科学学院,浙江 杭州 310036; 2. 嘉兴市第一医院皮肤科,浙江 嘉兴 314001;3. 邯郸市中心医院神经内二科,河北 邯郸 056001)
为进一步探讨GATA3在蛋白水平上的时空表达模式,应用荧光免疫组织化学技术对其在小鼠胚胎发育各时期的表达进行了研究.结果显示:从E11.5到E17.5时期,其表达在神经系统(脑桥和脊髓)中随胎龄的增大而减弱;在感官系统(犁鼻器)中随胎龄的增大而位置有所迁移;在泌尿系统(肾脏)中随胎龄的增大而增强.
GATA3;小鼠胚胎;蛋白表达;荧光免疫组织化学
0 引言
真核生物中,GATA家族由能结合特异DNA序列(A/T GATA A/G)的锌指状结构转录因子组成,与个体发育和细胞分化等息息相关.其成员之一GATA3,在中枢神经系统[1]、内耳[2]、交感神经系统[3]、免疫系统[4]、造血系统[5]、皮肤和毛囊细胞[6]、肾管[7]、晶状体[8]、乳腺祖细胞[9]、乳腺癌转移[10]等方面扮演了非常关键的角色.此外,GATA3单倍剂量不足会导致常染色体显性遗传病甲状旁腺功能减退-感音神经性耳聋-肾发育不良(HDR)综合征的发病[11-12].目前为止,关于GATA3的功能和作用尚未被完全阐述清楚.
表达预示着功能.现有对于GATA3的表达研究仅停留在mRNA水平[13-15],并未将其在各组织器官的时空表达模式阐述完全[16-17].因此,本文应用荧光免疫组织化学技术系统地研究了GATA3蛋白在小鼠胚胎发育中的时间空间表达.
1 材料和方法
1.1 材料
1.1.1 供试动物
C57BL/6健康小鼠,6周龄雌鼠、6周龄雄鼠(购于杭州师范大学实验动物研究中心).在室温22 ℃、控光(12 h昼夜节律)条件下按常规饲养.所购小鼠至少适应环境1周后方用于实验.
1.1.2 小鼠胚胎的获取
第一天将雄性小鼠和雌性小鼠按1∶3比例合笼,次日上午9时观察雌性小鼠阴栓情况,阴栓阳性小鼠视为交配成功,另外分笼饲养并标明交配日期,从交配成功日起,计算受孕为0.5 d,依据实验要求在不同时间段处理胚胎.
1.1.3 主要试剂
OCT冰冻切片包埋剂,磷酸缓冲溶液(PBS),4%多聚甲醛溶液(PFA),10%,20%和30%蔗糖溶液,0.2% PBST,牛血清白蛋白(BSA),一抗Anti-Gata3(abcam,ab199428),二抗Anti-Rabbit(568 nm,life technologies,A10042).
1.2 冰冻切片
分别于胚胎发育至11.5,12.5,13.5,14.5,15.5,16.5,17.5和18.5 d时,采取断颈方法处死孕鼠取出胚胎,将胚胎置于PBS(4 ℃预冷)中剥除胎衣,再转移至4%多聚甲醛溶液,固定(注:15.5 d及以后胎龄的胚胎需头身分离分别固定).然后用0.1 mol/L PBS 15 min 洗3次,再依次加入10%,20%,30%蔗糖溶液梯度脱水,直至组织降至液体底部,彻底脱水防止冰晶形成,接着OCT包埋后于-80 ℃冰冻保存.用冰冻切片机切片,厚度为20 μm.
1.3 荧光免疫组织化学
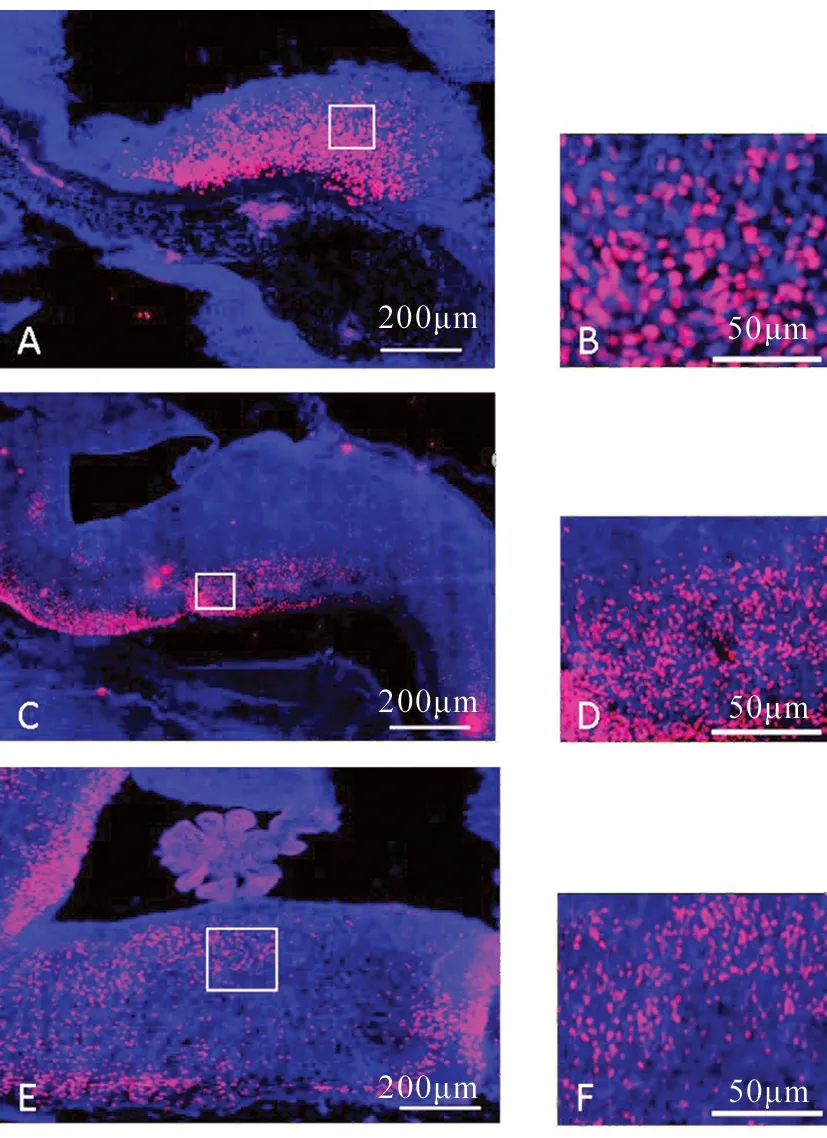
A,B:E11.5;C,D:E12.5;E,F:E13.5.B,D,F分别为A,C,E中白框范围的放大图.图1 GATA3在脑桥的表达情况Fig. 1 The expression of GATA3 in pons
切好的组织片放入1× PBS中洗2次,每次15 min;接着放入含0.2%Triton×-100的PBST中洗2次,每次15 min;用含2%BSA的封闭液,室温封闭1 h;加入按比例稀释的一抗,4 ℃过夜;片子取出后放入PBST中洗4次,每次10 min;再加入按比例稀释的二抗,室温孵育1.5 h;在1×PBST洗2次,每次5 min;然后加入DAPI,室温 5 min;在1×PBS中洗2次,每次5 min,封片拍照.抗体为Anti-Gata3(稀释比例1∶500),Anti-Rabbit(稀释比例1∶1 000).所有实验均重复3次.
2 结果
2.1 GATA3在脑桥的表达情况
脑桥是中枢神经系统中小脑和延髓之间的重要连接部位.从E11.5到E13.5时期,GATA3在脑桥部位均有表达(图1A,C,E),且表达强度随时间增加呈现明显的减弱趋势(图1B,D,F).当E13.5时呈明显的点状散在分布(图1F),之后表达消失.
2.2 GATA3在脊髓的表达情况
在E12.5,E15.5,E17.5时,GATA3在脊髓横断切片的腹侧部均有表达,且表现出明显的逐渐减少趋势(图2).
2.3 GATA3在背根神经节的表达情况
矢状面切片显示E13.5时,GATA3在背根神经节表达明显(图3),之后其它时期未检出.
2.4 GATA3在犁鼻器的表达情况
从E12.5到E15.5,GATA3在犁鼻器的呼吸上皮层表达(图4),并随时间增加呈明显的从两边向中间聚拢趋势(图4B,D,E,F).
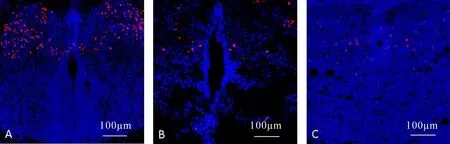
A:E12.5;B:E15.5;C:E17.5.脊髓横断面切片.图2 GATA3在脊髓的表达情况Fig. 2 The expression of GATA3 in spinal cord
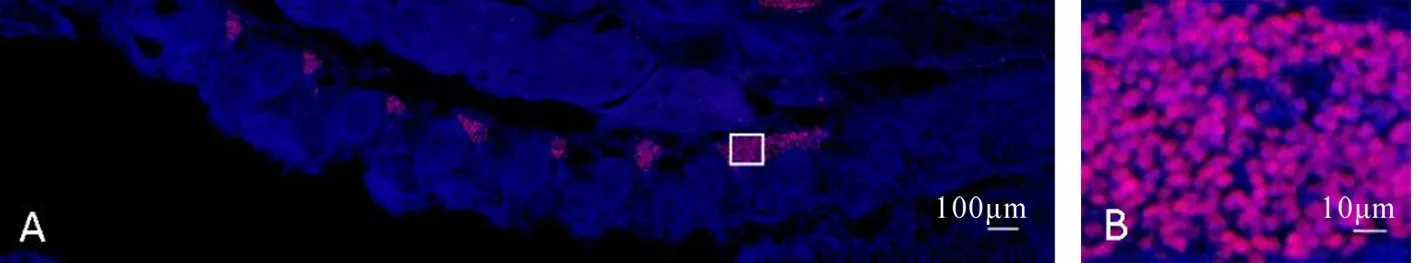
A:E13.5.B为A中白框范围的放大图.图3 GATA3在背根神经节的表达情况Fig. 3 The expression of GATA3 in dorsal root ganglion

A,B:E12.5;C,D:E13.5;E:E14.5;F:E15.5.横断面切片.B,D分别为A,C中白框范围的放大图.图 4 GATA3在犁鼻器的表达情况Fig. 4 The expression of GATA3 in vomeronasal organ
2.5 GATA3在舌的表达情况
当E13.5时,GATA3在舌部表达(图5),呈规律的条纹状,其在E11.5表达不明显,之后的时期表达消失.

A:E13.5.舌的矢状面切片.B为A图中白框范围的放大图.图5 GATA3在舌的表达情况Fig. 5 The expression of GATA3 in tongue
2.6 GATA3在肾的表达情况
从E12.5到E17.5, GATA3完全且局限于肾小管上皮部位,并随时间增加呈现递增趋势(图6).

A:E12.5;B:E13.5;C:E17.5.肾的横断面切片.图6 GATA3在肾的表达情况Fig. 6 The expression of GATA3 in kidney
3 讨论
已有的原位杂交实验结果[1,15]显示:中枢神经系统中,GATA3在脑桥、脊髓和背根神经节的表达都始于E11.5;在脑桥的表达于E12.5时减少,E14.5时限制更加严重;在脊髓的表达于E12.5时只限于腹侧;在背根神经节的表达于E12.5时消失.另外,E14.5时,在犁鼻器检测到Gata3mRNA,但缺乏对其时空表达变化的研究.犁鼻器(VON)在鼠类的社会行为中发挥着化学信号调节作用,特别是对攻击命令等[18].
有别与前述研究,笔者分析了GATA3在蛋白水平上的时空表达,结果发现:在脑桥的表达从E11.5到E13.5,且呈强度减弱趋势,E14.5之后的表达消失(图1);在脊髓,从E12.5到E17.5时期,表达持续存在于腹侧,呈逐渐减少趋势(图2);背根神经节,E13.5时表达明显,之后其他时期未检出(图3);在犁鼻器部位,从E12.5到E15.5时期表达在呼吸上皮层,且呈明显的从两边向中间聚拢趋势(图4),预示着GATA3可能在呼吸系统发育中发挥重要功能,需要进一步的探讨.GATA3在舌头部位的表达结果显示E13.5时表达明显(图5),其作用尚需进一步探究.
此外,关于肾功能缺陷与GATA3基因突变的关系,之前曾有相左的病例报道[19-20],虽然有对相关机制的探讨[21-22],但还未阐述清楚.本文的实验结果显示:GATA3在肾脏的表达从E12.5到E17.5呈现递增趋势,且随肾小管的增大而增大,完全且局限于各个独立的肾小管上皮部位,这对将来其功能的机制探讨有参考价值.
综上所述,本研究更加系统地探讨了GATA3在蛋白水平上的时空表达模式,从小鼠胚胎E11.5到E17.5时期,在神经系统(脑桥、脊髓、背根神经节)、感官系统(犁鼻器、舌)以及泌尿系统(肾脏),都有新发现.本文研究结果对GATA3在蛋白水平上的表达进行了深入阐述,也是对之前相关数据的完善.
[1] NARDELLI J, THIESSON D, FUJUWARA Y, et al. Expression and genetic interaction of transcription factors GATA-2 and GATA-3 during development of the mouse central nervous system[J]. Dev Biol,1999,210(2):305-321.
[2] KUREK D, GARINIS G A, VAN DOORNINCK J H, et al. Transcriptome and phenotypic analysis reveals Gata3-dependent signalling pathways in murine hair follicles[J]. Development,2007,134(2):261-272.
[3] LIM K C, LAKSHMANAN G, CRAWFORD S E, et al. Gata3 loss leads to embryonic lethality due to noradrenaline deficiency of the sympatheticnervous system[J]. Nat Genet,2000,25(2):209-212.
[4] ZHU J, TAMANE H, COTE-SIERRA J, et al. GATA-3 promotes Th2 responses through three different mechanisms: induction of Th2 cytokine production, selective growth of Th2 cells and inhibition of Th1 cell-specific factors[J]. Cell Res,2006,16(1):3-10.
[5] PANDOLFI P P, ROTH M E, KARIS A, et al. Targeted disruption of the GATA3 gene causes severe abnormalities in the nervous system and in fetal liver haematopoiesis[J]. Nat Genet,1995,11(1):40-44.
[6] KAUFMAN C K, ZHOU P, PASOLLI H A, et al. GATA-3: an unexpected regulator of cell lineage determination in skin[J]. Genes Dev,2003,17(17):2108-2122.
[7] LABASTIE M C, CATALA M, GREGOIRE J M, et al. The GATA-3 gene is expressed during human kidney embryogenesis[J]. Kidney Int,1995,47(6):1597-1603.
[8] MAEDA A, MORIGUCHI T, HAMADA M, et al. Transcription factor GATA-3 is essential for lens development[J]. Dev Dyn,2009,238(9):2280-2291.
[9] ASSELIN-LABAT M L. Mammary stem and progenitor cells: critical role of the transcription factor Gata-3[J]. Med Sci,2007,23(12):1077-1080.
[10] FANG S H, CHEN Y Z, WEIGEL R J. GATA-3 as a marker of hormone response in breast cancer[J]. J Surg Res,2009,157(2):290-295.
[11] VAN ESCH H, DEVRIENDT K. Transcription factor GATA3 and the human HDR syndrome[J]. Cell Mol Life Sci,2001,58(9):1296-1300.
[12] VAN ESCH H, GROENEN P, NESBIT M A, et al. GATA3 haplo-insufficiency causes human HDR syndrome[J]. Nature,2000,406(6794):419-422.
[13] KO L J, YAMAMOTO M, LEONARD M W, et al. Murine and human T-lymphocyte GATA-3 factors mediate transcription through a cis-regulatory element within the human T-cell receptor δ gene enhancer[J]. Mol Cell Biol,1991,11(5):2778-2784.
[14] OOSTERWEGEL M, TIMMERMAN J, LEIDEN J, et al. Expression of GATA-3 during lymphocyte differentiation and mouse embryogenesis[J]. Dev Immunol,1992,3(1):1-11.
[15] GEORGE K M, LEONARD M W, ROTH M E, et al. Embryonic expression and cloning of the murine GATA-3 gene[J]. Development,1994,120:2673-2686.
[16] HAUGAS M, LILLEVALI K, SALMINEN M. Defects in sensory organ morphogenesis and generation of cochlear hair cells inGata3-deficient mouse embryos[J]. Hear Res,2012,283(1/2):151-161.
[17] LUO X J, DENG M, XIE X L, et al. GATA3 controls the specification of prosensory domain and neuronal survival in the mouse cochlea[J]. Hum Mol Genet,2013,22(18):3609-3623.
[18] BRIGNALL A C, CLOUTIER J F. Neural map formation and sensory coding in the vomeronasal system[J]. Cell Mol Life Sci,2015,72(24):4697-4709.
[19] BILOUS R W, MURTY G, PARKINSON D B, et al. Autosomal dominant familial hypoparathyroidism, sensorineural deafness, and renaldysplasia[J]. N Engl J Med,1992,327(15):1069-1074.
[20] VAN ESCH H, GROENEN P, FRYNS J P, et al. The phenotypic spectrum of the 10p deletion syndrome versus the classical DiGeorge syndrome[J]. Genet Couns,1999,10(1):59-65.
[21] GROTE D, SOUABNI A, BUSSLINGER M, et al. Pax 2/8-regulated Gata3 expression is necessary for morphogenesis and guidance of thenephric duct in the developing kidney[J]. Development,2006,133(1):53-61.
[22] GROTE D, BOUALIA S K, SOUABNI A, et al. Gata3 acts downstream of beta-catenin signaling to prevent ectopic metanephric kidney induction[J]. PLoS Genet,2008,4(12):e1000316.
TheExpressionPatternofGATA3ProteininMouseEmbryonicDevelopment
ZHU Yuhe1, LI Shenghua2, ZHENG Dongwang1, XUE Jing3, FAN Zhihong1, WEN Lixing1, WANG Yuying1
(1. College of Life and Environmental Sciences, Hangzhou Normal University, Hangzhou 310036, China;2. Dermatology Department, The First Hospital of Jiaxing, Jiaxing 314001, China;3. Neurology Department, Handan Center Hospital, Handan 056001, China)
To further discuss the temporal and spatial expression pattern of GATA3 on protein level, immunofluorescence histochemical technique is applied to study the expression of GATA3 in mouse embryonic development. The results show that from E11.5 to E17.5 period, the expression of GATA3 in nervous system (pons and spinal cord) decreases with the increase of gestational age, migrates with the increase of gestational age in sensory system (vomeronasal organ), and increases with the increase of gestational age in urinary system (kidney).
GATA3; mouse embryo; protein expression; immunofluorescence histochemistry
2017-03-29
国家自然科学基金项目(81401811).
王宇英(1981-),女,实验师,博士,主要从事发育生物学研究.E-mail:yywwhz@163.com
10.3969/j.issn.1674-232X.2017.06.006
Q189
A
1674-232X(2017)06-0599-05

