黄河口牡蛎产卵场及邻近海域大型底栖动物现状评价
王志忠,张金路 顾汉东 李壮,巩俊霞 许国晶,客涵
(山东省淡水渔业研究院,山东 济南 250117;山东省淡水水产遗传育种重点实验室,山东 济南 250117) (山东省滨州市滨城区水产局,山东 滨州 256600) (山东省淡水渔业研究院,山东 济南 250117;山东省淡水水产遗传育种重点实验室,山东 济南 250117)
黄河口牡蛎产卵场及邻近海域大型底栖动物现状评价
王志忠,张金路 顾汉东 李壮,巩俊霞 许国晶,客涵
(山东省淡水渔业研究院,山东 济南 250117;山东省淡水水产遗传育种重点实验室,山东 济南 250117) (山东省滨州市滨城区水产局,山东 滨州 256600) (山东省淡水渔业研究院,山东 济南 250117;山东省淡水水产遗传育种重点实验室,山东 济南 250117)
分别于2015年5月、6月和8月对黄河口牡蛎(Crassostrearivularis)产卵场及邻近海域大型底栖动物现状进行3个航次的外业调查研究,结果表明:该海域共获大型底栖动物49种;其中软体动物19种,多毛类15种,甲壳类11种,棘皮动物和其他类均2种;软体动物和多毛类是构成该海域大型底栖动物的主要群落。大型底栖动物主要有32种,其中软体动物14种、多毛类11种、甲壳类5种、棘皮动物和其他类各1种。大型底栖动物栖息密度为30~305ind./m2,均值102.67ind./m2,6月最高,6月和5月显著高于8月,8月最低;以多毛类最高,其次是软体动物,再次是甲壳类和其他类,棘皮动物最低。生物量为0.12~65.83g/m2,均值13.93g/m2;6月最高,显著高于8月和5月,5月最低;以软体动物最高,其次是棘皮动物和甲壳类,多毛类和其他类相对较低。优势度指数为2.57~14.52,均值6.41;丰富度指数为0.77~3.67,均值2.10;多样性指数为1.46~4.05,均值2.79;均匀度指数为0.80~0.98,均值0.89。该海域环境质量以清洁和轻污染为主;5月和6月环境质量优于8月。
黄河口;牡蛎(Crassostrearivularis)产卵场;大型底栖动物;生物多样性;环境质量
大型底栖动物是海洋生态系统中的一个重要生态类群,大多生活在有氧和有机质丰富的沉积物表层,通过作用于底层水体环境,参与水体营养物循环,并影响污染物的迁移转化与沉积物的稳定性,在海洋生态系的能流和物流中占有十分重要的地位[1]。为研究黄河口牡蛎(近江牡蛎Crassostrearivularis)产卵场修复及重建技术,分别于2015年5月、6月和8月对黄河口牡蛎产卵场及邻近海域大型底栖动物现状进行了调查研究与分析,并采用Margalef物种丰富度指数(d)、Shannon-Wiener多样性指数(H′)、Sinpson优势度指数(D)、Pielou均匀度指数(J′)和大型底栖动物污染指数法(MPI)综合评价了该海域环境质量,旨在为黄河口牡蛎产卵场修复与重建提供科学依据。
1 材料与方法
1.1 研究区域与调查站位
分别于2015年5月、6月和8月对黄河口牡蛎(Crassostrearivularis)产卵场及邻近海域生态环境进行了3个航次的采样调查;每航次采样调查均为5个站位,分别编号为1号、2号、3号、4号和5号站位。调查区域为E 119° 4′34.99″~ 119° 8′41.94″,N 37°28′34.01″~ 37°35′19.95″,调查面积约68.88km2,调查采样站位分布详见图1。

图1 黄河口牡蛎产卵场及邻近海域调查站位图
1.2 取样方法
大型底栖动物定量采样,采用型号为QNC6-1的挖泥斗,采样面积为0.1m2,每次调查每个站位均采集4次,合并为一个样品,将采得的底泥放入孔径为0.5mm的不锈钢筛子中(用0.5mm孔径的不锈钢网筛分选)用水冲洗,同时捡出筛上的底栖动物,按类别分别装瓶,固定后写好相应的标签,保存并带回实验室进行种类鉴定、个体计数、生物量称量等。底栖动物样品的处理、保存、计数、称量等均按文献[2]的方法进行。
1.3 生态优势度
采用Pinkas等(1971)[3]的相对重要性指数(Index of Relative Importance,IRI)确定种类在群落中的重要性。对各种类在数量、重量中所占比例和出现频率3个方面进行优势度的综合评价,判断其在群落中的重要程度,用于底栖生物优势种判断,计算公式为:
IRI=(N+W)×F
式中,N为某种类的数量百分比;W为某种类的重量百分比;F为某种类的出现频率。将IRI≥1000的种类定义为优势种,100≤IRI<1000的种类定义为重要种,10≤IRI<100的种类定义为常见种,IRI<10的种类定义为少见种。将IRI≥100的种类(包括优势种和重要种)视为群落的主要种类。
1.4 生物多样性指数
采用Margalef物种丰富度指数(d)[4]、Shannon-Wiener多样性指数(H′)、Sinpson优势度指数(D)[5]和Pielou均匀度指数(J′)[6]等4项指数进行底栖动物群落种类组成的多样性分析。相应的环境质量评价标准见表1。

表1 多样性指数、物种丰富度指数、优势度指数和均匀度指数的环境质量评价标准
1.4 大型底栖动物污染指数(MPI)
计算公式如下[7]:
MPI=10(2+k)[∑(Ai-Bi)]/S1+k
k=|∑(Ai-Bi)|/∑(Ai-Bi)
式中,MPI为大型底栖动物污染指数;Ai为密度累积百分优势度;Bi为生物量累积百分优势度,即密度优势度大小顺序是第i个种,其密度累积百分优势度为Ai,生物量优势度大小顺序是第i个种,其生物量累积百分优势度为Bi;S为采集到的物种数。当∑(Ai-Bi)为正值时,k=1;当∑(Ai-Bi)为负值时,k=-1。值得注意的是,由于密度和生物量是分别排序的,因此Ai与Bi并不一定是指同一物种的密度和生物量。
根据蔡立哲[7]的研究结果,MPI污染程度界定为:当MPI>4时,为严重污染;MPI=4~0,为中度污染;MPI=-6~0时,为轻度污染;MPI<-6时,为清洁。
2 结果与分析
2.1 种类组成
3次采样共采集到大型底栖动物49种:软体动物19种(占38.78%),多毛类15种(占30.61%),甲壳类11种(占22.45%),棘皮动物和其他类均2种(各占4.08%)。5月采集到32种,其中软体动物11种(占34.38%),多毛类10种(占31.25%),甲壳类8种(占25.00%),棘皮动物1种(占3.13%),其他类2种(占6.25%);6月采集到34种,其中软体动物13种(占38.24%),多毛类11种(占32.35%),甲壳类7种(占20.59%),棘皮动物2种(占5.88%),其他类1种(占2.94%);8月采集到25种,其中多毛类和软体动物均9种(各占36.00%),甲壳类3种(占12.00%),棘皮动物和其他类均2种(各占8.00%)。可见,软体动物和多毛类在不同采集时间均占总种数的30%以上,是构成该海域底栖动物的主要群落,表明该海域大型底栖动物群落多样性,以软体动物和多毛类为主;大型底栖动物种类数量6月和5月的显著高于8月,以6月最多,5月次之,8月最少。
2.2 优势种
生态优势度分析结果(表2)表明,该海域大型底栖动物主要种32种,其中软体动物14种、多毛类11种、甲壳类5种、棘皮动物和其他类均1种。5月主要种18种,其中优势种5种,重要种13种;6月主要种16种,其中优势种6种,重要种10种;8月主要种12种,其中优势种3种,重要种9种。可见该海域底栖动物主要种和重要种数量均随时间推移而逐渐减少,优势种数量则以6月最多,5月次之,8月最少。
2.3 生物量
由图2可以看出,该海域大型底栖动物栖息密度为30~305ind./m2,均值102.67ind./m2。其中5月栖息密度为30~180ind./m2,均值111ind./m2;6月为55~305ind./m2,均值124ind./m2;8月为30~170ind./m2,均值73ind./m2。可见,6月栖息密度最高,6月和5月显著高于8月,8月最低;各站位栖息密度随着站位编号的增加而逐渐减少,以1号站位最高(218.33ind./m2),5号站位最低(40ind./m2)。由图2可知,1号站位不同采样时间栖息密度均显著高于其他站位,尤以6月最高,这是由于经氏壳蛞蝓(50ind./m2)、不倒翁虫(45ind./m2)和细长涟虫(30ind./m2)等栖息密度相对较高所引起。
该海域大型底栖动物生物量为0.12~65.83g/m2,均值为13.93g/m2。其中5月生物量为1.32~12.76g/m2,均值为6.80g/m2;6月为2.83~65.83g/m2,均值为24.72g/m2;8月为0.12~18.72g/m2,均值为10.28g/m2。表明6月生物量最高,显著高于8月和5月,5月最低;最高值出现在2号站位(28.69g/m2),最低值出现在4号站位(3.35g/m2)。造成2号站位生物量最高的主要原因,可能与6月该站位毛蚶生物量高达38.81g/m2,致使其生物量显著高于其他站位有关。各站位大型底栖动物生物量分布与变化见图3。
群落栖息密度组成中,以多毛类最高(39.67ind./m2),其次是软体动物(32.00ind./m2),再次甲壳类(14.33ind./m2)和其他类(12.67ind./m2,棘皮动物最低(4.00ind./m2)(图4)。多毛类和甲壳类栖息密度均随采样时间的推移而逐渐降低,软体动物和棘皮动物均以6月最高,而其他类则以5月最高。
群落生物量组成中,以软体动物最高(5.28g/m2),其次是棘皮动物(3.70g/m2)和甲壳类(2.89g/m2),多毛类(1.70g/m2)和其他类(0.37g/m2)相对较低(图5)。棘皮动物的栖息密度最低,而生物量则较高,这可能主要是由于6月3号和5号站位棘刺锚参生物量分别达18.21g/m2和18.54g/m2,致使其生物量相对较高。

表2 大型底栖动物主要种类生态优势度
2.4 多样性
由表3可知,该海域大型底栖动物多样性指数变化范围为1.46~4.05,均值2.79。其中5月为1.79~4.05,均值3.13,最低值出现在5号站位,最高值出现在2号站位;6月为1.87~3.98,均值2.83,最低值出现在5号站位,最高值出现在1号站位;8月为1.46~3.11,均值2.42,最低值出现在4号站位,最高值出现在1号站位。可见5月多样性指数明显高于6月和8月;5号和4号站位多样性指数相对较低,而1号和2号站位相对较高。

图2 大型底栖动物栖息密度分布与变化 图3 大型底栖动物生物量分布与变化
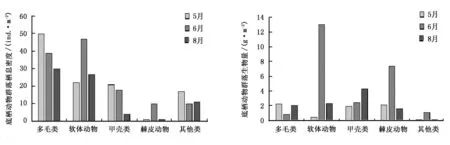
图4 大型底栖动物群落栖息密度 图5 大型底栖动物群落生物量
优势度指数变化范围为2.57~14.52,均值6.41。其中5月为3.00~14.52,均值8.30,最低值出现在5号站位,最高值出现在2号站位;6月为2.81~11.96,均值6.11,最低值出现在5号站位,最高值出现在1号站位;8月为2.57~6.25,均值4.82,最低值出现在4号站位,最高值出现在2号站位。可见5月和6月优势度指数明显高于8月;5号和4号站位优势度指数相对较低,而1号和2号站位相对较高。
丰富度指数变化范围在0.77~3.67之间,均值2.10。其中5月为1.16~3.67,均值2.41,最低值出现在5号站位,最高值出现在2号站位;6月为1.16~3.54,均值2.21,最低值出现在5号站位,最高值出现在1号站位;8月为0.77~2.56,均值1.68,最低值出现在4号站位,最高值出现在1号站位。表明5月和6月丰富度指数明显高于8月;5号和4号站位丰富度指数相对较低,而1号和2号站位相对较高。
均匀度指数变化范围在0.80~0.98之间,均值0.89。其中5月为0.90~0.95,均值0.92;6月为0.80~0.95,均值0.86;8月为0.82~0.98,均值0.90。表明5月均匀度指数最高,6月次之,8月最低。
2.5 水域环境质量评价
由表4可以看出,因站位和采样时间不同,大型底栖动物物种数存在一定差异。各站位物种总数随着站位编号的增加而逐渐减少;2号、3号和4号站位物种数均随着时间的推移而逐渐减少,1号站位以6月最多,5月和8月相对较少,而5号站位则是随着时间的推移而逐渐增多。
由表3可知,该海域大型底栖动物优势度指数(D)大于6、属清洁的站位占46.67%,在6~3之间、属轻污染的站位占40.00%,在3~2之间、属中污染的站位占13.33%,可见其环境质量以清洁和轻污染为主。D值均值为6.41,其中5月为8.30、6月为6.11、8月为4.81,因此该海域总体环境质量为清洁水平,5月和6月均为清洁,8月为轻污染,可见5月和6月环境质量明显优于8月。
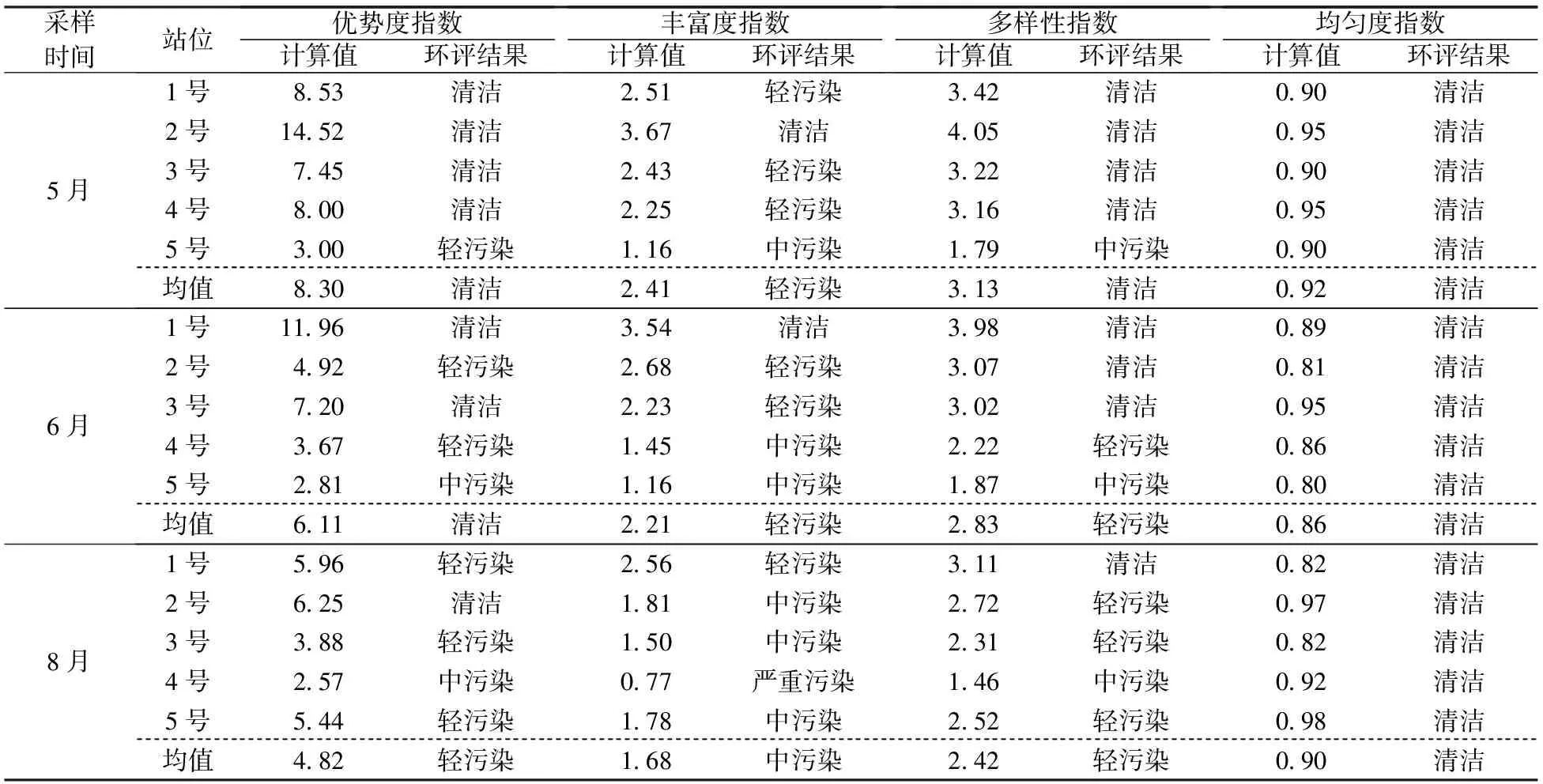
表3 大型底栖动物物种多样性指数及环境质量评价
丰富度指数(d)大于3、属清洁的站位占13.33%,在3~2之间、属轻污染的站位占40.00%,在2~1之间、属中污染的站位占40.00%,小于1、属严重污染的站位占6.67%,可见其环境质量以轻污染和中污染为主。d值均值为2.10,其中5月为2.41、6月为2.21、8月为1.68,因此该海域总体环境质量为轻污染水平,5月和6月均为轻污染,8月为中污染。可见5月和6月环境质量明显优于8月。

表4 大型底栖动物MPI及其环境质量评价
多样性指数(H′)大于3、属清洁的站位占53.33%,在3~2之间、属轻污染的站位占26.67%,在2~1之间、属中污染的站位占20.00%,可见其环境质量以清洁为主。H′值均值为2.79,其中5月为3.13、6月为2.83、8月为2.42,因此该海域总体环境质量为轻污染水平,5月为清洁,6月和8月均为轻污染。可见5月环境质量明显优于6月和8月。
各站位均匀度指数(J′)均大于0.5,因此各站位环境质量均为清洁,总体环境质量为清洁水平,表明不同采样时间该海域环境质量均较好。
由表4可见,MPI<-6、属清洁的站位占93.33%,在-6~0之间、属轻度污染的站位占6.67%;可见其环境质量以清洁为主。MPI的均值以及各月均值均小于-6,因此该海域环境质量为清洁水平。
根据上述结果,综合评价可以得出该海域环境质量以清洁和轻污染为主;5月和6月环境质量明显优于8月。
3 讨论与结论
黄河口牡蛎产卵场及邻近海域大型底栖动物共获49种;其中软体动物19种,多毛类15种,甲壳类11种,棘皮动物和其他类均2种。5月大型底栖动物32种,其中软体动物11种,多毛类10种,甲壳类8种,棘皮动物1种,其他类2种;6月34种,其中软体动物13种,多毛类11种,甲壳类7种,棘皮动物2种,其他类1种;8月25种,其中多毛类和软体动物均9种,甲壳类3种,棘皮动物和其他类均2种。因此软体动物和多毛类是构成该海域底栖动物的主要群落;6月和5月的种类数量显著高于8月。
大型底栖动物主要种有32种,其中软体动物14种、多毛类11种、甲壳类5种、棘皮动物和其他类均1种。5月主要种18种,其中优势种5种,重要种13种;6月主要种16种,其中优势种6种,重要种10种;8月主要种12种,其中优势种3种,重要种9种。表明该海域大型底栖动物主要种和重要种数量均随时间推移而逐渐减少,优势种数量则以6月最多,5月次之,8月最少。
该海域与我国主要河口水域研究结果相比较,大型底栖动物种类数量低于黄河口153种[8]与 64种[9]、滨州浅海81种[10],与长江口50种[11]接近,而高于珠江口34种[12],这可能与研究区域、研究时间、采样次数、受河口径流影响的程度等因素不同有关。
该海域大型底栖动物栖息密度为30~305ind./m2,均值102.67ind./m2。其中5月栖息密度为30~180ind./m2,均值111ind./m2;6月为55~305ind./m2,均值124ind./m2;8月为30~170ind./m2,均值73ind./m2。表明6月栖息密度最高,6月和5月显著高于8月,8月最低。以多毛类栖息密度最高,其次是软体动物,再次甲壳类和其他类,棘皮动物最低;多毛类和甲壳类栖息密度均随采样时间的推移而逐渐降低,软体动物和棘皮动物均以6月最高,而其他类则以5月最高。生物量为0.12~65.83g/m2,均值为13.93g/m2。5月生物量为1.32~12.76g/m2,均值为6.80g/m2;6月为2.83~65.83g/m2,均值为24.72g/m2;8月为0.12~18.72g/m2,均值为10.28g/m2。表明6月生物量最高,显著高于8月和5月,5月最低。以软体动物生物量最高,其次是棘皮动物和甲壳类,多毛类和其他类相对较低。
与黄河口水域相比,该海域大型底栖动物平均栖息密度明显低于557ind./m2[13]、260ind./m2[8],而明显高于(76.43±10.71)ind./m2[9];平均生物量明显低于35.28g/m2[13],而明显高于(9.44±2.04)g/m2[9]和8.74g/m2[8]。与我国主要河口水域相比较,该海域平均栖息密度明显低于珠江口春季759ind./m2和秋季274ind./m2[12]、长江口150ind./m2[11]和滨州浅海3836.83ind./m2[10],可见该海域大型底栖动物平均栖息密度相对较低;平均生物量低于长江口17.57g/m2[11]和滨州浅海48.65g/m2[10],而明显高于珠江口春季5.03g/m2和秋季2.34g/m2[12]。
该海域大型底栖动物优势度指数为2.57~14.52,均值6.41;5月和6月优势度指数明显高于8月。丰富度指数在0.77~3.67之间,均值2.10;5月和6月明显高于8月。多样性指数为1.46~4.05,均值2.79;5月多样性指数明显高于6月和8月。均匀度指数在0.80~0.98之间,均值0.89;5月均匀度指数最高,6月次之,8月最低。
该海域大型底栖动物多样性指数高于黄河口2.35[8]和(1.45±0.02)[9]、珠江口(2.18±0.55)[14]和0.79~1.49[12],以及滨州浅海(1.73±0.22)[10];均匀度指数高于黄河口0.85[8]和(0.77±0.02)[9]、珠江口0.49~0.74[12],以及滨州浅海(0.46±0.10)[10];丰富度指数高于黄河口1.13[8]和(0.90±0.02)[9]、珠江口0.67~1.40[12],以及滨州浅海(1.75±0.24)[10];优势度指数明显高于滨州浅海(3.22±0.91)[10]。可见黄河口牡蛎产卵场及邻近海域大型底栖动物多样性指数、均匀度指数、丰富度指数和优势度指数均相对较高。这可能主要是由于该海域受河流径流量影响的程度远低于上述河口研究区域的缘故。
采用优势度指数(D)、丰富度指数(d)、多样性指数(H′)、均匀度指数(J′)和大型底栖动物污染指数(MPI)综合评价,该海域环境质量以清洁和轻污染为主;5月和6月环境质量明显优于8月。该海域环境质量明显优于以轻度污染为主的黄河口水域[8]和滨州浅海[10],表明该海域环境质量相对较好。
[1]刘晓收,范颖,史书杰,等. 渤海大型底栖动物种类组成与群落结构研究[J]. 海洋学报, 2014, 36(12):53~66.
[2]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. 海洋调查规范 第6部分:海洋生物调查(GB/T 12763.6.2007)[S]. 北京:中国标准出版社,2007.
[3]Pinkas L, Oliphant M S, Iverson I L K . Food habits of albacore, bluefin tuna, and bonito in California waters[J]. California Department of Fish and Game Fish Bulletin, 1971, 152, 1~105.
[4]Margalef R. Perspective In Ecological Theory[M].Chicago, Illinois, USA: University of Chicago Press, 1968.
[5]Shannon C E, Weaver W. The mathematical Theory of Communication [M]. Urbana IL: University of Illinois Press, 1949.
[6]Pielou E C. Ecological Diversity[M]. New York: John Wiley and Sons, 1975.
[7]蔡立哲. 大型底栖动物污染指数(MPI)[J]. 环境科学学报, 2003, 23(5):625~629.
[8]冷宇,刘一霆,杜明,等. 黄河口海域2004~2009年春季大型底栖动物群落的时空变化[J]. 海洋学报,2013,35(6):128~139.
[9]王志忠, 张金路, 杜兴华, 等. 黄河口底栖动物群落特征及其环境质量评价[J]. 生态科学, 2014, 33(2): 269~275.
[10]王志忠,张金路,许国晶,等. 2012年滨州浅海大型底栖动物现状评价[J]. 海洋环境科学,2016, 35(4): 526~533.
[11]孙亚伟, 曹 恋, 秦玉涛, 等. 长江口邻近海域大型底栖生物群落结构分析[J]. 海洋通报, 2007, 26(2):66~70.
[12]彭松耀, 赖子尼, 蒋万祥, 等. 珠江口大型底栖动物的群落结构及影响因子研究[J]. 水生生物学报. 2001, 34(6):1179~1189.
[13]张志南, 图立红, 于子山. 黄河口及其邻近海域大型底栖动物的初步研究 (一) 生物量[J]. 青岛海洋大学学报, 1990, 20(1): 37~45.
[14]张景平, 黄小平, 江志坚, 等. 珠江口海域污染的水质综合污染指数和生物多样性指数评价[J]. 热带海洋学报, 2010, 29(1):69~76.
2017-06-02
海洋公益性行业科研专项经费项目(201405010)。
王志忠(1968-),男,高级工程师,主要从事渔业生态学研究,zhizhongwang@163.com。
[引著格式]王志忠,张金路,顾汉东,等.黄河口牡蛎产卵场及邻近海域大型底栖动物现状评价[J].长江大学学报(自科版),2017,14(22):37~44.
S932.8
A
1673-1409(2017)22-0037-08
[编辑] 余文斌

