观果树种轮生冬青离体快繁技术1)
王欢 杜凤国 兰河 李玉峰
(吉林省林业与生态环境重点实验室(北华大学),吉林省·吉林市,132013) (辽源市锦绣谷生态园艺有限公司)
观果树种轮生冬青离体快繁技术1)
王欢 杜凤国 兰河 李玉峰
(吉林省林业与生态环境重点实验室(北华大学),吉林省·吉林市,132013) (辽源市锦绣谷生态园艺有限公司)
以轮生冬青幼嫩茎段为外植体,通过筛选启动培养基、比较不同增殖培养基及继代次数对增殖的影响,生根诱导培养基的筛选,建立了轮生冬青的离体快速繁殖技术体系。结果表明:最适腋芽诱导培养基为B5+6-BA1.0 mg·L-1+IBA0.05 mg·L-1;适宜增殖培养基为B5+6-BA1.5 mg·L-1+IBA0.3 mg·L-1,第4次继代时增殖系数最大为6.3,丛生芽长势好;适宜的继代周期为35 d;最佳生根培养基为1/2B5+IBA0.2 mg·L-1+NAA0.3 mg·L-1,生根率可达100%。移栽于V(珍珠岩)∶V(蛭石)∶V(腐殖土)=2∶1∶1的混合基质中,成活率达90%以上。
轮生冬青;继代次数;组织培养;植株再生
轮生冬青(Ilexverticillata)又名北美冬青,是冬青科(Aquifoliaceae)冬青属落叶灌木;雌雄异株,花小白色,数朵丛生于叶腋,密集鲜红的浆果经冬不落,是珍贵的观果树种。原产北美东部和加拿大东南部,喜生长于潮湿地区,在欧美国家普遍用作切枝观果和园林景观美化。轮生冬青具有很强的抗寒性、耐热性,喜光梢耐阴,喜肥沃微酸性至中性土壤,喜温暖湿润环境,可在我国北至黑龙江南至福建的大部分地区生长[1]。近几年来,国内已开始大量引种栽培及园林应用。
轮生冬青现多采用播种和扦插方式繁殖。其种子具有深休眠特性,未经低温层积处理的种子隔年发芽[2],低温冷藏结合80 ℃高温处理种子,当年萌发率可达90%以上[3],但种子繁殖后代的性状不稳定。目前,关于北美冬青扦插繁殖[4-8]研究较多,研究了插穗幼嫩程度及长度、不同生根剂及浓度、基质等对北美冬青成活率的影响。6、7月将北美冬青结果枝环剥0.5~1.0 cm宽,以稀释1/4~1/2的200 mg·L-1IBA+500 mg·L-1NAA的生根剂处理,可实现高空压条繁殖[9]。但扦插和压条繁殖受季节及树龄等多方面限制,且需要大量插穗。轮生冬青现普遍采用播种和扦插进行繁殖[2-8],也可通过高空压条繁殖[9]。但种子繁殖后代的性状不稳定,扦插和压条繁殖受季节、树龄及枝条质量等方面限制。而通过植物组织培养技术可采用较少的材料,实现周年生产。目前,利用该技术开展轮生冬青离体繁殖仅有少量报道。采用MS培养基,比较了不同外源激素对美洲冬青当年生枝条组培的影响[10]。张俊林等以北美冬青成年雌株半木质化茎段为材料,建立了以WPM为基本培养基的组织培养繁殖体系[11]。以北美冬青叶片和茎段为外植体,进行了愈伤组织诱导及分化的研究[12]。这些研究主要集中在离体快繁体系的构建,仅研究了继代培养一代的增殖率及生长分化情况,关于轮生冬青在组织离体培养过程中多次继代的增殖系数及组培苗质量等相关研究未见报道。本文在前人的研究基础上,比较不同基本培养基、继代周期及继代次数对轮生冬青生长分化的影响,为其继代增殖培养提供合理化建议,这将为实现轮生冬青的工厂化育苗、加快其推广应用等方面具有重要意义。
1 材料与方法
试验材料及处理:试验材料为吉林省辽源市锦绣谷生态园艺有限公司提供的由荷兰引种栽培8年的扦插苗。2016年5月20日剪取生长健壮、无病虫害的当年萌发的枝条,放在盛有清水的塑料烧杯中带回实验室。先将枝条置于流水下冲洗30 min,然后剪去叶片,留少许叶柄,参考范诸平等[13]对外植体的处理方法。先将枝条置于流水下冲洗30 min,然后剪去叶片,留少许叶柄,修剪成5~6 cm长的茎段,放在盛有洗洁精溶液的烧杯中浸泡20 min,其间不断搅动,然后冲洗干净洗洁精。最后在超净工作台上先用70%乙醇浸泡20~30 s,倒掉乙醇溶液再用0.1% HgCL2溶液浸泡6 min,无菌水反复冲洗5次。将消毒后的外植体修剪成带1~2个芽的茎段,接种至诱导腋芽萌发的初代培养基上。
腋芽诱导培养:采用L9(34)正交试验设计筛选适宜轮生冬青芽诱导培养基。设计基本培养基分别采用WPM、B5和MS,细胞分裂素6-BA质量浓度设为0.3、0.5、1.0 mg·L-1,IBA质量浓度设为0、0.05、0.1 mg·L-1的三因素三水平正交试验。每个处理接种20瓶。培养30 d后观察腋芽生长情况,根据外植体萌发率、新梢长度筛选适宜的诱导培养基。
继代培养:将腋芽萌发形成的新梢转接到不同增殖培养基。根据外植体在不同初代培养基的诱导分化情况,增殖培养采用B5培养基,添加不同质量浓度的6-BA(1.5和2.0 mg·L-1)和IBA(0.1和0.3 mg·L-1)。将初代培养获得的嫩枝随机地接种到不同增殖培养基,每个处理接种30瓶,分别继代培养5次。培养周期为35 d,统计每代的平均增殖系数,观察记录中间繁殖体的生长状况。
生根培养挑选增殖培养获得的高约3 cm健壮芽苗接种到以下生根诱导培养基:(1)1/2WPM+IBA0.2 mg·L-1+NAA0.3 mg·L-1;(2)1/2WPM+NAA0.5 mg·L-1;(3)1/2B5+IBA0.2 mg·L-1+NAA0.3 mg·L-1;(4)1/2B5+IBA0.5 mg·L-1。每种处理接种20瓶,定期观测根系生长情况,30 d统计生根率、不定根数量及长度等指标。
炼苗移栽:待不定根长至2 cm左右时挑选生长健壮、根系发达的组培苗,打开铝箔纸,向培养瓶中注入少量自来水,在室内自然光下炼苗3 d,用镊子取出试管苗放在水盆里,小心洗掉根部附着的培养基,栽入已消毒的腐殖土、珍珠岩及蛭石的混合基质中。保证湿度是移栽成活的关键,移栽前期每天少量多次喷施1/2B5大量元素的水溶液,30 d后统计移栽成活率。
培养条件:所有培养基的琼脂质量浓度均为6 g·L-1,蔗糖质量浓度在芽诱导和继代培养的培养基为30 g·L-1、生根培养基为15 g·L-1,pH均为5.8。培养温度25 ℃,光照强度约为2 000 lx,光照时间12 h·d-1。
数据处理:采用SPSS18.0软件对数据进行统计分析。
2 结果与分析
2.1 不同基本培养基及生长调节物质配比对腋芽诱导萌发的影响
接种10 d左右,不同处理均可见腋芽膨大,20 d开始陆续可见腋芽萌发展叶(图1A),但多数腋芽萌发抽出的嫩茎节间短。由表1可知,在基本培养基、6-BA质量浓度及IBA质量浓度3个因素中,生长素IBA质量浓度是影响轮生冬青腋芽萌发及伸长生长的主要因素,基本培养基种类次之,6-BA质量浓度影响最弱。随着IBA质量浓度升高,腋芽萌发率先升高后降低,同时发现随着IBA质量浓度升高,外植体基部形成的愈伤组织增大。3种基本培养基均可诱导腋芽萌发,但MS的诱导效果较WPM、B5培养基差。从正交试验分析结果得出,适宜轮生冬青诱导分化的培养基为B5+6-BA1.0 mg·L-1+IBA0.05 mg·L-1。
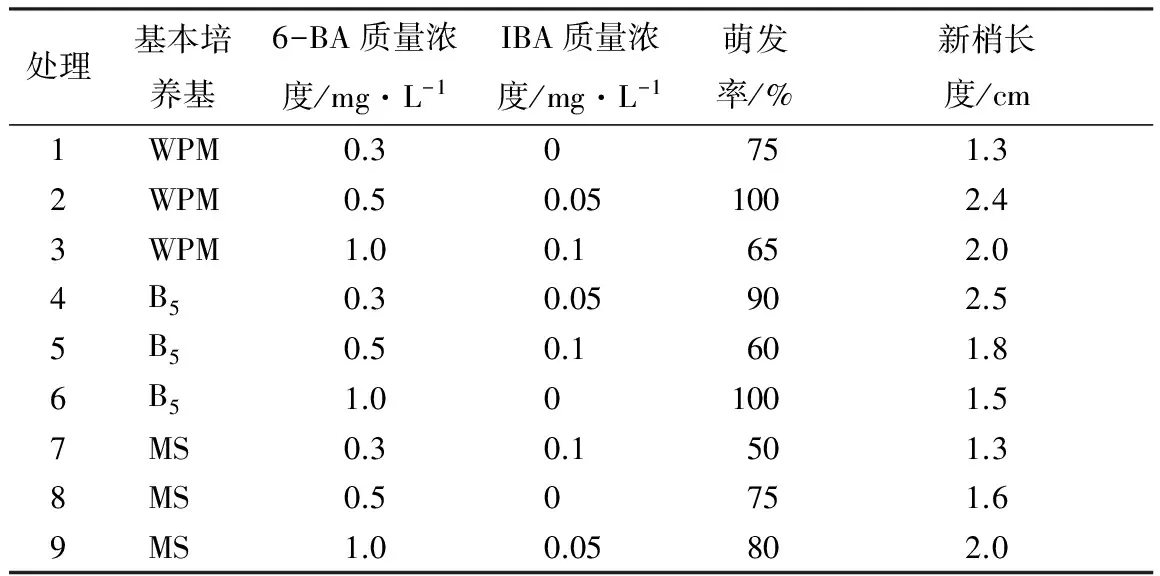
表1 培养基对轮生冬青腋芽诱导的影响
2.2 6-BA与IBA不同质量浓度配比及继代次数对轮生冬青增殖的影响
由表2可知,将初代培养中轮生冬青腋芽萌发的嫩枝接种到不同质量浓度6-BA和IBA组合的B5培养基中,在最初的2次继代培养,增殖系数较小,主要以腋芽萌发抽枝为主;到第3次继代培养,3种处理的增殖系数均明显增大,组培苗长势健壮,叶片绿色,部分茎段叶腋处形成丛生芽(图1B);到第4代,6-BA与IBA比值较低的,增殖系数大于6,腋芽生长快,叶片绿色,在6-BA1.5 mg·L-1+IBA0.3 mg·L-1培养基增殖系数最大,新梢伸长生长明显。而6-BA与IBA比值为15的培养基,增殖率开始降低,叶片窄小,芽丛生矮小,个别试管苗叶片透明、卷曲。随着继代次数增加,6-BA与IBA比值为5和6.7的2种组合,在第5次继代培养时增殖倍数有所下降,芽苗基部形成致密的愈伤组织。同时在继代培养过程中发现,继代周期30~35 d比较适宜,若时间过长,组培苗会逐渐出现黄化或茎尖枯死现象。从轮生冬青增殖培养的增殖系数及组培苗生长分化情况综合得出,适宜轮生冬青继代培养的培养基为B5+6-BA1.5 mg·L-1+IBA0.3 mg·L-1。

表2 不同质量浓度6-BA、IBA对轮生冬青增殖的影响
注:增殖系数为平均值±标准差,同列不同小写字母表示差异显著(P<0.05)。

A.茎段腋芽萌发;B.增殖培养;C.生根培养;D.组培苗移栽成活。
2.3 不同生根培养基对轮生冬青生根的影响
在生根诱导培养基中培养12 d后,陆续可见从皮部产生白色不定根,培养20 d后,先分化的不定根上又长出大量须根,根系密被根毛(图1C)。由表3可知,只使用NAA或IBA一种生长素,或两种生长素同时使用,都能不同程度诱导轮生冬青生根。但单独使用IBA,生根率低且生根时间长,根系生长慢,产生的不定根数量较少,而单独使用NAA与NAA、IBA共同使用生根效果基本无明显差异。大量元素浓度减半的WPM和B5培养基均可用作轮生冬青诱导生根的培养基,在生根后期发现1/2WPM培养基中,多数根系平展在培养基表面;而1/2B 5培养基中多数根系伸向培养基,个别根系平展在培养基表面。因此,从生根率及根系质量综合得出,轮生冬青适宜的生根培养基为1/2B 5+IBA0.2 mg·L-1+NAA0.3 mg·L-1。

表3 不同培养基对轮生冬青生根的影响
注:表中数据为平均值±标准差,同列不同小写字母表示差异显著(P<0.05)。
将根系发育良好,枝叶健壮的再生植株移栽于已消毒的V(珍珠岩)∶V(蛭石)∶V(腐殖土)=2∶1∶1混合基质中,加强养护管理,保证湿度及光照需求。移栽20 d左右,植株叶片变大,根系进一步发育,移栽成活率达90%(图1D)。
3 结论与讨论
在木本植物组织培养过程中,选择适合的基本培养基对其诱导分化及器官再生至关重要。因此,本试验中采用MS、B5和WPM3种培养基,通过正交设计初步筛选适合轮生冬青初代培养的基本培养基为WPM或B5。而以MS为基本培养基的组合中,腋芽诱导率低。这可能是由于不同基本培养基所含有的营养物质组成与含量差异造成的,由3种培养基所需大量元素的无机盐组成可以看出,氧化态氮和还原态氮的含量差异较大。MS培养基中铵态氮和硝态氮含量均很高(NH4NO31 650 mg·L-1,KNO31 900 mg·L-1),而WPM培养基(NH4NO3400 mg·L-1,Ca(NO3)2556 mg·L-1)、B5培养基(KNO32 500 mg·L-1,(NH4)2SO4134 mg·L-1)[14]硝态氮含量高,而铵态氮含量较低,可能是MS培养基较高的铵盐浓度对轮生冬青的生长分化不利,产生了一定毒害作用。另外,氧化态氮与还原态氮的相对比例对培养物的细胞分裂及分化也具有显著影响[15],可能较高的硝态氮和铵态氮的比值有利于轮生冬青的诱导分化。
在植物离体快繁中,植物生长调节物质的种类、用量及配比对培养物的诱导分化起重要作用。在培养基中加入生长调节物质可以改变和影响外植体的内源激素水平,从而导致外植体在添加不同质量浓度植物生长调节物质的培养基中诱导分化能力差异很大[10-12,16-18]。本研究在启动培养阶段,选用不同质量浓度的6-BA与IBA组合,腋芽萌发率随着6-BA质量浓度增大而提高,随着IBA质量浓度增大先提高后降低,正交试验结果表明1.0 mg·L-16-BA+0.05 mg·L-1IBA为适宜诱导轮生冬青茎段启动培养的最佳组合。在初代培养阶段,外植体腋芽萌发率较高,但新梢伸长生长慢且节间短。植物生长素具有促进细胞伸长生长的作用,在继代繁殖时通过提高IBA质量浓度,促进了新梢的伸长生长,在B5+6-BA1.5 mg·L-1+IBA0.3 mg·L-1增殖培养基,轮生冬青增殖率最高,新梢高生长明显,组培苗长势好。
继代次数是影响平均增殖倍数的重要因素之一。马大杂种相思经多次继代培养,随继代次数增加,增殖倍数呈下降趋势[16]。毛叶枣在前6代继代培养时,随继代次数增加,增殖系数递增,而后下降[17]。这与本实验研究结果一致。在轮生冬青最初的几代继代培养过程中,随继代次数增加,增殖率逐渐提高,但继代到5代时略有下降。这可能是由于培养物经多次继代培养在体内积累了高浓度的植物生长调节物质,超过了其适宜分裂的浓度范围从而抑制细胞分裂分化。同时杨增海认为组培苗在多次继代培养过程中逐渐消耗了原有母体组织中存在的与器官形成的特殊物质,致使分化能力降低或丧失[19]。因此,在生产实践中,应根据组培苗的生长状况,及时调整培养基中植物细胞分裂素及生长素用量。尤其在经过多次继代培养后,应降低细胞分裂素的浓度,待增殖能力明显下降或组培苗长势变弱无法用于继代培养时,需重新采集外植体进行新一轮离体培养。
组培苗黄化是在离体培养过程中由于培养基组成、环境条件及培养时间等因素引起的组培苗叶片部分或全部变黄[20]。在轮生冬青的离体繁殖过程中发现,继代周期超过35 d,个别组培苗会出现黄化现象,但及时转瓶,更换新鲜培养基,叶片又重新变绿,这可能与采用铝箔纸作为封口材料导致瓶内通气不良,长时间不转瓶糖已耗尽有关,具体原因有待进一步研究。
通常在离体培养诱导生根时,采用低盐的培养基或将培养基中的大量元素浓度降低,以利于根原基的形成及发育。同时对于绝大多数植物而言,添加生长素也是诱导生根必不可少的。Hidehiro等研究表明,在一定的IBA浓度范围内,内源IAA含量随着IBA浓度增加而增加;外源NAA能促进内源IAA的合成,有利于根的形成[21]。在本实验中,单独使用IBA,生根时间长,根系生长慢;而单独使用相同浓度NAA所形成的根系质量与二者同时使用差异很小,这可能和前期继代培养使用IBA有关。本试验采用0.2 mg·L-1IBA+0.3 mg·L-1NAA的组合,生根率达85%以上,根系发达,植株生长健壮。这与张俊林等对继代培养的第6代组培苗未能诱导生根不一致[11],这可能和植物来源及前期培养阶段采用的培养基组成不同,尤其是与植物生长调节物质的种类及浓度配比具有一定关系。
本研究建立了高效的轮生冬青组培快繁技术体系,筛选出B5培养基作为基本培养基,在初代培养时,适宜添加6-BA1.0 mg·L-1+IBA0.05 mg·L-1;继代增殖培养阶段,B5+6-BA1.5 mg·L-1+IBA0.3 mg·L-1培养基的增殖系数大,组培苗长势好,但经过多次继代培养后,应根据组培苗的生长分化情况和生产需求调整6-BA和IBA的用量;生根诱导阶段适宜采用1/2B5+IBA0.2 mg·L-1+NAA0.3 mg·L-1培养基,根系质量好有利于移栽成活。这将为实现轮生冬青工厂化生产奠定基础,有利于推动冬季观果树种在园林景观上的应用。
[1] 查琳,袁紫倩,董建华,等.‘奥斯特’北美冬青在我国的区域性引种试验[J].林业科技开发,2015,29(6):80-82.
[2] 余有祥,查琳,徐旻昱,等.‘奥斯特’北美冬青种子萌发及苗期观察[J].浙江林业科技,2016,36(2):86-89.
[3] 谢有福.北美冬青容器育苗试验研究[J].林业勘察设计,2015(1):141-143,146.
[4] 蔡建国,王丽英,胡本林,等.不同基质对北美冬青扦插生根的影响[J].浙江林业科技,2014,34(3):72-75.
[5] 邹义萍,金晓玲,杨玉洁,等.采穗时间和生根剂对北美冬青生根的影响[J].广东农业科学,2012(17):43-45.
[6] 陈慧玲,张新叶,陈华超,等.北美冬青硬枝扦插技术研究初探[J].农学通报,2015,5(9):100-103.
[7] 王丽英,蔡建国,臧毅,等.不同生根剂对北美冬青嫩枝扦插生根的影响[J].江苏农业科学,2014,42(9):157-159.
[8] 余有祥,查琳,徐旻昱,等.‘奥斯特’北美冬青嫩枝扦插技术[J].林业科技开发,2015,29(1):27-29.
[9] 张俊林,樊靖,姜兰芸,等.北美冬青结果枝高空压条技术研究[J].林业科技通讯,2016(6):63-66.
[10] 李永欣,王晓明,陈明皋,等.外源激素对美洲冬青组织培养的影响[J].中南林业科技大学学报,2010,30(1):65-68.
[11] 张俊林,余有祥,沈柏春,等.北美冬青‘奥斯特’的组织培养和快速繁殖[J].植物生理学报,2014,50(10):1541-1545.
[12] 邹义萍.北美冬青快繁技术研究[D].长沙:中南林业科技大学,2014.
[13] 范诸平,王立雪,杨东,等.重瓣长寿花组织培养再生体系的建立[J].东北林业大学学报,2016,44(7):54-58.
[14] 王蒂,陈劲枫.植物组织培养[M].北京:中国农业出版社,2014.
[15] 肖尊安.植物生物技术[M].北京:高等教育出版社,2010,29.
[16] 施琼.胡峰.黄烈健,等.马大杂种相思腋芽高效组培增殖体系[J].林业科学,2014,50(6):55-60.
[17] 霍朗宁,张东升,贾忠奎.树莓‘沙尼’组培技术[J].东北林业大学学报,2015,43(3):6-9.
[18] 绪九如,李春立,孙建设.毛叶枣组培快繁技术研究[J].北京林业大学学报,2003,25(3):28-32.
[19] 杨增海.园艺植物组织培养[M].北京:农业出版杜,1987.
[20] 刘杰.小桐子的组织培养及其组培苗黄化问题研究[D].昆明:西南林学院,2009.
[21] HIDEHIRO F, YOKO O, MASSO T. Regulation of lateral root formation by auxin signaling inArabidopsis[J]. Plant Biotechnology,2005,22(5):393-399.
RapidinvitroPropagationSystemofIlexverticillata
Wang Huan, Du Fengguo
(Key Laboratory of Forestry and Ecological Environment of Jilin Province, Beihua University, Jilin 132013, P. R. China); Lan He, Li Yufeng(Liaoyuan Jinxiu Valley Ecological Horticulture Company Limited) Journal of Northeast Forestry University,2017,45(12):27-31.
Ilexverticillata; Subculture times; Tissue culture; Plantlet regeneration
1)中央财政林业科技推广示范项目(吉推【2014】13号)。
王欢,女,1978年8月生,吉林省林业与生态环境重点实验室(北华大学),副教授。E-mail:magnolia2009@126.com。
杜凤国,吉林省林业与生态环境重点实验室(北华大学),副教授。E-mail:dfg4656@qq.com。
2017年9月12日
潘 华。
Q943.1
We developed a fastinvitropropagation system forIlexverticillatawith the segments of tender stems as explants. We tested various culture media for inducing axillary buds and roots and for shoot multiplication, and studied the influences of subculture times and period on multiplication were studied. The results show that B5+6-BA1.0 mg·L-1+IBA 0.05 mg·L-1was the optimal culture medium for inducing axillary buds. The optimal culture medium for shoot proliferation was B5+6-BA 1.5 mg·L-1+IBA0.3 mg·L-1, resulting in a maximum multiplication coefficient of 6.3 at the fourth subculture. Cluster buds grew well. Subculture period of 35 d was appropriate. The optimal culture medium for root induction was 1/2 B5+IBA0.2 mg·L-1+NAA 0.3 mg·L-1. The rooting rate was 100%. After being transplanted into a mixture of pearlite, vermiculite and humus (2∶1∶1,V/V/V), the survival rate of the plantlets was above 90%.
——致坚守奋斗的你

