血清CEA、CYFRA21-1及TSGF在肺癌化疗前后的表达变化及意义
陈玲玲 林 勇 叶小凯 许圣威 曹晓红 林宜亭 翁朝航 姜 燕 柯明耀
血清CEA、CYFRA21-1及TSGF在肺癌化疗前后的表达变化及意义
陈玲玲 林 勇 叶小凯 许圣威 曹晓红 林宜亭 翁朝航 姜 燕 柯明耀
目的探讨血清癌胚抗原(CEA)、细胞角蛋白19片段(CYFRA21-1)和肿瘤特异性生长因子(TSGF)在肺癌化疗前后的水平变化及疗效评估价值。方法选取80例接受紫杉醇联合吉西他滨化疗的肺癌患者,应用电化学发光免疫分析技术和生化比色法,检测化疗前及化疗21天后患者血清中CEA、CYFRA 21-1和TSGF水平变化。结果患者血清中CEA、CYFRA 21-1和TSGF的水平在紫杉醇联合吉西他滨化疗后显著降低,差异具有统计学意义(P<0.05)。且患者血清中CEA、CYFRA 21-1和TSGF水平变化与紫杉醇联合吉西他滨的化疗疗效具有明显的统计相关性。结论肺癌患者应用紫杉醇联合吉西他滨化疗可明显降低血清CEA、CYFRA 21-1和TSGF水平,说明CEA、CYFRA 21-1和TSGF在临床肺癌治疗效果的评估中具有重要的意义。
肺癌;CEA;CYFRA 21-1;TSGF
肺癌发病率近年来呈逐年上升的趋势,且因其高侵袭性、高复发性的生物学特点,已成为威胁人类健康与生命最常见的恶性肿瘤[1-2]。因此,早期诊断、有效治疗并准确判断治疗效果及时调整治疗方案已成为提高肺癌整体治疗效果至关重要的临床问题[3]。血清肿瘤标志物检测在肺癌临床诊断及疗效评估中日益受到关注,本研究主要通过对本院2013年5月至2016年12月收治的80例肺癌患者,应用紫杉醇联合吉西他滨药物治疗,电化学发光免疫分析技术进行癌胚抗原(carcinoembryonic antigen,CEA)和细胞角蛋白19片段(cytokeratin 19 fragment,CYFRA21-1)的浓度检测,生化比色法测定肿瘤特异性生长因子 (tumor supplied group of factors,TSGF)浓度,来探讨这3种肿瘤标记物在肺癌的诊断和治疗中的表达变化及临床意义。
1 材料与方法
1.1 研究对象及一般资料
选取本院2013年5月至2016年12月收治的80例肺癌患者,均经病理学确诊。其中包括男性42例,女性38例,中位发病年龄为46(24~74)岁。临床分期Ⅰ期18例,Ⅱ期37例,ⅢA期25例;腺癌27例,鳞癌32例,小细胞癌21例。患者自愿接受临床检查,并签署了知情同意书。
肺癌患者接受紫杉醇联合吉西他滨药物化疗,紫杉醇购于北京协和制药厂(国药准字:H10980068,商品规格:5 ml∶30 mg,批号:140403)。吉西他滨购于齐鲁药业有限公司产品(国药准字:H20113286商品规格:1.0 g按吉西他滨计,批号:131003)。患者采用紫杉醇150 mg/m2联合吉西他滨1 000 mg/m2静脉滴注化疗21天。
1.2 疗效诊断
化疗药物的临床疗效评定依据实体瘤疗效评价标准(RECIST)。主要分为4种:①完全缓解(complete remission,CR),肿瘤完全消失超过1个月;②部分缓解(partial remission,PR),肿瘤最大直径及最大垂直直径的乘积缩小达50%,其他病变无增大,持续超过1个月;③稳定(stable disease,SD),病变两径乘积缩小≤50%,增大≤25%,持续超过1个月;④进展(progressive disease,PD),病变两径乘积增大超过25%。其中完全缓解CR和部分缓解PR计算为有效,稳定SD和进展PD计算为无效。
1.3 CEA、CYFRA 21-1和TSGF检测方法
收集肺癌患者清晨空腹静脉血3 ml。分离血浆并低温离心2 000 rpm/min 15 min,取血清待检。采用电化学发光全自动免疫分析仪Roche Elecsys 2010检测患者血清中CEA和CYFRA 21-1浓度;采用东芝TBA40全自动生化分析仪对TSGF浓度进行生化比色法测定,均按照配套试剂盒的操作说明严格进行实验。3种肿瘤标志物正常参考值分别为:CEA<10 ng/ml,CYFRA 21-1<3.3 ng/ml,TSGF<64 U/ml。
1.4 统计学处理
数据应用SPSS 22.0软件处理,结果用均数±标准差表示。采用Student's t test和卡方分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 联合化疗前后患者血清CEA、CYFRA 21-1和TSGF浓度的变化
联合化疗前后患者血清CEA、CYFRA 21-1和TSGF浓度有明显改变,化疗前患者血清CEA浓度(21.74±9.24) ng/ml、CYFRA 21-1浓度(5.62±2.58) ng/ml和TSGF浓度(79.82±12.59) (U/ml);联合化疗后患者血清CEA浓度(14.33±8.67) ng/ml、CYFRA 21-1浓度(2.71±1.68) ng/ml和TSGF浓度(45.79±13.63) U/ml,浓度水平明显降低,差异具有统计学意义(P<0.05)(表1)。
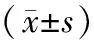
表1 联合化疗前后患者血清CEA、CYFRA 21-1和TSGF浓度的变化
注:与化疗前相比,*为P<0.05。
2.2 CEA、CYFRA 21-1和TSGF与联合化疗疗效的关系
经RECIST标准评价联合化疗后的患者疗效情况,其中完全缓解 4人(5.00%);部分缓解34例(42.50%);稳定27例(33.75%);进展15例(18.75%)。联合化疗有效为38例(60.00%),无效为42例(40.00%),说明联合化疗疗效显著,差异具有统计学意义(χ2=24.29,P=0.000)。
紫杉醇联合吉西他滨药物化疗后,患者的化疗疗效与CEA表达具有明显相关性(P=0.0010),与CYFRA 21-1表达也具有明显相关性(P=0.0015),与TSGF表达也具有明显相关性(P=0.0348),见表2。

表2 CEA、CYFRA 21-1和TSGF与疗效的关系/例
2.3 CEA、CYFRA 21-1和TSGF患者血清单独及联合检出率
联合化疗前后患者血清CEA、CYFRA 21-1和TSGF血清单独及联合检出率均有明显改变。说明CEA、CYFRA 21-1和TSGF对肺癌患者化疗前后的诊断有一定的特异性和意义;同时发现CEA+CYFRA 21-1+TSGF联合检出率明显高于三项指标的单独检出率。
化疗前后血清CEA单独检出率与联合检出率相比,无明显差异(P>0.05);血清CYFRA 21-1单独检出率与联合检出率相比,具有明显差异(P<0.05);血清TSGF单独检出率与联合检出率相比,具有明显差异(P<0.05),说明三者联合检测的敏感性更高(表3)。

表3 CEA、CYFRA 21-1和TSGF单独及联合检出率比较(例,%)
3 讨论
近年来,肺癌的发病率和死亡率逐年上升,且肺癌是全球最常见恶性肿瘤之一,严重威胁着人类健康与生命[4-5]。因此,肺癌的早发现、早诊断和早治疗尤为重要。血清肿瘤标志物的联合检测在检测肺癌的病变及发生发展过程中起到关键作用,已成为临床重要参考指标[6-7]。广谱的肿瘤标志物CEA,作为1种肿瘤细胞表面的结构抗原,其常用于临床辅助诊断肺癌、肝癌、乳腺癌及胃癌等恶性肿瘤,在众多肿瘤患者血的清中均呈现高表达状态[8-9]。存在肺肿瘤上皮细胞质中CYFRA 21-1是1种酸性多肽,能被蛋白酶降解以溶解片段的形式释放到血液中,CYFRA21-1在肺癌患者血清中含量明显升高,可早于临床症状和影像学检查,是肺癌的早期诊断、疗效监测和预后判断的重要标志物[10-12]。TSGF是早期肿瘤发生的血管内皮生长因子,TSGF的迅速升高与肿瘤的形成、浸润和转移等过程密切相关,对肿瘤的早期发现和监测具有重要意义[13]。
紫杉类药物紫杉醇是一类天然产物源的、靶向肿瘤细胞微管骨架系统,而起到调控肿瘤细胞有丝分裂及诱导凋亡的作用,因其确切的临床肿瘤治疗效果已成为临床一线抗肿瘤药物,对肿瘤的发生和发展具有重要的调控作用[14-15]。吉西他滨是1种新型的脱氧胞苷类药物,在细胞内主要可以转化为二磷酸双氟脱氧胞嘧啶核苷,影响并抑制细胞内核酸DNA的合成,进一步引发细胞凋亡[16]。紫杉醇与吉西他滨对中晚期肺癌或复发肺癌均有一定抗药耐药性,二者之间并无交叉耐药,因此可以选择作为治疗肺癌的基本治疗药物。
已有文献报道,血清中CEA、CYFRA 21-1和TSGF的水平降低可以作为肺癌患者疗效评价及预后指标(此处列出参考文献)。而我们的研究结果表明,肺癌患者应用紫杉醇联合吉西他滨化疗前后,血清中CEA、CYFRA 21-1和TSGF含量明显降低。因此,可以说明紫杉醇联合吉西他滨化疗可以显著改善肺癌患者的疾病情况,临床效果良好。并且,进一步分析肺癌患者经紫杉醇联合吉西他滨化疗前后CEA、CYFRA 21-1和TSGF血清的检出率和化疗疗效具有较强相关性。综合上述结果及文献报道,说明CEA、CYFRA 21-1和TSGF可以作为患者使用紫杉醇联合吉西他滨化疗疗效的重要检测指标。
综上所述,紫杉醇联合吉西他滨的化疗方案对临床肺癌治疗具有重要作用。同时,患者血清CEA、CYFRA 21-1和TSGF含量检测可以对肺癌的病情诊断和化疗疗效的判断起到重要的提示作用,为肺癌的诊断与治疗提供了良好的理论依据。
[1] 刘 力,刘国文,谭米多.肺癌的综合治疗现状〔J〕.中国肿瘤外科杂志,2013,5(1):60-63.
[2] Boolell V,Alamgeer M,Watkins DN,et al.The Evolution of Therapies in Non-Small Cell Lung Cancer〔J〕.Cancers,2015,7(3):1815-1846.
[3] 徐定华,蔡春仙,黄光学.乳腺钼靶 X 射线摄片联合四种血清肿瘤标志物对肺癌的诊断价值〔J〕.海南医学院学报,2015,21(9):1294-1296.
[4] 邵志敏,李 俊,吴 炅,等.术前化疗诱导肺癌细胞凋亡的临床意义〔J〕.中华肿瘤杂志,2000,22(4):295-297.
[5] 刘潇衍,李峻岭.晚期非小细胞肺癌的治疗选择〔J〕.中国肿瘤临床,2015,42(19):935-941.
[6] 阎 飞,张定昌.血清肿瘤标记物联合检测诊断肺癌的临床价值〔J〕.山东医药,2011,51(19):67-68.
[7] 王 莹,郭 华,余 阗.4种血清肿瘤标志物检测对诊断肺癌的对比研究〔J〕.检验医学与临床,2013,10(20):2732-2734.
[8] 李 林,廖嘉煦.钼靶X射线摄片与血清 CEA、CA19-9、CA15-3 联合检查对肺癌的临床诊断价值〔J〕.标记免疫分析与临床,2009,16(6):365-367.
[9] 许立生,王 水,黄中晶,等.ER、PR、VEGF、CA15-3、CA125 和 CEA 水平在肺癌预后判断中的临床意义〔J〕.实用医学杂志,2012,28(21):3565-3567.
[10] 孙丽娟,秦 超,岳慧萍.CYFRA21-1、CA19-9、VEGF联合检测对非小细胞肺癌临床诊断价值的探讨〔J〕.当代医学,2011,17(12):41-43.
[11] 佟威威,佟广辉,王 婧,等.CYFRA21-1、NSE、SCCA和CRP在肺癌诊断中的应用〔J〕.中国免疫学杂志,2015,31(3):396-400.
[12] Wang P,Piao Y,Hang X,et al.The concentration of CYFRA21-1-,NSE and CEA in cerebro-spinal fluid can be useful indicators for diagnosis of meningeal carcinomatosis of lung cancer〔J〕.Cancer Biomark,2013,13(2):123-130.
[13] Wang G,Qin Y,Zhang J,et al.Nipple discharge of CA15-3,CA125,CEA and TSGF as a new biomarker panel for breast cancer〔J〕.Int J Mol Sci,2014,15(6):9546-9565.
[14] 任维维,米登海,李 征,等.非小细胞肺癌紫杉醇类联合顺铂同步或序贯放化疗对比的Meta分析〔J〕.中华肿瘤防治杂志,2013,20(5):337-382.
[15] 许先荣,赵桂芝,朱婉萍,等.紫杉醇脂质体联合中药姜黄素对小鼠转移性肺癌的影响〔J〕.中国中医药科技,2016,23(5):551-553.
[16] 陈玉丽,朱勤伟,隋晓梅.BRD4沉默联合吉西他滨为治疗三阴性肺癌提供新的治疗方案〔J〕.实用医学杂志,2016,26(9):750-755.
ExpressionandSignificanceofSerumCEA,CYFRA21-1andTSGFinLungCancerbeforeandafterChemotherapy
CHENLingling,LINYong,YEXiaokai,etal.
XiamenHaicangHospital,Xiamen,361026
ObjectiveTo investigate the change of expression of carcinoembryonic antigen (CEA),cytokeratin 19 fragment (CYFRA21-1) and tumor supplied group of factors (TSGF) in lung cancer before and after chemotherapy,and their efficacy evaluation value.Methods80 patients with lung cancer were treated with paclitaxel combined with gemcitabine.The concentration and efficacy of CEA,CYFRA 21-1 and TSGF in serum of patients in 21 days was measured by electrochemiluminescence immunoassay and biochemical colorimetric method.And further value were combined with the efficacy of chemotherapy for statistical analysis.ResultsThe levels of serum CEA,CYFRA 21-1 and TSGF significantly decreased after paclitaxel combined with gemcitabine chemotherapy,the difference was statistically significant (P<0.05).And the serum CEA,CYFRA 21-1 and TSGF concentrations were significantly correlated with the efficacy of paclitaxel combined with gemcitabine in chemotherapy.ConclusionPaclitaxel combined with gemcitabine chemotherapy could significantly reduce the levels of serum CEA,CYFRA 21-1 and TSGF in patients with lung cancer,which indicates that CEA,CYFRA 21-1 and TSGF in the evaluation of clinical treatment of lung cancer is of great significance.
Lung cancer;Carcinoembryonic antigen(CEA);Cytokeratin 19 fragment(CYFRA21-1);Tumor supplied group of factors(TSGF)
(ThePracticalJournalofCancer,2017,32:1928~1930)
361000 厦门市海沧医院(陈玲玲,林 勇,叶小凯,许圣威,曹晓红,林宜亭,翁朝航,姜 燕);361000 厦门市呼吸病医院(柯明耀)
姜 燕
10.3969/j.issn.1001-5930.2017.12.004
R734.2
A
1001-5930(2017)12-1928-03
2017-06-09
2017-07-10)
(编辑:吴小红)

