一株高产γ-氨基丁酸乳酸菌的筛选及应用
韩昱姝,李永转,胡凤山*,梁丽娟
(山西三盟实业发展有限公司,山西 太原 030032)
一株高产γ-氨基丁酸乳酸菌的筛选及应用
韩昱姝,李永转,胡凤山*,梁丽娟
(山西三盟实业发展有限公司,山西 太原 030032)
γ-氨基丁酸是存在于人体中枢神经系统中一种重要的抑制性神经递质,具有镇静神经、抗焦虑等功效。以泡菜为原料,利用指示剂变色法和γ-氨基丁酸含量检测筛选出7株产γ-氨基丁酸产酸菌,并从中筛选出一株稳定性较高菌株,经生理生化鉴定和16SrDNA序列分析为短乳杆菌(Lactobacillus brevis),编号LF-fb-017。以牛奶为发酵底物,在温度37℃,L-谷氨酸钠浓度为0.5 g/100 mL条件下发酵3 d,终γ-氨基丁酸产量可达1.68 mg/mL。
γ-氨基丁酸;短乳杆菌;分离鉴定;牛奶
随着生活节奏加快,工作压力加大,疲劳已成为当今人们关注的热点问题之一。γ-氨基丁酸(γ-aminobutyric acid,GABA)广泛存在于动植物体内(植物如豆属、藻类、蕨类、藓类等的种子、组织液和根茎中;动物则几乎只存在于神经组织中,浓度最高的区Ⅱ为大脑中黑质,脑组织中含量大约为0.1~0.6 mg/g组织)[1-3]。γ-氨基丁酸具有许多重要的生理功能(如降压、镇静、增强记忆、抗焦虑等),尤其对更年期的失眠、压抑和自身失调疗效良好。我国卫生部于2009年9月正式批准γ-氨基丁酸为新资源食品。随着γ-氨基丁酸生理功能的不断研究和阐明,目前已经发展成为一种新型的功能因子,正逐渐应用于医药、食品等行业[4-7]。
乳酸菌是一种存在于人类体内的益生菌,有帮助消化、有助于人体肠道的健康等功能,是人体必不可少的且具有重要生理功能的有益菌[8]。短乳杆菌是乳酸菌中一种,目前已有多篇报道短乳杆菌能够高产γ-氨基丁酸[9-13]。因此,利用乳酸菌生产的GABA能达到食品安全级,并可进一步丰富乳酸菌作为益生菌的保健功效,应用前景广阔[14]。
牛奶是最天然的饮料之一,营养丰富,含有丰富的矿物质和必需氨基酸,牛奶中所含的钙质与L-色氨酸能产生诱发睡眠的荷尔蒙5-羟色胺与褪黑激素,有效助眠,与γ-氨基丁酸的功效相得益彰[15]。本试验选用牛奶、谷物等绿色健康食品作为乳酸菌的发酵底物,开发一种纯天然发酵的γ-氨基丁酸饮品,以期为γ-氨基丁酸在食品中的应用提供参考。
1 材料与方法
1.1 材料与试剂
韩国泡菜、酸白菜:市售;盐白菜:实验室自制。
MRS培养基:酪蛋白胨10.0 g,牛肉膏10.0 g,酵母粉5.0 g,葡萄糖5.0 g,乙酸钠5.0 g,吐温-80 1.0 g,柠檬酸二铵2.0 g,磷酸氢二钾2.0 g,硫酸镁0.2 g,硫酸锰0.05 g,蒸馏水补至1.0 L,pH6.8。
菌种筛选培养基:在MRS固体培养基中添加0.1%溴甲酚绿。
发酵培养基:①MRS液体培养基(对照);②牛奶培养基;③脱脂奶粉培养基;④酸奶培养基;⑤马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基⑥;高粱培养基:3%粉碎高粱;⑦大米培养基:3%大米粉;⑧3%粉碎高粱+3%豌豆;⑨3%粉碎高粱+3%黄豆。
L-谷氨酸钠(食品级),γ-氨基丁酸标准品、甲醇、乙腈(色谱纯):国药集团化学试剂有限公司;氨基酸衍生试剂(邻苯二甲醛(o-phthalaldehyde,OPA)、9-芴甲基氯甲酸酯(9-fluorenylmethylchloroformate,FMOC)):安捷伦科技(中国)有限公司。
1.2 仪器与设备
BSA224S型分析天平:赛多利斯科学仪器(北京)有限公司;PHS-3C型数显酸度计:上海仪电科学股份有限公司;DH-500A型电热恒温培养箱:北京中兴伟业仪器有限公司;UV5100型分光光度计:上海元析仪器有限公司;1260型高效液相色谱仪:安捷伦科技有限公司。
1.3 方法
1.3.1 高产γ-氨基丁酸菌种筛选
检测3种泡菜汁中γ-氨基丁酸含量,选择含量较高的泡菜汁,从中筛选高γ-氨基丁酸乳酸菌菌株。取泡菜汁2 mL,于无菌的MRS液体培养基中,恒温培养箱37℃静置培养48 h,富集菌种。将富集后菌种发酵液用无菌生理盐水稀释至10-12,吸取1 mL至无菌平皿中,倾注法倒平板,37℃倒置培养48 h。
1.3.2 高产γ-氨基丁酸菌种的分离纯化
从平板上的杂菌中挑选使溴甲酚绿变黄的菌株,在MRS固体平板上划线培养,直至培养出菌落形态单一的纯菌种为止。
1.3.3 高产γ-氨基丁酸菌种鉴定
将菌株37℃培养48 h后收集菌体,送北京中国食品发酵工业研究院微生物检测中心进行菌种鉴定,包括生理生化鉴定,DNA序列分析,并应用MEGA5.0软件与相关种的16S rDNA序列进行多次重复比对计算。
1.3.4 高产γ-氨基丁酸菌种培养基选择
以2%的接种量接入1.1部分的培养基筛选出的高产γ-氨基丁酸菌种,37℃静置培养48 h后,检测发酵液中γ-氨基丁酸含量。
1.3.5 发酵条件优化单因素试验
以γ-氨基丁酸产量为衡量指标,设置发酵时间(1 d、2 d、3 d、4 d、5 d)、γ-氨基丁酸底物质量浓度(L-谷氨酸钠)(0.1 g/100 mL、0.2 g/100 mL、0.5 g/100 mL、0.7 g/100 mL、1.0 g/100 mL)的单因素试验,考察发酵时间、γ-氨基丁酸底物质量浓度对饮品中γ-氨基丁酸产量的影响。
1.3.6 测定方法
将发酵液样品充分混匀后,取适量于离心杯中,5000r/min离心10min,取上清液。将上清液经过0.22 μm微孔滤膜过滤。色谱条件为:色谱柱为ZorbaxEclipse-AAA氨基酸分析柱;流动相A为40mmol/L NaH2PO4,调节pH为7.8;流动相B为甲醇、乙腈和水,混合比例为45∶45∶10;流速为2 mL/min;进样量为0.5 μL;柱温为40℃;检测波长为338 nm。
2 结果与分析
2.1 菌种初筛
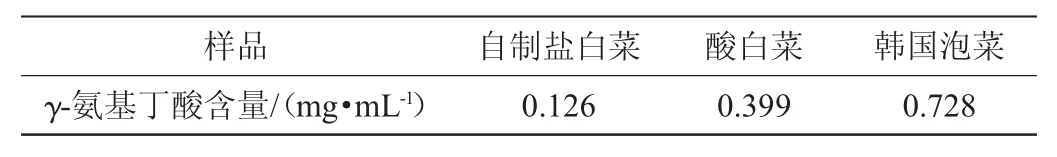
表1 泡菜样品中γ-氨基丁酸含量Table 1 γ-aminobutyric acid contents in pickle samples
由表1可知,韩国泡菜中γ-氨基丁酸含量最高,为0.728 mg/mL。因此从韩国泡菜中筛选高产γ-氨基丁酸菌株。
利用含有溴甲酚绿指示剂的MRS固体培养基共筛得变色圈较大的产酸菌株31株,在MRS液态培养基中分别对其进行单菌种培养,检测发酵液中γ-氨基丁酸含量,结果见表2。

表2 产γ-氨基丁酸菌株初筛结果Table 2 Preliminary screening results of strains producing γ-aminobutyric acid
由表2可知,可得到7株产γ-氨基丁酸菌株,其中仅1株为革兰氏阴性菌,剩余6株均为革兰氏阳性,且菌落形态与镜检形态都较为相似,仅γ-氨基丁酸含量有差异。
2.2 菌种鉴定
对上述筛得的6株革兰氏阳性菌株经3~5次继代培养后,选择其中一株稳定性较好且γ-氨基丁酸含量较高的菌株H-3,分离纯化后,收集菌体,进行菌落形态鉴定及镜检测定,结果如图1所示。生理生化分析结果和16S rDNA基因序列分析结果如表3所示。与相关种的16S rDNA构建系统发育树如图2所示。

图 1菌株LF-fb-017菌落(A)及细胞(B)形态Fig.1 Colony (A)and cell(B)morphology of strain LF-fb-017
由图1可知,该菌株菌落呈乳白色,圆形,表面光滑,湿润,凸起,半透明,边缘整齐;菌体呈杆状,大小为(0.4~0.5)μm×(0.8~2.1)μm,单个或成对排列,革兰氏阳性。

表3 菌种LF-fb-017生理生化特征Table 3 Physiological and biochemical characteristics of strain LF-fb-017

图2 基于16S rDNA基因序列构建的系统发育树Fig.2 Phylogenetic tree based on 16S rDNA gene sequences
由表3、图2可知,该菌种与安全等级为1级的模式短乳杆菌ATCC 14869相似度100%,将该菌种鉴定为短乳杆菌(Lactobacillus brevis),编号LF-fb-017。
2.3 发酵培养基的筛选
将LF-fb-017菌种种子液按照2%的添加量分别加入液体发酵培养基①~⑨中,于37℃恒温培养箱中静置培养3 d后,检测发酵液中γ-氨基丁酸含量,结果见表4。

表4 不同发酵培养基对γ-氨基丁酸含量的影响Table 4 Effects of different fermentation media on γ-aminobutyric acid content
由表4可知,该乳酸菌在MRS培养基、牛奶培养基和脱脂奶粉培养基中发酵培养可产生较高γ-氨基丁酸(分别为2.119 mg/mL、0.765 mg/mL、0.903 mg/mL),在牛奶与脱脂奶粉培养基中γ-氨基丁酸含量低于MRS培养基,猜测可能是由于该培养基中缺乏碳源导致,因此向上述两种培养基中补加碳源。谷物培养基中几乎不产生γ-氨基丁酸,可能是由于复配谷物中仍缺乏乳酸菌产γ-氨基丁酸所必需营养因子,还有待继续研究[16]。
牛奶培养基中葡萄糖添加量对γ-氨基丁酸含量的影响如图3所示,脱脂奶粉培养基中葡糖糖添加量对γ-氨基丁酸含量的影响如图4所示。

图3 牛奶培养基中葡萄糖添加量对γ-氨基丁酸含量的影响Fig.3 Effect of glucose addition in milk medium on γ-aminobutyric acid content
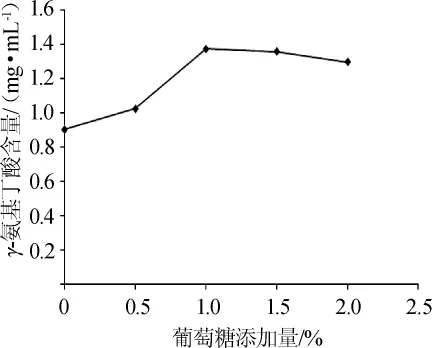
图4 脱脂奶粉培养基中葡糖糖添加量对γ-氨基丁酸含量的影响Fig.4 Effect of glucose addition in the skimmed milk powder medium on γ-aminobutyric acid content
由图3、图4可知,葡萄糖添加量为1%时,两种发酵液中γ-氨基丁酸含量基本达到最大值,之后随着葡萄糖添加量增加,γ-氨基丁酸含量趋于平缓或增加缓慢,因此可确定上述两种培养基中最适葡萄糖添加量为1%。对比图3、图4可发现,添加葡萄糖后牛奶培养基中γ-氨基丁酸含量增幅较大,最大值达到1.682 mg/mL,高于脱脂奶粉培养基中的最大值(1.372 mg/mL),因此选择含有1%葡萄糖的牛奶培养基为最适培养基。
2.4 发酵条件优化
该菌种的发酵过程共4个影响因素:发酵温度、发酵时间、γ-氨基丁酸底物质量浓度、发酵液pH值。其中发酵温度由菌株LF-fb-017的最适温度决定,为37℃;为确保牛奶的营养价值以及成分不被破坏,pH为牛奶固有pH值,不做改变。
2.4.1 不同发酵时间对γ-氨基丁酸含量的影响

图5 不同发酵时间对γ-氨基丁酸含量的影响Fig.5 Effects of different fermentation times on γ-aminobutyric acid content
由图5可知,不同发酵时间对γ-氨基丁酸含量的影响较大,前2dγ-氨基丁酸含量激增,在第2天即可达到1.2mg/mL以上,但第3天增长缓慢,达到最大值1.653mg/mL,第4天开始下降,这可能是由于γ-氨基丁酸在第4天时消耗量大于产生量,导致含量下降。因此,选择3d为最佳发酵时间。
2.4.2 不同L-谷氨酸钠含量对γ-氨基丁酸含量的影响

图6 不同L-谷氨酸钠含量对γ-氨基丁酸含量的影响Fig.6 Effects of different L-glutamate concentrations on γ-aminobutyric acid content
由图6可知,不同L-谷氨酸钠含量对γ-氨基丁酸含量有一定的影响,当L-谷氨酸钠含量较低时,γ-氨基丁酸含量随L-谷氨酸钠含量的增加而增加;当L-谷氨酸钠含量达到一定值(0.5 g/100 mL)时,γ-氨基丁酸含量变化较小,这可能是由于发酵液中其他因素限制了短乳杆菌对L-谷氨酸钠的转化。因此,选择0.5 g/100 mL为最适底物质量浓度。
3 结论
本研究以泡菜为原料,筛选出7株产γ-氨基丁酸菌株,并从中筛选出一株稳定性较高菌株,经鉴定为短乳杆菌(Lactobacillus brevis),编号LF-fb-017。 该菌株在MRS液体培养基中可产生γ-氨基丁酸2.119 mg/mL,以牛奶为发酵底物,在温度37℃,γ-氨基丁酸底物浓度为0.5 g/100 mL的条件下发酵3 d,γ-氨基丁酸终产量可达1.682 mg/mL。
[1]刘佳荣.微生物发酵合成γ-氨基丁酸(GABA)的研究[D].哈尔滨:哈尔滨商业大学,2015.
[2]YANG R Q,HUI Q R,GU Z X.Effects of ABA and CaCl2on GABA accumulation in fava bean germinating under hypoxia-NaCl stress[J].Biosci Biotech Biochem,2016,3:540-546.
[3]胡 珊,王小波,戴 甄,等.产γ-氨基丁酸红曲菌种的筛选及其发酵工艺条件研究[J].食品与发酵科技,2011,47(4):64-67.
[4]赵玉娟,牛春华,张 健,等.一株高产γ-氨基丁酸短乳杆菌的筛选、鉴定及发酵优化[J].吉林农业科学,2015,40(1):95-99,103.
[5]高爱同.高产γ-氨基丁酸乳酸菌发酵条件优化及分离纯化工艺研究[D].杭州:浙江师范大学,2013.
[6]黄桂东,毛 健,姬中伟,等.一株产氨基丁酸植物乳杆菌MJ0301培养基的优化[J].食品科学,2013,34(17):165-166.
[7]蒋冬花,高爱同,毕 珂,等.乳酸菌发酵小米糠生产γ-氨基丁酸的配方和条件优化[J].浙江师范大学学报,2013,36(1):6-10.
[8]范 杰,孙君社,张晓杰,等.高产γ-氨基丁酸乳酸菌的筛选及鉴定[J].中国酿造,2011,30(4):39-41.
[9]宋明明.产GABA的乳酸菌菌株的选育及最佳发酵条件研究[D].哈尔滨:黑龙江大学,2008.
[10]贤乾隆.产γ-氨基丁酸乳酸菌的筛选及其功能性发酵酸奶的研制[D].柳州:广西科技大学,2013.
[11]黄柳舒,沈莲清,王向阳.改良比色法测桑叶中γ-氨基丁酸含量及其热稳定性研究[J].食品科技,2010,35(8):328-335.
[12]王向阳,仝义超,施青红,等.γ-氨基丁酸的检测方法和热杀菌稳定性研究[J].食品研究与开发,2009,30(4):13-16.
[13]周 鹏.含牛乳米乳饮料的工艺及稳定性研究[D].无锡:江南大学,2008.
[14]彭春龙,黄 俊,赵伟睿,等.酸胁迫下短乳杆菌谷氨酸脱羧酶系统关键基因的表达及酶活性响应[J].高校化学工程学报,2015,29(2):359-365.
[15]TUNG Y T,LEE B H,LIU C F,et al.Optimization of culture condition for ACEI and GABA production by lactic acid bacteria[J].J Food Sci,2011,9:585-591.
[16]KIM M J,KIM K S.Isolation and Identification of γ-aminobutyric acid(GABA)-producing lactic acid bacteria from Kimchi[J].J Korean Soc Appl Biol Chem,2012(55):777-785.
Screening and application of lactic acid bacteria with a high yield γ-aminobutyric acid
HAN Yushu,LI Yongzhuan,HU Fengshan*,LIANG Lijuan
(Shanxi Three-League Industrial Development Co.,Ltd.,Taiyuan 030032,China)
γ-aminobutyric acid is an important inhibitory neurotransmitter in the central nervous system of human,with the effects of nerves sedative,anxiolytic and so on.In this study,7 γ-aminobutyric acid-producing strains were screened from pickle by using indicator color change method and detection of γ-aminobutyric acid content.A strain with high stability was screened out and identified by physiological biochemical tests and 16S rDNA sequencing asLactobacillus brevisLF-fb-017.Using milk as fermentation substrate,the γ-aminobutyric production was 1.68 mg/ml at the conditions of temperature 37℃,L-glutamate 0.5 g/100 ml and fermentation time 3 d.
γ-aminobutyric acid;Lactobacillus brevis;isolation and identification;milk
TS201.3
0254-5071(2017)12-0072-04
10.11882/j.issn.0254-5071.2017.12.015
2017-10-09
山西三盟实业发展有限公司专项基金(2016)
韩昱姝(1989-),女,助理工程师,硕士,研究方向为食品微生物发酵工程。
*通讯作者:胡凤山(1965-),男,高级工程师,硕士,研究方向为食品微生物发酵工程。

