双氢青蒿素含药血清抗血管生成活性的研究❋
王 武,盛庆寿
(1.海南省中医院肝病科,海口 570203; 2.广西医科大学研究生院,南宁 530021;3.广西中医药大学附属瑞康医院肝病科,南宁 530011)
【方药研究】
双氢青蒿素含药血清抗血管生成活性的研究❋
王 武1,盛庆寿2△
(1.海南省中医院肝病科,海口 570203; 2.广西医科大学研究生院,南宁 530021;3.广西中医药大学附属瑞康医院肝病科,南宁 530011)
目的:研究不同剂量组双氢青蒿素对人脐静脉内皮细胞的增殖、迁移抑制作用和作用机制。方法:制备空白对照组、双氢青蒿素15 mg/kg组、30 mg/kg组和60 mg/kg组4个剂量组含药血清,以贝伐单抗为对照药作用于人脐静脉内皮细胞,噻唑蓝法检测细胞增殖,划痕实验检测细胞迁移能力,RT-qPCR法检测细胞VEGF表达,放射配体受体结合分析法检测细胞VEGFR最大结合容量和解离常数。结果:相对于空白对照组,双氢青蒿素30 mg/kg组和60 mg/kg组可明显抑制人脐静脉内皮细胞增殖且能降低细胞的迁移能力;RT-qPCR结果显示,这2个剂量组的VEGF表达出现明显降低;VEGFR最大结合容量出现明显降低,解离常数明显升高,结果均具有显著性意义。结论:30 mg/kg剂量以上的双氢青蒿素含药血清可显著抑制人脐静脉内皮细胞增殖和迁移,作用机制可能与抑制血管内皮生长因子表达并阻断其与受体的结合相关。
双氢青蒿素;人脐静脉内皮细胞;增殖;迁移;血管内皮生长因子
青蒿素是我国科研人员首次从黄花蒿中提取的有效抗疟成分,为一种生物碱蓓半萜内酯化合物,当前合成了多种青蒿素衍生物包括双氢青蒿素、青蒿琥酯、蒿甲醚等。临床上广泛用于各类疟疾的治疗,具有低毒、高效、廉价的优点。近年研究发现,除外其抗疟活性,青蒿素类药物在抗肿瘤方面发现具有巨大价值[1-2]。笔者在前期研究中也发现,双氢青蒿素可抑制原发性肝癌大鼠的肿瘤生长,改善肝功能,延长大鼠生存时间[3]。体外实验则发现,双氢青蒿素可抑制肝癌细胞增殖活性,对细胞血管内皮生长因子(vascular endothelial growth factor,VEGF)表达也表现出明显抑制作用[4],提示双氢青蒿素的抗肝癌机制可能与其抑制肿瘤血管生成作用有关。为进一步验证双氢青蒿素的抗血管生成作用,本研究设计了双氢青蒿素含药血清对人脐静脉内皮细胞(HUVEC)的活性抑制实验,并进一步检测细胞的VEGF表达和VEGF/VEGFR结合力变化,为双氢青蒿素的抗肝癌机制提供更多的理论依据。
1 材料与方法
1.1 实验药物
图1显示,双氢青蒿素由广西中医药大学基础医学院农慧博士馈赠,粉剂,质量分数99.5%,批号070711,鉴定人林海,双氢青蒿素在溶液中以α和β 2种异构体存在,形成α峰和β峰)。使用时以5%羧甲基纤维素钠按所需浓度混匀,4 ℃保存;贝伐珠单抗注射液100 mg/4ml/支,美国罗氏公司(商品名:安维汀,批号N3539)。
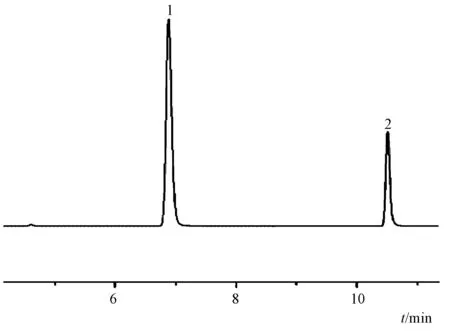
图1 双氢青蒿素样品液相图谱注:1. α峰;2. β峰
1.2 细胞与动物
人脐静脉内皮细胞(自中国科学院细胞库购买)、SPF级雄性SD大鼠20只,6周龄,体质量均≥200 g,购于广西医科大学实验动物中心(许可证号SCXK桂2003-0003)。大鼠饲养于广西中医药大学实验动物中心(SPF级),饲养环境12 h采光,12 h黑暗,恒温24 ℃,相对湿度50%~60%。实验过程严格遵守动物实验室有关条例。
1.3 试剂
引物合成(VEGF上游引物:5’-CATGTACGAACCGCCAG-3’,下游引物: 5’-TTGGCTGTTTGGTCATTGGC-3’,由上海拜力生物公司合成);逆转录试剂盒(美国invitrogen 公司,批号31245);SYBR Green试剂盒(美国罗氏公司,批号Z587690);重组人VEGF165(美国PeproTech公司,批号GZ654565);125IVEGF试剂盒(美国perkinelmer公司,批号1000551);内皮细胞培养基(美国Scien Cell公司,批号3145905)。
1.4 仪器
酶标仪(美国伯乐公司 680型),荧光定量PCR仪(ABI7500型),液体闪烁测量仪(西安262厂,FJ-2105p)。
1.5 方法
1.5.1 双氢青蒿素含药血清制备 将20只SD大鼠随机分为空白对照组和双氢青蒿素15 mg/kg、30 mg/kg、60 mg/kg剂量组4组各5只,双氢青蒿素各剂量组的大鼠分别按照相应药物浓度灌胃。空白对照组给予等体积生理盐水,连续7 d,于末次灌胃2 h后腹主动脉取血,离心分离血清,灭活、过滤除菌后置于-80 ℃冰箱备用。
1.5.2 人脐静脉内皮细胞体外培养和药物干预 HUVEC在含10%小牛血清的RPMI-1640培养液中培养,分空白对照组、阳性对照组、双氢青蒿素15 mg/kg、30 mg/kg和60 mg/kg剂量组。贴壁后换成5%血清培养4 h,双氢青蒿素各组换用10%双氢青蒿素含药血清,空白对照组和阳性对照组换用10%小牛血清,阳性对照组另加入10 mg/L浓度贝伐单抗溶液继续培养。
1.5.3 MTT(噻唑蓝)法检测细胞增殖 细胞接种于96孔板中,接种浓度2×104个/ml,每孔加入100 μL,设5个复孔,余步骤同上。分别培养24、48、72 h后,每孔加入5 μL MTT,摇匀后再孵育4 h;吸去上清液,每孔加入二甲基亚砜 200 μL,振荡器震荡10 min;酶标仪设置490 nm波长,检测吸光度(A值),以计算细胞抑制率。抑制率=[(对照组A490-空白A490)-(药物处理组A490-空白组A490)]/(对照组A490-空白A490)。
1.5.4 划痕实验检测细胞迁移能力 6孔板先以记号笔在底部做“井”字形标记。细胞接种于6孔板中,接种浓度1.2×106个/ml,每孔加入2 ml。细胞密度达到80%时,以200 μL枪头在标记处做直线划痕;分别更换含贝伐单抗和各剂量双氢青蒿素的培养液后,继续培养至24 h;分别于0 h和24 h在倒置显微镜下观察划痕宽度变化并拍照记录。
1.5.5 RT-qPCR法检测细胞的血管内皮生长因子mRNA表达 细胞接种于6孔板中,接种浓度1.2×106个/ml,每孔加入2 ml,设5个复孔,余步骤同上。培养48 h后PBS洗涤2次,以TRIZOL法提取总RNA,PCR扩增采用SYBR Green法。反应条件:预变性95 ℃ 3min(1循环),变性95 ℃ 10 s,退火60 ℃ 20 s(40循环)。扩增结束获取溶解曲线和扩增曲线进行定量分析,得到ΔΔCT值(comparative ct method od quantitation),应用2-ΔΔCT法进行数据统计分析。
1.5.6 放射配体受体结合分析法检测细胞的血管内皮生长因子受体最大结合容量和解离常数 参考文献[5],取药物干预后的各组细胞,以结合缓冲液将细胞密度调整至6×105个/ml,分别添加150 μm细胞悬液至1~24号检测管后PBS浸泡过夜。采用复管法,1~16号管分别按50、80、100、150、200、350、500、700 pmol/L加入VEGF165;17~24号管分别按50、100、350、700 pmol/L加入VEGF165后,再加入100倍量的非标记VEGF,记为非特异结合管。各管中加入结合缓冲液至总体积300 μm,置于4 ℃冰箱,孵育3 h。加入1 ml pbs终止反应,离心弃上清,再以PBS洗3次,置入γ计数器中检测放射性。以总结合减去对应浓度点非特异性结合得出特异性结合的cpm值,再经BRA数据分析软件处理后获得受体最大结合容量(Bmax)和解离常数(Kd)。Bmax为配体与受体最大结合容量,目的基因表达增强时可检测到更高Bmax值;Kd值提示受体配体亲和力,Kd值越小表示最大效应所需配体浓度越低则亲和力越大,最后绘制饱和曲线并进行scatchard绘图。

2 结果
2.1 双氢青蒿素对人脐静脉内皮细胞抑制率的影响
表1显示,经药物干预后同空白对照组比较,双氢青蒿素15 mg/kg组和30 mg/kg组的样本细胞增殖明显受到抑制(P<0.01,P<0.01),且随药物干预时间的延长其抑制率也逐步提高,双氢青蒿素15 mg/kg组的抑制作用则不明显(P>0.05)。
表1 双氢青蒿素对人脐静脉内皮细胞增殖抑制率的影响
注:与空白对照组比较:**P<0.01
2.2 双氢青蒿素对人脐静脉内皮细胞迁移能力的影响
图2显示,划痕实验结果显示,经药物干预24 h后,相对于空白对照组,双氢青蒿素30 mg/kg组、60 mg/kg组和阳性对照组的划痕宽度明显增宽,提示药物对细胞的迁移能力起到明显的抑制作用;双氢青蒿素低剂量组的划痕宽度相对于空白对照组变化不大。
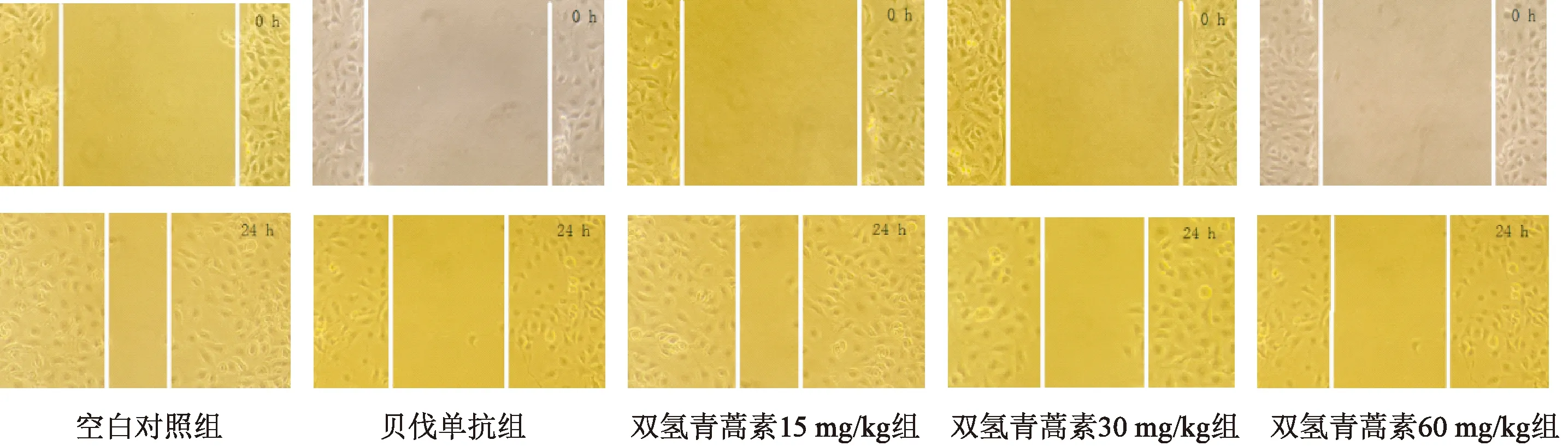
图2 双氢青蒿素干预后细胞迁移能力变化
2.3 双氢青蒿素对人脐静脉内皮细胞血管内皮生长因子mRNA表达的影响
表2显示,双氢青蒿素各个剂量组和阳性对照组的VEGF表达均显著低于正常组(P<0.05),表明药物对VEGF表达确实起到抑制作用。
2.4 双氢青蒿素对人脐静脉内皮细胞血管内皮生长因子受体最大结合容量和解离常数的影响
表2图3、4显示,双氢青蒿素30 mg/kg组、60 mg/kg组和阳性对照组的Bmax值较空白对照组明显降低(P<0.01),提示这3组样本的VEGF表达出现明显抑制,双氢青蒿素15 mg/kg组的Bmax表达则没有明显变化(P>0.05);4组样本的Kd值较空白对照组均明显升高(P<0.05),提示经药物处理后细胞的VEGF/VEGFR结合亲和力下降。取双氢青蒿素60 mg/kg剂量组绘制饱和曲线和scatchard 绘图,饱和曲线可见特异性结合(specific binding,SB)和总结合(total binding,TB)呈典型的饱和趋势,而非特异性结合(non-specific binding,NSB)则无饱和趋势为直线图。
表2 双氢青蒿素对人脐静脉内皮细胞VEGF mRNA表达和Bmax、Kd值的影响
注:与空白对照组比较:*P<0.05,**P<0.01

图3 双氢青蒿素60 mg/kg组的饱和曲线

图4 双氢青蒿素60 mg/kg组的scatchard分析
3 讨论
肿瘤的血管生成一直被认为是肿瘤快速增长、浸润、转移的基础[6],通过抑制肿瘤血管生成而实现抑瘤活性也是当前多种抗癌靶向药物的抑瘤机制[7]。血管生成过程中,内皮细胞活性是血管新生活跃的最关键因素,观察血管内皮细胞药物干预后的活性变化,对评估其抗血管生成作用有着重要意义。HUVEC具备人新生血管内皮的特点,并兼具原代获取容易、体外培养代谢稳定等优点[8],是科研最常用的血管内皮细胞。有研究发现,青蒿琥酯对HUVEC的迁移和小管形成可起到抑制作用[9],作用机制与青蒿琥酯诱导的铁依赖性活性氧产生、线粒体凋亡通路[10]以及增大细胞内Ca2+浓度[11]有关,这些研究提示青蒿素类药物可能存在抗血管生成作用。
在前期实验的基础上,我们将其作用靶点定位于血管内皮生长因子及其受体。血管生成因子是一类由细胞分泌,可促进血管形成的肽类物质,其种类非常多,各种血管生成因子之间相互作用,共同主导新血管生成[12]。VEGF是其中一类作用最直接、特异质最强的血管生成因子,组织血管生成旺盛时可检测到VEGF表达明显增强[13],是评估血管生成的重要检测指标。VEGF与受体的结合是其发挥生物学特性的基础,当血管生成被抑制时,不仅表现为VEGF自身表达下降,VEGF与受体的结合也会受到抑制[14]。目前VEGF受体发现有3种,即VEGFR-1(flt-1)、VEGFR-2(KDR/flk-1)和VEGFR-3(flt-4),三者均属酪氨酸激酶受体。VEGF通过与VEGFR的特异性结合发生自身磷酸化,并使VEGFR二聚体化而启动信号传导,通过促进基质金属蛋白酶分泌,增强NO合酶表达等途径,加速血管内皮细胞增殖和分化而调控血管新生[14-15]。故进一步对双氢青蒿素干预HUVEC后其VEGF表达、VEGF/VEGFR亲和力变化进行验证,也能更好地支持双氢青蒿素抑制血管生成理论。本次实验结果显示,经双氢青蒿素干预后,RT-qPCR结果显示,30 mg/kg和60 mg/kg组的双氢青蒿素对HUVEC的VEGF表达明显抑制。进一步用RBA法检测VEGF表达与VEGF/VEGFR结合亲和力变化,也发现适宜的双氢青蒿素剂量不仅可明显抑制VEGF表达,还能明显降低VEGF与VEGFR的结合力。结合前期的双氢青蒿素抗癌实验提示,双氢青蒿素的抗血管生成作用或许是其抗癌效应的其中一项机制。
[1] ZHOU HJ,ZHANG JL,LI A,et al.Dihydroartemisinin improves the efficiency of chemotherapeutics in lung carcinomas in vivo and inhibits murine Lewis lung carcinoma cell line growth in vitro[J].Cancer Chemother Pharmacol,2010,66(1):21-29.
[2] WANG XM,ZHANG L,DING GF,et al.Inhibitory effect of dihydroartemisinin on the growth of human prostate cancer PC-3M cells and its mechanism[J].Zhonghua Nan Ke Xue,2012,18(7):590-594.
[3] 盛庆寿,王武,郭洪武.双氢青蒿素对原发性肝癌大鼠的治疗作用及机制[J].中国实验方剂学杂志,2014,20(14):150-154.
[4] 盛庆寿,王武,郭洪武,等.双氢青蒿素含药血清抑制人肝癌SMMC-7721细胞活性的研究[J].中药药理与临床,2015,31(1):40-43.
[5] GIRAUDO E,PRIMO L,AUDERO E,et al.Tumor necrosis factor-alpha regulates expression of vascular endothelial growth factor receptor-2 and of its coreceptor neuropilin-1 in human vascular endothelial cells[J].Journal of Biological Chemistry,1998,273(34):22128-22135.
[6] YANG Z F,POON R T P.Vascular changes in hepatocellular carcinoma[J].The Anatomical Record,2008,291(6):721-734.
[7] ZHU AX.Development of sorafenib and other molecularly targeted agents in hepatocellular carcinoma[J].Cancer,2008,112(2):250-259.
[8] MARIN V,KAPLANSKI G,GRS S,et al.Endothelial cell culture: protocol to obtain and cultivate human umbilical endothelial cells[J].Journal of Immunological Methods,2001,254(1-2):183-190.
[9] CHEN H H,ZHOU H J,FANG X.Inhibition of human cancer cell line growth and human umbilical vein endothelial cell angiogenesis by artemisinin derivatives in vitro[J]. Pharmacological Research,2003,48(3):231-236.
[10] 程锐.青蒿琥酯诱导血管内皮细胞凋亡的分子机制研究[D].广州:中山大学,2011.
[11] 吴国东,周慧君.青蒿琥酯诱导人脐静脉内皮细胞凋亡[J].中国药理学与毒理学杂志,2004,18(4):294-299.
[12] HANAHAN D,FOLKMAN J.Patterns and emerging mechanisms of the angiogenic switch during tumorigenesis[J].Cell,1996,86(3):353-364.
[13] FERRARA N .Vascular endorthelial growth factor as a target foranticancer therapy[J].Oncologist,2004,9(suppl 1):2-10.
[14] POON R T P,HO J W Y,TONG C S W,et al.Prognostic significance of serum vascular endothelial growth factor and endostatin in patients with hepatocellular carcinoma[J].British Journal of Surgery,2004,91(10):1354-1360.
[15] YOSHIJI H,KURIYAMA S,NOGUCHI R,et al.Angiopoietin 2 displays a vascular endothelial growth factor dependent synergistic effect in hepatocellular carcinoma development in mice[J].Gut,2005,54(12):1768-1775.
TheResearchonTheAnti-angiogenicActivityofDihydroartemisininContainedSerum
WANG Wu1, SHENG Qing-shou2△
(1.DepartmentofLiverDisease,HainanProvincialHospitalofTraditionalChineseMedicine,Haikou570203,China;2.Guangximedicaluniversitygraduateschool,Nanning530021,China;3.DepartmentofLiverDisease,RuikangHospitalAffiliatedtoGuangxiUniversityofChineseMedicine,Nanning530011,China)
Objective: To study the proliferation and migration ability impact of dihydroartemisinin of different dosage group on human umbilical vein endothelial cell (HUVEC) and its mechanism. Methods:Prepared four dosage groups of drug serum, i.e. blank control group, dihydroartemisinin 15mg/kg group, dihydroartemisinin 30 mg/kg group and dihydroartemisinin 60 mg/kg group and then used them to HUVEC. Detected the cell proliferation with MTT method; The scratch test was used to analyze the cell migration ability; detected the VEGF expression with RT-qPCR method and detected VEGF receptors’ Bmax and dissociation constant with RBA method.Results: Compared with blank control group, the dihydroartemisinin 30 mg/kg group and dihydroartemisinin 60 mg/kg group obviously inhibited cell proliferation and reduce the ability of cell to migrate; RT-qPCR results show that the expression of dihydroartemisinin 30 mg/kg group and dihydroartemisinin 60 mg/kg group has significantly decrease; VEGF receptors Bmax in these two groups decreased clearly while the dissociation constant increased obviously. The results all have statistical significance.Conclusion: More than 30 mg/kg dose of dihydroartemisinin can remarkably inhibit HUVEC proliferation and migration ability. The inhibition mechanism may be related with the inhibition of VEGF and its function to block the combination with VEGFR.
Dihydroarteannuin; HUVEC; Proliferation; Migration; VEGF
广西自然科学基金资助项目(2012GXNSFAA053115)-双氢青蒿素介导VEGF/VEGFR信号通路调控肝癌血管生成的分子机制研究;广西卫生厅课题(Z2013239)-双氢青蒿素介导肝癌VEGF/VEGFR信号通路研究;八桂学者建设工程专项经费资助项目
王 武(1988-),男,海南海口人,主治医师,医学硕士,从事急慢性肝病的中西医结合临床与研究。
△通讯作者:盛庆寿(1976-),男,江西人,主任医师,医学博士,从事慢性肝病的临床与研究,Tel:13707715487,E-mail:675249679@qq.com。
R289.5
B
1006-3250(2017)11-1635-04
2017-03-23

