胍基锂化合物的合成、晶体结构及催化异氰酸酯三聚反应
高晓娜,韩红斐,郭志强,魏学红,*
(1.运城学院 应用化学系,山西 运城 044000;2.山西大学 化学化工学院,山西 太原 030006;3.山西大学 大型科学仪器研究中心,山西 太原 030006)
胍基锂化合物的合成、晶体结构及催化异氰酸酯三聚反应
高晓娜1,2,韩红斐2,郭志强3,魏学红2,3*
(1.运城学院 应用化学系,山西 运城 044000;2.山西大学 化学化工学院,山西 太原 030006;3.山西大学 大型科学仪器研究中心,山西 太原 030006)
以二乙胺、正丁基锂和不对称的碳化二亚胺PhN=C=NCy反应,生成一个新的胍基锂化合物,[(Et)2NC(NCy)(NPh)LiOEt2]2(1),该化合物通过元素分析、1H NMR、13C NMR和X-ray单晶衍射等完整的结构表征。另外,研究了该胍基锂化合物(1)对芳香异氰酸酯三聚合成异氰脲酸酯的催化效果。实验结果表明,在室温条件下,当催化剂1和底物的摩尔比为0.5%,反应时间为10 min时,三聚合成异氰脲酸酯的产率最高可达到99%。
胍基锂化合物;合成;晶体结构;催化
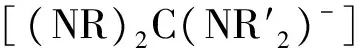
由于异氰脲酸酯分子中存在稳定的六元环结构,且环上没有活泼氢存在,这种结构使它具有刚性、阻燃性、热稳定性和水解稳定性等特点,这些与生俱来的特点促使这类物质有着广阔的应用领域,尤其是在建筑外墙使用的保温隔热材料方面。聚氨酯硬泡(RPUF)是目前广泛应用于外墙的保温材料,但是这种材料存在着阻燃性和耐热性差的劣势,如果在聚氨酯链上引入异氰脲酸酯,改性过的聚氨酯可以在150℃高温下长期连续使用,其先天不足的缺点能得到极大的改善[15]。另外,异氰脲酸酯还应用在需要耐水、透明且耐撞击的共聚物合成树脂的制备上[16]。鉴于异氰脲酸酯广阔的应用领域,因此开发新的催化剂来高效制备异氰脲酸酯是许多化学工作者的研究热点。
本论文以二乙胺、正丁基锂和不对称的碳化二亚胺PhN=C=NCy为起始原料,合成了一个新的胍基锂化合物,并利用NMR、X-ray单晶衍射等测试手段对该化合物进行了完整的结构表征。另外,我们将这种胍基锂化合物应用于异氰酸酯的三聚反应中,催化效果良好。
1 实验部分
1.1 试剂与仪器
二乙胺、苯基异氰酸酯、对氯苯异氰酸酯、对甲基苯异氰酸酯和对甲氧基苯异氰酸酯(阿拉丁试剂公司,分析纯),nBuLi(1.6 mol/L正己烷溶液,Alfa Aesar试剂公司);不对称的碳化二亚胺PhN=C=NCy按文献合成[17];实验中所用溶剂经干燥、蒸馏后使用;Vario EL-Ⅲ元素测定仪,Brucker 300 MHz核磁共振波谱仪(TMS为内标),Bruker Smart CCD X-Ray单晶衍射仪。
1.2 合成与表征
1.2.1 [(Et)2NC(NCy)(NPh)LiOEt2]2(1)的合成与结构表征
在氮气保护下,将n-BuLi(1.88 mL,3.0 mmol)缓慢地逐滴加到冷却的(约0 ℃)Et2NH(0.30 mL,3.0 mmol)乙醚(约20 mL)溶液中,搅拌0.5 h,撤去冰浴,恢复到室温后继续反应1 h。随后将N-环己基-N′-苯基碳二亚胺(CyN=C=NPh,0.601 g,3.0 mmol)加入到上述的混合反应溶液中,反应2 h后停止搅拌,过滤,浓缩滤液至约10 mL, 将滤液放于-5℃的冰箱中,两天后析出无色透明的晶体(1,0.923 g,87%,式1)。Anal. Calc. for C42H72LiN6O2: C, 71.36; H, 10.27; N, 11.89. Found: C, 71.20; H, 10.19; N, 12.02%.1H NMR (C6D6, δ/ppm): 0.95 (br, 6H, NCH2CH3), 1.09 (t, 6H, OCH2CH3), 1.18-1.21 (m, 4H, C6H11), 1.30-1.76 (m, 6H, C6H11), 2.95 (br, 4H, NCH2CH3), 3.13 (br, 1H, C6H11), 3.28-3.31 (q, 4H, OCH2CH3), 6.87 (t, 1H, C6H5), 6.96 (br, 2H, C6H5), 7.30 (br, 2H, C6H5);13C NMR (C6D6, δ/ppm): 13.09 (NCH2CH3), 14.97 (OCH2CH3), 26.28, 27.17, 36.34 (C6H11), 43.42 (NCH2CH3), 56.05 (C6H11), 65.29 (OCH2CH3), 122.21, 123.22, 128.65, 147.66 (C6H5), 167.53 (NCN)。
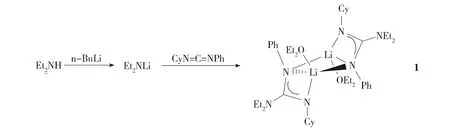
Scheme 1 Synthetic route of complex 1式1 化合物1的合成路线
1.2.2 化合物1催化异氰酸酯三聚环化合成异氰脲酸酯的一般过程
在氮气保护下将催化剂与异氰酸酯(摩尔比为0.5%)溶于约10 mL乙醚中,在室温下逐滴加入异氰酸酯,搅拌约1 min后开始生成白色沉淀,随着反应进行沉淀逐渐增多,继续反应10 min,停止反应。静置后过滤,沉淀用约10 mL乙醚洗涤2次,烘干后得到产品异氰脲酸酯(式2),产品通过NMR测试,产率为分离产率。
1,3,5-三苯基异氰脲酸酯1H NMR (CD3Cl, δ/ppm): 7.27-7.52 (m, 15H, C6H5);13C NMR (C6D6, δ/ppm): 128.87, 129.83, 134.06 (C6H5), 149.38 (C=O)。
1,3,5-三(4-甲基)苯基异氰脲酸酯1H NMR (CD3Cl, δ/ppm): 2.25 (s, 9H, CH3), 7.22-7.48 (m, 12H, C6H4);13C NMR (C6D6, δ/ppm): 20.57 (CH3), 127.37, 129.31, 130.49, 138.53 (C6H4), 148.12 (C=O)。
1,3,5-三(4-氯)苯基异氰脲酸酯1H NMR (CD3Cl, δ/ppm): 7.25-7.51 (m, 12H, C6H4);13C NMR (C6D6, δ/ppm): 129.27, 131.33, 134.92 (C6H4), 147.58 (C=O)。
1,3,5-三(4-甲氧基)苯基异氰脲酸酯1H NMR (CD3Cl, δ/ppm):1H NMR (CD3Cl, δ/ppm): 3.79 (s, 9H, OCH3), 6.95-7.33 (m, 12H, C6H4);13C NMR (C6D6, δ/ppm): 57.62 (OCH3), 116.73, 128.40, 131.57, 151.25 (C6H4), 162.00 (C=O)。
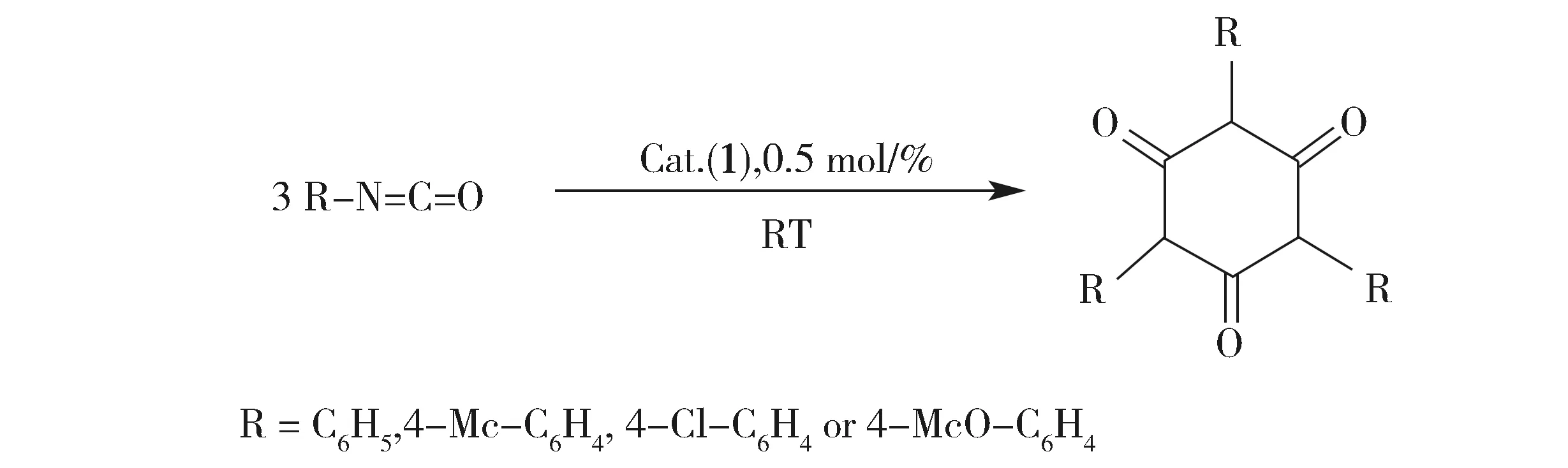
Scheme 2 Preparation of isocyanurates catalyzed by the complex 1式2 化合物1催化合成异氰脲酸酯
2 结果与讨论
2.1 胍基锂化合物1的晶体结构

Fig.1 Molecular Structure of the guanidinatolithium complex 1 (Hydrogen atoms are omitted for clarity)图1 胍基锂化合物1的分子结构(为简洁氢原子被省略)
化合物1的晶体从乙醚溶液中结晶得到,其单晶结构图见图1,部分键长与键角见表1。化合物1的分子结构是一个二聚的锂盐,结构类似于已经报道的化合物[(iPr)2NC(NCy)2LiOEt2]2[18],呈中心对称,对称中心位于四边形Li2N2的中心。化合物1分子的主体结构类似于一个扭曲的三环梯状结构,平面Li(1)N(3)C(7)N(1)和平面Li(1)′N(3)′C(7)′N(1)′完全平行,这两个平面与平面Li(1)N(1)Li(1)′N(1)′形成的二面角都为60.61(8) °。分子结构中的两个Li原子分别同两个胍基骨架中的三个N原子、一个O原子(来自溶剂乙醚)键合,形成扭曲的四面体构型。化合物1中Li-N键的键长为1.979(3)和2.231(3)Å,类似于化合物[(iPr)2NC(NCy)2LiOEt2]2中Li-N键的键长(1.987(3),2.214(3)Å)。对于胍基骨架C(7)N3而言,C(7)-N(1),C(7)-N(2)和C(7)-N(3)的键长分别是1.332 9(18),1.398 4(18)和1.344 5(18)Å,由此可见C-N键都具有部分双键特性,三个C-N键具有一定程度的共轭作用。另外,Li(1)-O(1)键长为2.038(3),两个金属Li原子的距离为2.587(5)Å。

表1 胍基锂化合物1的部分键长(Å)与键角(°)Table 1 Selected bond lengths (Å) and bond angles (°) of the guanidinatolithium complex 1
2.2 胍基锂化合物1催化异氰酸酯的三聚反应
我们采用胍基锂化合物1对芳基异氰酸酯的环化反应进行了研究,研究结果见表2。我们对反应的条件进行了优化,首先选择苯异氰酸酯作为底物,催化剂的加载量为0.5 mol%时进行反应溶剂的筛选(表2,Entries1-4),结果显示,反应10 min后所有苯异氰酸酯的三聚环化反应的产率均能达到90%以上,但是反应在溶剂乙醚中的产率最高,苯基异氰脲酸酯的产率能达到98%;其次在催化剂加载量和反应溶剂不变的情况下,我们改变苯异氰酸酯三聚环化的反应时间发现,缩短和延长反应时间,对苯基异氰脲酸酯的产率影响不大(表2,Entries 5-6);当催化剂的加载量减半后,苯异氰酸酯的三聚环化反应的产率略有减少(表2,Entry 7)。因此使用胍基锂化合物1进行催化芳基异氰酸酯三聚环化反应的最佳条件为:常温下在乙醚溶剂中,催化剂的加载量为0.5 mol%,反应时间为10 min。另外,我们使用胍基锂化合物1在最佳的反应条件下,拓展了底物的范围(表2,Entries 8-10)。研究发现,芳基异氰酸酯中芳环上取代基对其三聚环化产率有一定的影响,当苯环对位上是给电子基团时,转化产率降低,苯环对位上是吸电子基团时,转化产率明显升高。究其原因是,转化产率和异氰酸根中碳原子的电子云密度有关[19],苯环上给电子基团使碳原子的电子云密度增加,苯环上吸电子基团使碳原子的电子云密度降低。
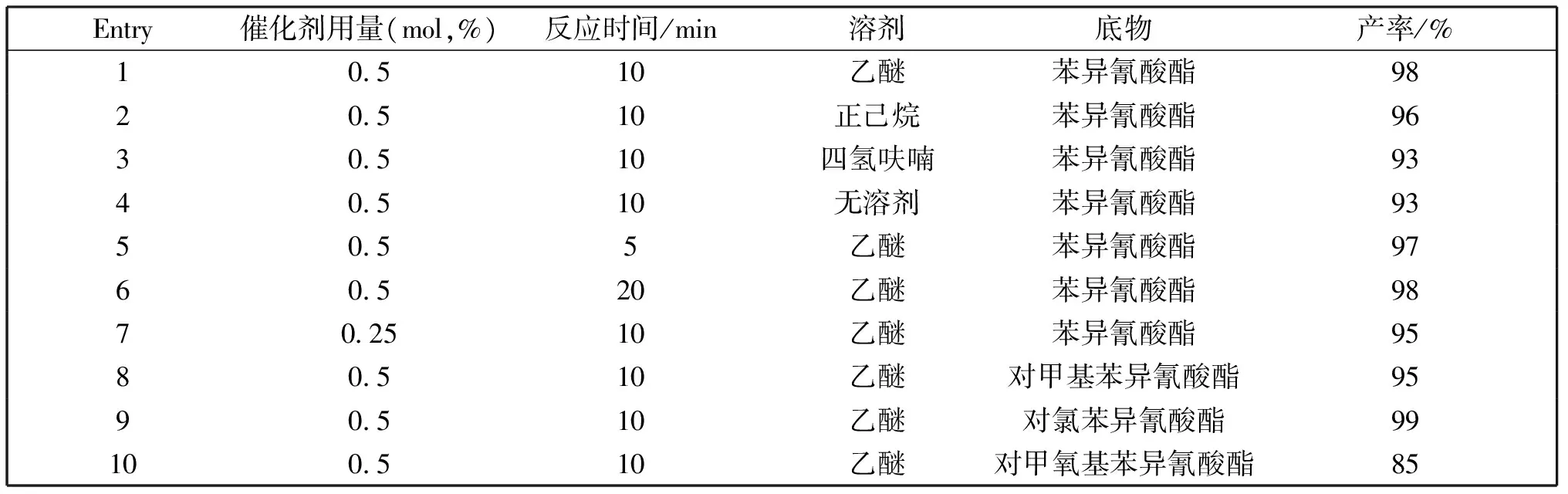
表2 胍基锂化合物1催化异氰酸酯三聚反应Table 2 Trimerization of isocyanates catalyzed by the guanidinatolithium complex 1
3 结论
合成了一个新的胍基锂化合物,并且利用NMR、X-ray单晶衍射等测试手段对该化合物进行了完整的结构表征,另外使用该化合物对异氰酸酯的三聚反应进行了研究。研究表明,底物芳基异氰酸酯中芳环上取代基的种类对反应的产率有一定的影响,芳环上吸电子基团有利于异氰酸酯的三聚反应。
[1] Chandra G,Jenkins A D,Lappert M F,etal.Amido-derivatives of Metals and Metalloids Part X.Reactions of Titanium(Ⅳ), Zirconium(Ⅳ), and Hafnium(Ⅳ) Amides with Unsaturated Substrates,and Some Related Experiments with Amides of Boron, Silicon, Germanium, and Tin(Ⅳ)[J].JChemSocA,1970,5:2550-2558.DOI:10.1039/J19700002550.
[2] Han H,Guo Z,Zhang S,etal.Synthesis and Crystal Structures of Guanidinatoaluminum Complexes and Catalytic Study for MPV Reduction[J].Polyhedron,2017,126:214-219.DOI:org/10.1016/j.poly.2017.01.030.
[3] Han H,Guo Z,Zhang S,etal.Guanidinatoaluminum Complexes:Synthesis,Crystal Structures and Reactivities[J].RSCAdv,2016,6:101437-101446.DOI:10.1039/c6ra18367k.
[4] Schwamm R J,Day B M,Mansfield N E,etal.Catalytic Bond Forming Reactions Promoted by Amidinate,Guanidinate and Phosphaguanidinate Compounds of Magnesium[J].DaltonTrans,2014,43:14302-14314.DOI: 10.1039/C4DT01097C.
[5] Bailey P J,Pace S.The Coordination Chemistry of Guanidines and Guanidinates[J].CoordChemRev,2001,214:91-141.DOI:org/10.1016/S0010-8545(00)00389-1.
[6] Kenney A P,Yap G P A,Richeson D S,etal.The Insertion of Carbodiimides into Al and Ga Amido Linkages.Guanidinates and Mixed Amido Guanidinates of Aluminum and Gallium[J].InorgChem,2005,44:2926-2933.DOI:10.1021/ic048433g.
[7] Rische D,Baunemann A,Winter M,etal.Mixed Guanidinato/Alkylimido/Azido Tungsten(Ⅵ) Complexes:Synthesis and Structural Characterization[J].InorgChem,2006,45:269-277.DOI:10.1021/ic0512431.
[8] Carmalt C J,Newport A C,O′Neill S A,etal.Synthesis of Titanium(Ⅳ) Guanidinate Complexes and the Formation of Titanium Carbonitride via Low-Pressure Chemical Vapor Deposition[J].InorgChem,2005,44:615-619.DOI:10.1021/ic049013u.
[9] Zhou Y,Yap G P A,Richeson D S.N-Substituted Guanidinate Anions as Ancillary Ligands in Organolanthanide Chemistry.Synthesis and Characterization of {CyNC[N(SiMe3)2]NCy}2SmCH(SiMe3)2[J].Organometallics,1998,17:4387-4391.DOI:10.1021/om980480r.
[10] Jones C.Bulky Guanidinates for the Stabilization of Low Oxidation State Metallacycles[J].CoordChemRev,2010,254:1273-1289.DOI:org/10.1016/j.ccr.2009.07.014.
[11] Day B M,Mansfield N E,Coles M P,etal.Bicyclic Guanidinate Compounds of Magnesium and Their Activity as Pre-catalysts in the Tishchenko Reaction[J].ChemCommun,2011,47:4995-4997.DOI:10.1039/C0CC04789A.
[12] Coles M P.Bicyclic-Guanidines,-Guanidinates and-Guanidinium Salts:Wide Ranging Applications from a Simple Family of Molecules[J].ChemCommun,2009,45:3659-3676.DOI:10.1039/B901940E.
[13] Milanov A P,Xu K,Cwik S,etal.Sc2O3,Er2O3,and Y2O3Thin Films by MOCVD from Volatile Guanidinate Class of Rare-Earth Precursors[J].DaltonTrans,2012,41:13936-13947.DOI: 10.1039/C2DT31219K.
[14] Xu K,Milanov A P,Winter M,etal.Heteroleptic Guanidinate-and Amidinate-Based Complexes of Hafnium as New Precursors for MOCVD of HfO2[J].EurJInorgChem,2010:1679-1688.DOI:10.1002/ejic.200901225.
[15] Paul F,Moulin S,Piechaczyk O,etal.Palladium(0)-Catalyzed Trimerization of Arylisocyanates into 1,3,5-Triarylisocyanurates in the Presence of Diimines:A Nonintuitive Mechanism[J].JAmChemSoc,2007,129:7294-7304.DOI:10.1021/ja068291k.
[16] Raders S M,Verkade J G.An Electron-Rich Proazaphosphatrane for Isocyanate Trimerization to Isocyanurates[J].JOrgChem,2010,75:5308-5311.DOI:10.1021/jo9023396.
[17] Ali A R,Ghosh H,Patel B K.A Greener Synthetic Protocol for the Preparation of Carbodiimide[J].TetrahedronLetters,2010,51:1019-1021.DOI:org/10.1016/j.tetlet.2009.12.017.
[18] Rudolf D,Kaifer E,Himmel H J.Novel Bi-and Trinuclear Gallium Halides and Hydrides with Acyclic and Bicyclic Guanidinate Substituents:Synthesis and Reactivity[J].EurJInorgChem,2010:4952-4961.DOI:10.1002/ejic.201000598.
[19] Shi J,Guo Z,Wei X,etal.Lithium Dibenzylamide,a Simple,Selective and Highly Efficient Catalyst for Isocyanate Cyclotrimerization to Isocyanurate[J].Synlett,2011,13:1937-1939.DOI:10.1055/s-0030-1260825.
Synthesis,CrystalStructureandItsApplicationinTrimerizationofIsocyanatesofaGuanidinatolithiumComplex
GAO Xiaona1,2,HAN Hongfei2,GUO Zhiqiang3,WEI Xuehong2,3*
(1.DepartmentofAppliedChemistry,YunchengUniversity,Yuncheng044000,China;2.SchoolofChemistryandChemicalEngineering,ShanxiUniversity,Taiyuan030006,China;3.ScientificInstrumentCenter,ShanxiUniversity,Taiyuan030006,China)
Treatment of diethyl amide with n-butyl lithium and unsymmetric carbodiimine PhN=C=NCy afforded a new guanidinatolithium complex, [(Et)2NC(NCy)(NPh)LiOEt2]2(1), which was characterized by elemental analyses,1H,13C NMR spectra and single crystal X-ray diffraction analysis. In addition, the trimerization of aryl isocyanates to aryl isocyanurates catalyzed by the guanidinatolithium complex (1) was also investigated. The experimental results showed that the yield of aryl isocyanurate by the trimerization reaction was up to 99% when mol ratio of1as pre-catalyst to substrate is 0.5%,and reaction time is for 10 min at room temperature.
guanidinatolithium complex;synthesis;crystal structure;catalysis
10.13451/j.cnki.shanxi.univ(nat.sci.).2017.04.028
2017-03-31;
2017-04-19
山西省煤基重点科技攻关项目(MH2014-07),山西省自然科学基金(201601D202091)
高晓娜(1987-),女,助教,主要研究方向:金属有机合成。E-mail:771984363@qq.com
*通信作者:魏学红(WEI Xuehong),E-mail:xhwei@sxu.edu.cn
O627
A
0253-2395(2017)04-0854-05

