反胶束的微结构与前萃率相互关系的研究
张倩,陈复生,*,孙倩
(1.河南工业大学粮油食品学院,河南郑州450001;2.北京科技大学化学与生物工程学院生物前沿技术与应用研究中心,北京100024)
反胶束的微结构与前萃率相互关系的研究
张倩1,陈复生1,*,孙倩2
(1.河南工业大学粮油食品学院,河南郑州450001;2.北京科技大学化学与生物工程学院生物前沿技术与应用研究中心,北京100024)
以全脂豆粉为原料,在不同单因素条件下,对丁二酸二异辛酯磺酸钠(sodium bis(2-ethylhexyl)sulfo succinate,AOT)/异辛烷反胶束萃取体系分离提取大豆分离蛋白的前萃过程中胶束的平均粒径及W0进行分析,结合前萃率的变化,探讨反胶束的微结构与前萃率相互关系的变化规律。
全脂豆粉;反胶束;微结构;前萃率
反胶束是两性表面活性剂分子在非极性溶剂中自发形成的极性头朝内,非极性尾朝外的热力学稳定的纳米聚集体[1-2]。该体系的内部水核结构能够有选择性的增溶水溶性物质如蛋白质、氨基酸等[3-4],在分离纯化的基础上,能够较大程度的保持蛋白质的生物活性。此外,反胶束体系能够同时分离油脂和蛋白,低能耗条件下实现连续操作,因此针对大豆、花生等油料作物的蛋白提取而言,是一种前景广阔的分离技术[5]。反胶束萃取蛋白的过程可以分为两步:前萃和后萃。前萃即蛋白质固体与反胶束溶液混合震荡后增溶至反胶束内部水核中的过程,后萃过程即通过加入一定体积的水相,使蛋白质从反胶束中转入水相中的过程。前萃过程为液-固萃取,后萃为液-液萃取,pH值、表面活性剂浓度、离子浓度等一系列因素都会影响前萃过程的传质[6]。
目前,多位学者都对前萃过程有所研究,但大多仅仅局限于不同条件下对提取率的优化分析上,对蛋白质增溶于反胶束的过程还有待进一步的探讨。此外,就实际应用而言,关于反胶束体系的平衡状态、不同条件下的粒径变化等问题依然值得研究[7-8]。此前,有研究就表明表面活性剂浓度和含水量会对反胶束体系的粒径等有所影响,进而影响该体系对蛋白的萃取率[9-11]。因此,本文选取表面活性剂浓度、加水量、pH值和盐浓度四个关键因素,探讨不同条件下蛋白质增溶于反胶束前后反胶束体系的W0及粒径的变化规律,并结合前萃率的变化规律,进一步阐明蛋白质增溶于反胶束体系的变化过程,为提高反胶束体系萃取率提供相应的理论依据。
1 材料与方法
1.1 材料与仪器
全脂大豆粉:河南省鲲华生物技术有限公司;丁二酸二异辛酯磺酸钠(sodium bis(2-ethylhexyl)sulfo succinate,AOT):上海海曲化工有限公司;异辛烷(分析纯):天津市科密欧化学试剂有限公司;Na2HPO4、KH2PO4、KCl、浓H2SO4(分析纯):洛阳昊华化学试剂有限公司。
BS210S型分析天平:德国Sartorius公司;K1100全自动凯氏定氮仪:济南海能仪器股份有限公司;ZSD-2J智能自动水分滴定仪:上海安亭科学仪器有限公司;Zetasizer Nano ZS90激光粒度分析仪:英国马尔文仪器公司;GL-20C型高速冷冻离心机:上海安亭科学仪器有限公司;pH211型pH计:意大利HANNA公司;SHZ-82型数显水浴恒温振荡器:常州博远实验分析仪器厂。
1.2 实验方法
1.2.1 反胶束溶液的制备
称取一定质量的AOT于锥形瓶中,加入一定体积的异辛烷,用手摇匀至AOT完全溶解。然后加入含一定浓度KCl的特定pH的Na2HPO4-KH2PO4缓冲溶液,气浴震荡1 h后,静置12 h。若溶液澄清透明,即为反胶束溶液。
1.2.2 反胶束萃取大豆蛋白
称取一定质量的全脂豆粉,加入到一定体积的反胶束溶液中,40℃水浴震荡30min后,5 000 r/min离心25min。上清液即为前萃液(大豆蛋白已经增溶进入反胶束内)。加入与上清液相同体积的含1 mol/L的KCl的Na2HPO4-KH2PO4缓冲溶液,40℃水浴震荡30min后,4 000 r/min离心30min后,下层水相即为溶有蛋白的后萃液。本文主要针对前萃过程研究。
1.2.3 Karl-fischer法测定胶束体系的W0值
采用智能自动水分滴定仪对反胶束溶液(蛋白质增溶前的溶液)和前萃液的含水量进行测定,测定方法具体如下:首先自动吸取一定体积的甲醇(一级色谱纯)于滴定瓶中,以液面高于金属铂片为准,然后手动吸卡尔费休液后打空白,待滴定瓶中的甲醇中的水消耗完之后,用微量进样器直接加入10 μL的水进行标定,重复标定五次后得到滴定度。然后用微量进样器加入50 μL的待测溶液,测定后可得到待测溶液中的含水量V水。再按照公式1计算待测溶液的W0值。

1.2.4 反胶束体系粒径测定方法
采用Zetasizer Nano ZS90激光粒度分析仪对反胶束体系的粒径进行测定。在样品池中加入1mL左右的待测液,系数设定如下:黏度参数0.47 Cp,折光率为1.389,分散剂为异辛烷,温度设定为25℃。每个样品测定至少3次。最后取平均值得到待测样品的平均粒径。
1.2.5 前萃率的测定方法
先称取一定质量的全脂豆粉,用量筒准确称量一定体积的反胶束溶液,均倒入锥形瓶中,水浴震荡后离心处理,弃去豆粉沉渣,上清液即为溶有蛋白质的前萃液,通过凯氏定氮的方法测定前萃液中的蛋白质含量。蛋白质前萃率按式2计算:

1.3 试验条件设置
采用AOT反胶束体系萃取大豆蛋白,以AOT浓度、pH值、加水量和KCl盐浓度为单因素,探讨不同的单因素条件下,反胶束溶液的粒径大小、含水量W0、前萃液的粒径大小、含水量W0与前萃率的相互关系。其中,AOT 浓度水平设为:0.04、0.06、0.08、0.10、0.12 g/mL。pH 值水平设为:5、6、7、8、9。KCl盐浓度水平设为:0,0.05、0.10、0.15、0.20 mol/L。加水量水平设为:0.02、0.04、0.06、0.08、0.1mL/mL。豆粉浓度定为 0.02 g/mL。加热温度设为40℃,时间设为30min。
1.4 数据分析
本试验采用Microsoft Excel软件、SPSS16.0对数据进行处理分析以及绘图。试验结果都至少重复3次。
2 结果与分析
2.1 AOT浓度对反胶束萃取的影响规律研究
AOT浓度对反胶束萃取的影响规律研究见图1。
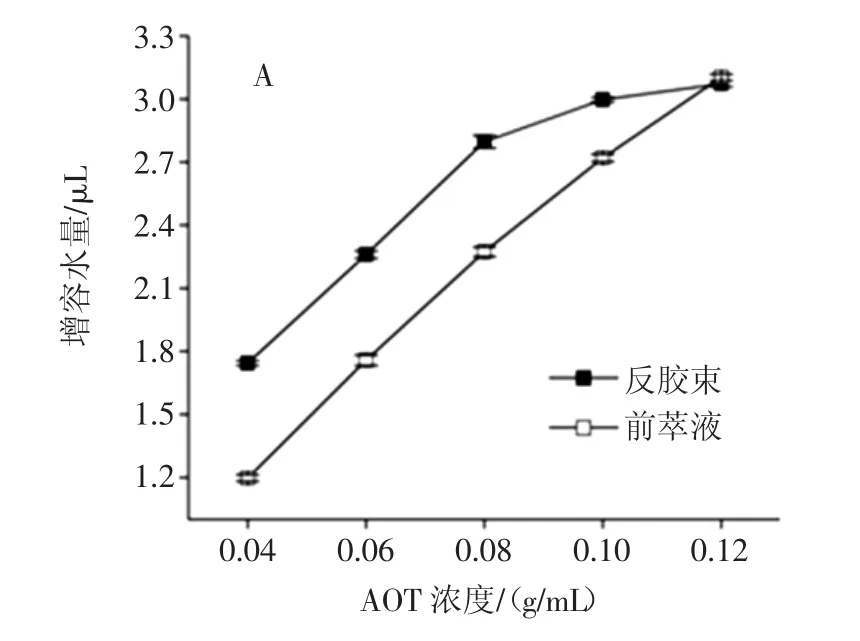

图1 AOT浓度对反胶束萃取大豆分离蛋白的影响Fig.1 The effect of AOT concentration on the reverse micelle extraction of SPI
AOT浓度对反胶束体系萃取蛋白前后的增溶水量及W0的影响规律如图1-(A)所示,在加水量不变的情况下,随着AOT浓度的增加,反胶束溶液和前萃液的含水量都呈显著增加趋势,而且反胶束溶液的增溶水量在0.10 g/mL之后增加趋势逐渐平缓。这表明随着AOT浓度的增加,反胶束溶液和前萃液中的增溶水量都明显增加,并在0.12 g/mL的条件下两者基本持平。对于反胶束溶液而言,增溶水量在0.04 g/mL~0.08 g/mL范围内变化趋势明显,说明AOT浓度较低时形成的反胶束聚集数较少,而在未饱和之前,胶束数目会随着AOT浓度变化显著,增溶水量也会增加的较为明显。而0.08 g/mL~0.12 g/mL范围内,反胶束溶液的增溶水量增加逐渐趋于平缓,表明体系中的反胶束已经逐渐饱和,结合图1-(B)的W0值不断下降的趋势,即体系中形成的胶束数目在不断增加,但每个胶束中增溶水量的比例却在下降。而对于空胶束而言,增溶水量的比例会直接影响反胶束的大小[12],因此,可以得出结论,空胶束的尺寸是随着AOT浓度的增加而递减的。这与粒径结果是相一致的,即反胶束数目多尺寸小。
对于前萃液而言,图1-(C)表明前萃液相较于同等条件下的反胶束溶液的增溶水量都有所降低,这是因为蛋白增溶进反胶束体系后,在水核中发生水合作用[3],因此前萃液的增溶水量整体比空胶束溶液低。且图1-(B)可以看出反胶束溶液和前萃液对应的W0值都是逐渐降低的,且前萃液的W0值的变化较为平缓。图1-(C)表明平均粒径的整体数值都相较于空胶束有显著增加,但整体趋势却和空胶束的变化相反,呈现逐渐增加的趋势。这是因为反胶束体系本身就是一个不断更新的稳定的热力学体系,当AOT浓度较低时,整个体系的胶束聚集数比较少,形成的空胶束尺寸较大,蛋白质增溶进胶束水核后,水核结构体积变大,整个胶束体系无法被少量的表面活性剂包裹进而实现稳定,会自发裂解为较小体积的反胶束结构。因此,由图1-(C)可以看出,当AOT浓度在0.04 g/mL~0.08 g/mL的范围时,形成的胶束聚集数还远没有达到饱和,有机相中有足够的空间使其分解为稳定的反胶束结构,所以处于平稳递增状态。但是当AOT浓度在0.08 g/mL~0.12 g/mL的范围时,反胶束聚集数越发接近饱和,反胶束体系黏度增大,随着表面活性剂间的分子相互作用和位阻效应的明显增强,蛋白增溶后临近胶束之间会自发融合形成大体积的新胶束体系以实现整个系统的稳定[13-14],因此,在该范围内,增溶后的胶束体系平均粒径迅速增加,但增溶的蛋白质的总量并未有所增加。这和前萃率的变化规律是一致的,如图1-(D)所示。整体呈现先增加后降低的趋势,并在AOT浓度为0.08 g/mL时前萃率最高。因为在AOT浓度较低时,形成的反胶束聚集数目太少,难以增溶较多的大豆蛋白,而AOT浓度太高时,体系黏度较大,胶束溶液的整体极性增大,反胶束聚集数目的增加趋势逐渐平缓,且有效水核结构并未增加,因此增溶蛋白后的胶束相互融合之后虽有利于蛋白的提取,但提取率基本保持不变。
2.2 加水量对反胶束萃取的影响规律研究
加水量对反胶束萃取的影响规律研究见图2。
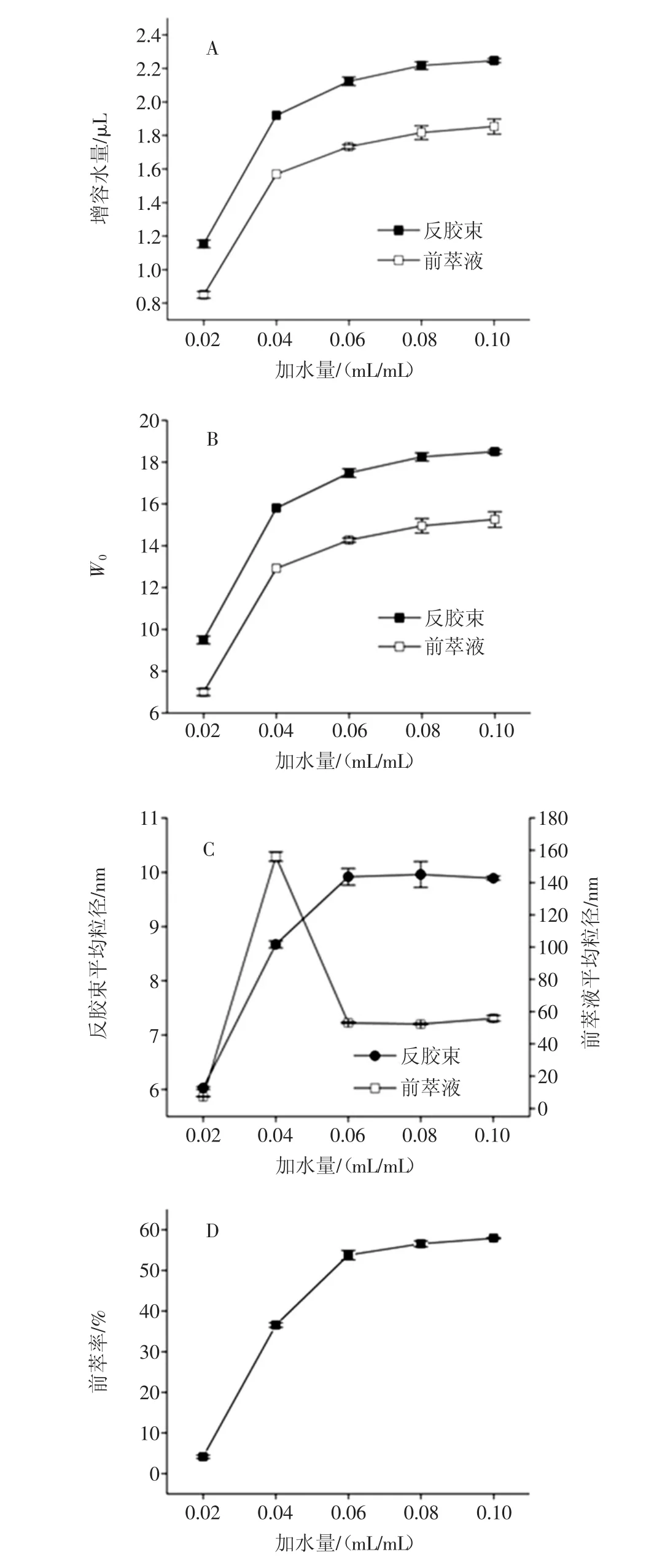
图2 加水量对反胶束萃取大豆分离蛋白的影响Fig.2 The effect of water addition on the reverse micelle extraction of SPI
加水量对大豆蛋白增溶于反胶束体系前后的增溶水量和W0的影响规律如图2-(A,B)。由图可以看出随着加水量的逐渐增加,增溶水量和W0值均逐渐增加,而且前萃液的增溶水量和W0值均低于同等条件下的空胶束溶液。加水量在0.02mL/mL~0.06mL/mL的范围内,增溶水量和W0都迅速增加,这是因为当反胶束体系胶束聚集情况一样时,加水量越多,表面活性剂极性头水化程度越大,形成的水核结构越大,因此,随着加水量的增加,增溶水量和W0都不断增加。但是,反胶束体系水核结构能够增溶的水量是有限的。因此当加水量在0.0mL/mL~0.12mL/mL时,随着加水量的增加,反胶束体系的增溶水量逐渐接近饱和,增加趋势平稳缓慢。
加水量对蛋白增溶前后反胶束体系的平均粒径的影响规律见图2-(C)。反胶束溶液的平均粒径整体呈现递增趋势,且在加水量为0.02mL/mL~0.06mL/mL的范围内迅速增加,而在0.06mL/mL~0.10mL/mL的范围内基本没有变化,这与增溶水量和W0的变化规律是一致的,这是因为在反胶束水核结构饱和前,加水量对水核的大小影响较为明显。但加水量大于0.06mL/mL的时候,反胶束体系中的水核结构接近饱和,因此水核的大小不再随着加水量增加而变化,甚至加水量过多时会破坏稳定的反胶束体系。对于前萃液,平均粒径是在加水量为0.04 g/mL时激增后迅速下降,之后随着加水量的增加平均粒径保持平稳。加水量为0.02mL/mL时,反胶束体系中大多数为不含水核结构的“实心胶束”,不具备增溶蛋白质的能力,因此前萃液中的平均粒径较小。而随着加水量的递增,当加水量增加至0.04mL/mL时,前萃液的粒径出现明显增加,当加水量继续增加时,前萃液粒径减小并保持稳定。这可能是由于加水量在0.04mL/mL时,蛋白质增溶后,胶束的体积和表面积增加,需要额外的表面活性剂覆盖以形成完整的体系,然而增溶水量和W0值未出现异常变化,只有前萃液胶束体系粒径出现激增,极有可能是因为胶束之间发生了融合现象,形成了较大的胶束[15]。
加水量对反胶束体系萃取大豆分离蛋白的前萃率的影响规律见图2-(D)。由图2-(D)中前萃率的规律也可以看出,随着加水量的增加,前萃率逐渐增加然后基本保持稳定,这是因为随着加水量的增加,胶束粒径增大,增溶蛋白质的能力逐渐增强。当加水量在0.06 g/mL之后,反胶束溶液含水量基本饱和,因此前萃率也基本保持稳定。结合粒径变化规律可以看出,反胶束的粒径与前萃率是存在一定的正相关性的,但前萃液的粒径对前萃率的影响就没有直接的相关性。
2.3 pH值对反胶束萃取的影响规律研究
反胶束溶液配制过程中所添加的盐溶液的pH值对反胶束溶液的增溶水量和W0值的影响如图3所示,均呈现先增加后降低的趋势,且不同pH梯度下并未有较为显著的差异,表明酸碱度对于反胶束溶液的增溶水量影响并不明显。
反胶束萃取前后体系的平均粒径变化规律如图3-(C)所示。

图3 pH值对反胶束萃取大豆分离蛋白的影响Fig.3 The effect of pH on the reverse micelle extraction of SPI
由图3-(C)可以看出pH值对于反胶束溶液的胶束粒径大小影响也是呈现先增大后降低的趋势,这和体系W0的变化规律是一致的。而且,蛋白增溶后的胶束直径也呈现先增大后减小的趋势,且在pH值为7的情况下粒径最大。研究表明[16]反胶束增溶蛋白的能力与反胶束的平均粒径存在一定线性关系,反胶束的粒径较大,便可以增溶较大分子的蛋白,进而在一定程度上提高蛋白的萃取率。当AOT浓度和加水量恒定的情况下,反胶束数目和反胶束粒径并未出现较大波动,均在小范围内呈现先增大后减小的趋势,因此,由图3-(D)可以看出前萃率的变化趋势也与粒径基本保持一致,在pH为7时前萃率最高,这和杨光胜。大豆分离蛋白的等电点4.5,在pH高于蛋白质等电点的情况下,带负电的蛋白质分子依然能增溶进入阴离子表面活性剂形成的反胶束体系,表明蛋白增溶于反胶束体系的动力并非主要是由静电相互作用引起的,还有疏水相互作用和空间位阻效应[17]。因为某些侧链氨基酸如谷氨酸和天冬氨酸等会在高于蛋白等电点的情况下表现出较强的疏水性[18]。而且前萃率的变化规律和粒径的变化规律较为一致,也表明在表面活性剂和加水量恒定(即反胶束数目基本稳定)的状态下,粒径较大能为蛋白质的增溶提供相对较大的空间,提高萃取率。
2.4 KCl浓度对反胶束萃取的影响规律研究
KCl浓度对反胶束萃取大豆分离蛋白的前萃过程的影响如图4所示。
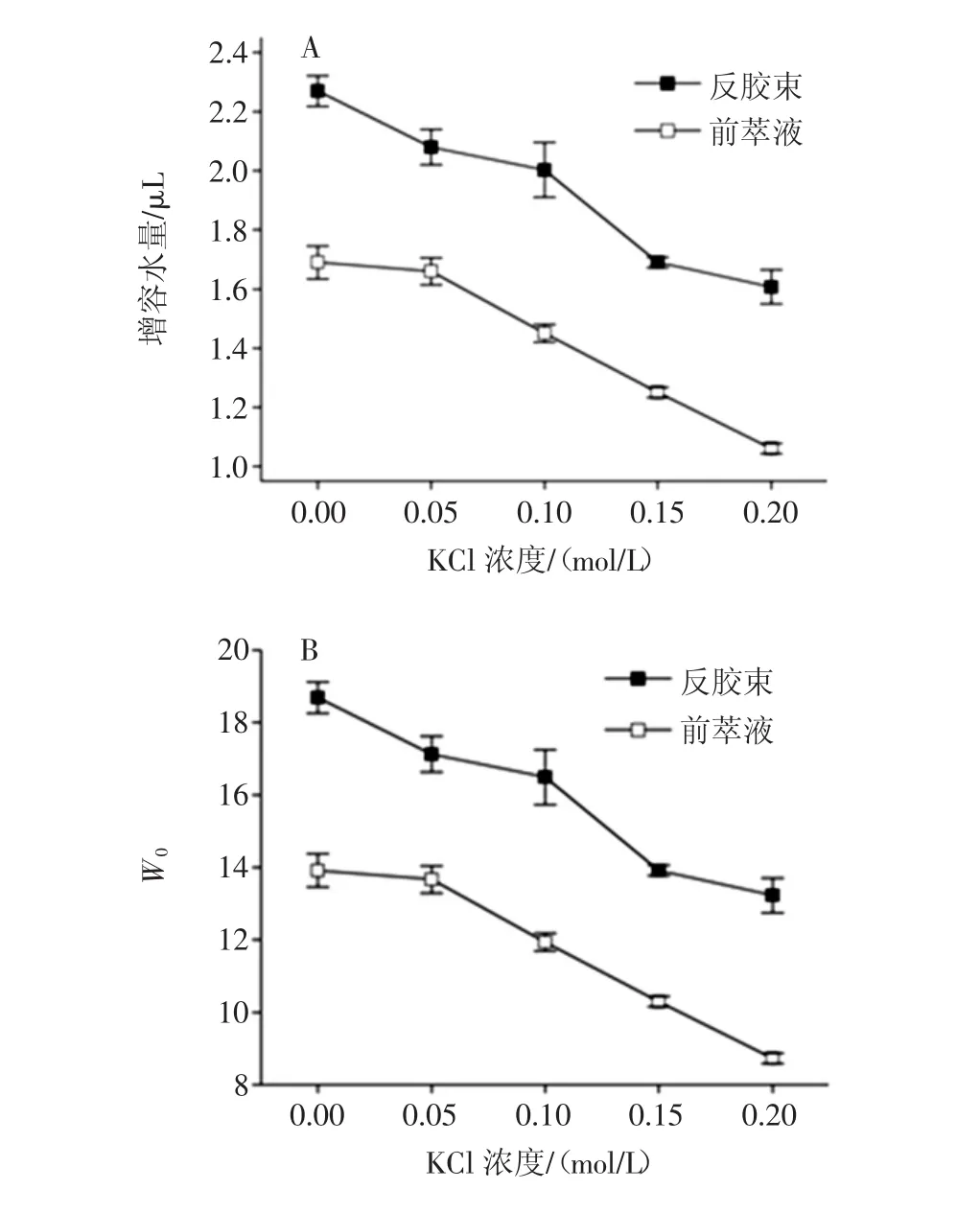

图4 KCl浓度对反胶束萃取大豆分离蛋白的影响Fig.4 The effect of KCl on the reverse micelle extraction of SPI
由图4可以看出来随着KCl浓度的增加,增溶水量和W0值均呈现逐渐下降的趋势。这表明盐离子浓度较大时,反胶束的水核结构较小,这很可能是因为盐离子浓度的增加导致水相的界面张力增加,进而阻碍了盐溶液的增溶。与此同时,蛋白质增溶后的胶束的增溶水量和W0也呈相应减小的趋势。由于水核的大小能很大程度上影响反胶束的尺寸及相关特性[19],因此,反胶束的平均粒径随着盐离子浓度的增加也应该是呈现逐渐较小的趋势,这和图4-(C)的反胶束平均粒径的变化规律是一致的。即盐离子浓度较小时,体系中反胶束的数目较多尺寸较小,而盐离子浓度增加后,反胶束的数目较少尺寸增大。这一反胶束溶液的尺寸变化规律另一方面是由于随着盐离子浓度的增加,胶束双电子层的厚度变薄,导致电位之间靠的更为接近从而形成足够的斥力来平衡反胶束形成的力,因此,整体粒径变化是逐渐减小的[20]。而对于前萃液,胶束的平均粒径的变化规律恰好相反,呈现逐渐上升的趋势,这可能是由于盐离子浓度较大时,反胶束数目多但水核尺寸较小,因此临近胶束之间相溶增加水核结构从而更好的实现蛋白质的增溶。
图4-(D)反映的是KCl浓度对反胶束体系萃取大豆分离蛋白的前萃率的影响规律。从图4-(D)中可以看出前萃率随着KCl浓度的增加呈现逐渐减小的趋势,一方面原因是如上所述,增溶水量的逐渐减小直接影响蛋白质的增溶过程,即便较大盐浓度时临近胶束相溶也并未增加增溶蛋白质的量;另一方面盐浓度的增加直接导致界面张力的增加,进一步阻碍蛋白质的增溶。因此,该现象进一步证明适当的静电引力作用才能促进前萃率的提高。
3 结论
研究表明,不同单因素均会对反胶束溶液的增溶水量、W0及胶束粒径产生影响。反胶束体系的微结构的变化会直接影响蛋白质的增溶过程造成前萃率的变化。而且研究再次证实蛋白增溶过程中,胶束之间会发生相互融合的现象以实现体系的稳定。
此外,整体来看,反胶束溶液的含水量均低于同条件下的前萃液的含水量,且前萃液的平均粒径整体显著高于反胶束溶液,这表明蛋白增溶进反胶束后,会与水核中的水分子发生相互作用,且导致胶束粒径有显著增加,可以推断反胶束加溶蛋白质的过程更为符合“水壳模型”。
[1]Zhao X,Zhu H,Chen J.Effects of sodium bis(2-ethylhexyl)sulfo succinate(AOT)reverse micelles on physicochemical properties of soy protein[J].Food and Bioproducts Processing,2015,94:500-506
[2]M Alejandra Luna.Properties of AOT reverse micelle interfaces with different polar solvents[J].Journal of Physical Organic Chemistry,2016,29(11):580-585
[3]Malik NA.Surfactant-Amino Acid and Surfactant-Surfactant Interactions in Aqueous Medium:a Review[J].Applied Biochemistry and Biotechnology,2015,176(8):2077-2106
[4]Silbera J J,Biasuttia A,Abuinb E,et al.Interactions of small molecules with reverse micelles[J].Advances in Colloid&Interface Science,1999,82(1/3):189-252
[5]Mohd-Setapar S H,Mohamad-Aziz S N,Harun N H,et al.Review on the Extraction of Biomolecules by Biosurfactant Reverse Micelles[J].APCBEE Procedia,2012,3(8):78-83
[6]Xin Ding.Cai J,Guo X.Effect of surfactant structure on reverse micellar extraction of ovalbumin[J].Process Biochemistry,2015,50(2):272-278
[7]Vasquez VR,Williams B C,Graeve O A.Stability and comparative analysis of AOT/water/isooctane reverse micelle system using dynamic light scattering and molecular dynamics[J].The journal of Physical Chemistry B,2011,115(12):2979-2987
[8]Bhattarai A,Wilczura-Wachnik H.Size and diffusion phenomena of AOT/alcohol/water system in the presence of morin by dynamic light scattering[J].International Journal of Pharmaceutics,2015,478(2):610-616
[9]布冠好,刘海远,陈复生,等.AOT/异辛烷反胶束体系特性及萃取大豆蛋白的研究[J].河南工业大学学报自然科学版,2012,33(6):7-12
[10]Aferni A E,Guettari M,Tajouri T.Determination of the Water/AOT/Isooctane Reverse Micelles Size Parameters from Their Refractive Index Data[J].Journal of Solution Chemistry,2017,46(1):89-102
[11]Sharma S,Yadav N,Chowdhury P K,et al.Controlling the Microstructure of Reverse Micelles and Their Templating Effect on Shaping Nanostructures[J].The Journal of Physical Chemistry B,2015,119(34):11295-11306
[12]Schmollngruber M,Braun D,Steinhauser O.A computational component analysis of dielectric relaxation and THz spectra of water/AOT reverse micelles with different water loading[J].The Journal of Chemical Physics,2016,145(21):214702
[13]Khoshnood A,Firoozabadi A.Polar Solvents Trigger Formation of Reverse Micelles[J].Langmuir:the Acs Journal of Surfaces and Colloids,2015,31(22):5982-5991
[14]蔡宝玉,许林妹,彭远宝.反胶束萃取大豆蛋白的研究[J].中国油脂,2004,29(6):37-39
[15]EskiciG,AxelsenPH.TheSizeofAOTReverseMicelles[J].The journal of physical chemistry B,2016,120(44):11337-11347
[16]王丽敏,陈复生,刘昆仑,等.不同条件下萃取花生蛋白前后AOT/异辛烷反胶束粒径与萃取率相互关系变化的研究[J].食品工业科技,2016,37(2):228-233
[17]Chen J,Chen F,Wang X,et al.The forward and backward transport processes in the AOT/hexane reversed micellar extraction of soybean protein[J].Journal of food science and technology,2014,51(10):2851-2856
[18]Zhao X,Li Y,He X,et al.Study of the factors affecting the extraction of soybean protein by reverse micelles[J].Molecular biology reports,2010,37(2):669-675
[19]Agazzi F M,Falcone R D,Silber J J,et al.Solvent blends can control cationic reversed micellar interdroplet interactions.The effect of nheptane:benzene mixture on BHDC reversed micellar interfacial properties:droplet sizes and micropolarity[J].The journal of physical chemistry B,2011,115(42):12076-12084
[20]Fathi H,Kelly J P,Vasquez V R,et al.Ionic Concentration Effects on Reverse Micelle Size and Stability:Implications for the Synthesis of Nanoparticles[J].Langmuir:the ACS journal of surfaces and colloids,2012,28(25):9267-9274
The Changes of Relationship between the Microstructure of Reverse Micelles and Their Extraction Rates
ZHANG Qian1,CHEN Fu-sheng1,*,SUN Qian2
(1.College of Food Science and Technology,Henan University of Technology,Zhengzhou 450001,Henan,China;2.Advanced Biotechnology and Application Research Center,School of Chemistry and Biological Engineering,University of Science and Technology Beijing,Beijing 100024,China)
The changes about the average size and the W0of the sodium bis(2-ethylhexyl)sulfo succinate(AOT)/isooctane reverse micelles during the forward extraction were studied under different conditions in this work.And the correlation between the microstructure of the reverse micelles and the forward extraction rate was discussed in conjunction with the trends of the forward extraction.
full-fat soybean powder;reverse micelle;microstructure;forward extraction rate
张倩,陈复生,孙倩.反胶束的微结构与前萃率相互关系的研究[J].食品研究与开发,2018,39(1):4-10
ZHANG Qian,CHEN Fusheng,SUN Qian.The Changes of Relationship between the Microstructure of Reverse Micelles and Their Extraction Rates[J].Food Research and Development,2018,39(1):4-10
10.3969/j.issn.1005-6521.2018.01.002
国家自然科学基金项目(21376064、21676073)
张倩(1992—),女(汉),在读硕士研究生,研究方向:蛋白质资源开发与利用。
*通信作者:陈复生(1963—),男(汉),教授,博士生导师,研究方向:食品资源开发与利用。
2017-06-06

