紫包菜花色苷提取工艺及其对DPPH·清除活性研究
(江苏经贸职业技术学院工程技术学院,江苏南京211168)
紫包菜花色苷提取工艺及其对DPPH·清除活性研究
石雪萍,郑萍
(江苏经贸职业技术学院工程技术学院,江苏南京211168)
以紫包菜为原料,采用乙醇水浴浸提法提取花色苷,通过单因素试验确定从紫包菜中提取花色苷的工艺参数的适宜范围,并进一步通过正交试验确定最佳提取工艺。紫包菜中花色苷的最佳工艺条件为:pH 1,提取温度 50℃,料液比1∶40(g/mL),提取时间2.5 h,乙醇浓度60%。在这种提取条件下,花色苷得率可达到4.530mg/g。对提取的花色苷进行DPPH·清除活性研究,结果表明,提取液花色苷含量越高,DPPH·的清除作用越大。
紫包菜;花色苷;提取;DPPH·
紫包菜又称紫甘蓝,是十字花科二年生植物,叶片紫红,叶面有蜡粉,叶球近圆形。营养丰富,尤其含有丰富的VC、VE和VB。作为彩色蔬菜,其中呈紫色的成分主要是花色苷,具有特定的药理药效功能,可广泛应用于食品、医药以及化妆品着色等领域,具有广泛的开发应用前景[1]。
近年来研究结果表明:颜色较深、较艳的蔬菜的营养价值较高。因此,作为彩色蔬菜,紫甘蓝的使用量增加,栽培面积亦逐步扩大[2]。花色苷是一类广泛存在于植物的根、茎、叶、花、果实等器官的细胞液中,从而使其呈现出红色、蓝色或紫色等颜色的天然的水溶性色素[3]。花色苷作为一种天然食用色素,安全、无毒、资源丰富,而且具有一定营养和药用价值。本试验研究紫包菜花色苷的最佳提取工艺和花色苷含量对DPPH·清除活性的影响,为紫包菜的进一步研究提供理论依据。
1 材料与方法
1.1 原材料及预处理
紫包菜:南京苏果超市购得。将紫包菜洗净切碎,放入烘箱中于46℃下烘干,用粉碎机粉碎后放入自封袋中,将粉末置于干燥阴凉处待用。
1.2 仪器与试剂
721分光光度计:上海精科实业有限公司;SHB-ⅢA循环水式多用真空泵:河南省泰康科教仪器厂。
无水乙醇、盐酸、冰乙酸、氯化钾、醋酸钠:均为分析纯。
1.3 试验方法
1.3.1 总花色苷含量(ACY)的测定
采用pH示差法测定样品中的花色苷含量[4]
吸取样品制备液 1mL(0.2 mol/L KCl∶0.2 mol/L HCl=25 ∶67,体积比)和 pH 4.5(0.2 mol/L NaAc·3H2O ∶0.2 mol/LHAc=1∶1,体积比)的缓冲液稀释至 10mL,混匀。以1mL溶剂加9mL相应缓冲液作空白,分别在510 nm和700 nm处测定吸光值。
花色苷含量按下式计算:

式中:DF为稀释倍数;V为提取液总体积,mL;MW=449.2,为矢车菊素-3-葡萄糖苷的相对分子质量;29 600为矢车菊素-3-葡萄糖苷的消光系数;m为试样的质量,g;1是光路的路径,cm;样品含量以mg/g(矢车菊素-3-葡萄糖苷当量)表示。
1.3.2 花色苷提取工艺优化
由于不同的试验条件下花色苷的得率不同,因此,本次试验分别从pH值、乙醇浓度、提取时间、提取温度、料液比5个方面进行单因素试验,以便找出花色苷得率最高的提取工艺。分析了各因素对紫包菜花色苷提取率的影响后,再对乙醇浓度、提取温度、料液比、提取时间进行综合评价,分别准确称取样品按紫包菜花色苷提取液的制备方法进行四因素三水平的正交试验[5]。
1.3.3 紫包菜花色苷对DPPH自由基抑制活性
1.3.3.1 溶液配制
DPPH溶液的配制:准确称取49.24mg的DPPH试剂,用95%乙醇溶解,定量转入250mL的容量瓶中,用95%乙醇定容,摇匀得到浓度为0.5 mmol/L的DPPH溶液待用。
VC溶液的配制:称取0.4 g的VC试剂,用蒸馏水溶解,定量转入1 000mL的容量瓶中,用蒸馏水定容,摇匀得到浓度为0.4mg/mL的VC溶液;再用蒸馏水稀释,分别得到浓度为 0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.10mg/mL 的 VC溶液。
样液的配制:经计算可知,验证试验所得提取液的浓度为0.10mg/mL,再用30%的乙醇液分别稀释至浓度0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09mg/mL。
1.3.3.2 步骤
各取2mL不同浓度的样液(或VC溶液)与2mL DPPH溶液及4mL 95%的乙醇溶液加入同一试管中,摇匀,在37℃下水浴30min,以95%乙醇溶液为参比,2mL的DPPH溶液+6mL 95%的乙醇溶液为空白,在517 nm测定其吸光度,按下面公式计算其清除率。

式中:Ao为2mL DPPH溶液+6mL 95%的乙醇溶液的吸光度;As为2mL DPPH溶液+2mL样液(或VC溶液)的吸光度。
2 结果与讨论
2.1 单因素试验结果
2.1.1 pH值对紫包菜花色苷提取率的影响
称取紫包菜5份,每份2 g于干燥的锥形瓶中。用70% 的乙醇和 HCl分别配制 pH 1、pH 2、pH 3、pH 4、pH 5的溶液,料液比为 1∶25(g/mL),放入 60℃ 水浴锅中浸提2h,抽滤得到滤液。吸取样液1mL,分别用pH 1.0和pH 4.5的缓冲液稀释至10mL,分别在510 nm和700 nm处测定吸光值[6],结果见图1。

图1 不同pH值下花色苷的提取得率Fig.1 Extraction yield of anthocyanin under different pH values
由图1可知,pH 1时紫包菜花色苷提取效率最高,花色苷提取液颜色为鲜艳红色。随着pH值的不断提高,花色苷提取率逐步降低。样液在pH 1.0缓冲溶液中的吸光值高于pH 4.5缓冲溶液中的吸光值。
2.1.2 温度对紫包菜花色苷提取率的影响
称取紫包菜5份,每份2 g于干燥的锥形瓶中。pH值为 1,乙醇浓度为 70%,料液比为 1 ∶25(g/mL),分别置于 40、50、60、70、80、90 ℃ 水浴锅中,浸提 2 h,抽滤得到滤液。吸取样液1mL,分别用pH 1.0和pH 4.5的缓冲液稀释至10mL,分别在510 nm和700 nm处测定吸光值,结果见图2。
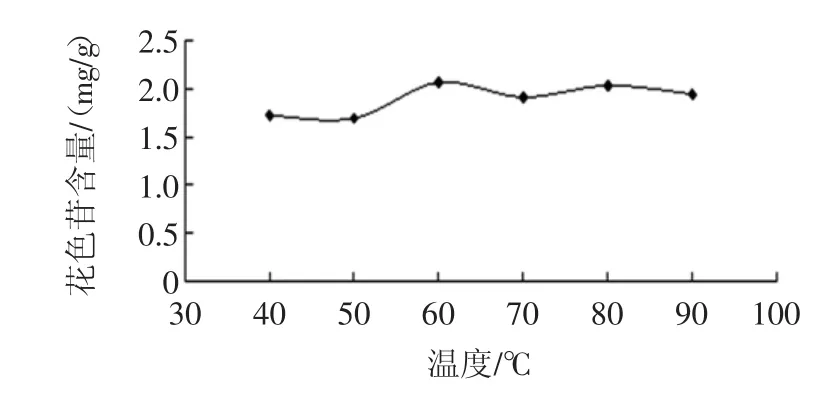
图2 不同温度下花色苷的提取得率Fig.2 Extraction yield of anthocyanin at different temperatures
由图2可知,样液在60℃左右时花色苷的提取率最高,不同温度条件下,其提取率有所不同,提取率呈曲线。
2.1.3 提取时间对紫包菜花色苷提取率的影响
称取紫包菜5份,每份2 g于干燥的锥形瓶中。pH值为 1,乙醇浓度为 70%,料液比为 1∶25(g/mL),置于 60 ℃ 水浴锅中分别浸提 0.5、1、1.5、2、2.5、3、3.5 h,抽滤得到滤液。吸取样液1mL,分别用pH 1.0和pH 4.5的缓冲液稀释至10mL,分别在510 nm和700 nm处测定吸光值,计算花色苷含量,结果见图3。
由图3可知,不同时间下花色苷的提取率变化趋势较为平缓,总体上呈缓慢上升的状态;相同条件下,浸提3.5 h提取率最高。
2.1.4 乙醇浓度对紫包菜花色苷提取率的影响

图3 不同时间下花色苷的提取得率Fig.3 Extraction yield of anthocyanin at different time
称取紫包菜5份,每份2 g于干燥的锥形瓶中。分别加入 40%、50%、60%、70%、80%、90%、100%的乙醇溶液50mL(料液比1∶25 g/mL),pH值为1,置于60℃水浴锅中浸提2 h,抽滤得到滤液。吸取样液1mL,分别用pH 1.0和pH 4.5的缓冲液稀释至10mL,分别在510 nm和700 nm处测定吸光值,计算花色苷含量,结果见图4。

图4 不同乙醇浓度下花色苷的提取率Fig.4 Extraction rate of anthocyanin under different ethanol concentration
由图4可知,乙醇浓度为60%时花色苷提取率最高,当浓度在80%以上时,提取率有明显的下降趋势,花色苷含量-乙醇浓度曲线有较为明显的波动;样液在波长510 nm处、pH 1.0缓冲溶液中的吸光值最高。
2.1.5 料液比对花色苷提取率的影响
称取紫包菜5份,每份2 g于干燥的锥形瓶中。分别加入 20、30、50、60、70、80mL 的乙醇溶液 (70%),pH值为1,置于60℃水浴锅中浸提2 h,抽滤得到滤液。吸取样液1mL,分别用pH 1.0和pH 4.5的缓冲液稀释至10mL,分别在510 nm和700 nm处测定吸光值,计算花色苷含量,结果见图5。
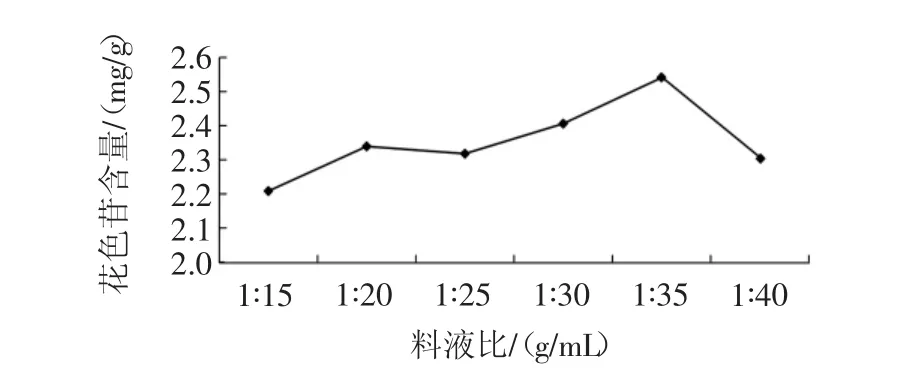
图5 不同料液比下花色苷的提取率Fig.5 Extraction rate of anthocyanin at different material liquid ratio
由图5可知,随着料液比的升高,花色苷的含量逐步提高,当料液比达到1∶35(g/mL)时花色苷的提取率最高,料液比继续升高,花色苷含量降低。
2.2 正交试验优化紫包菜花色苷提取条件
分析了各因素对紫包菜花色苷提取率的影响后,再对乙醇浓度、提取温度、料液比、提取时间进行综合评价,分别准确称取样品按紫包菜花色苷提取液的制备方法进行四因素三水平的正交试验[5],见表1,试验结果见表2。

表1 因素水平表Table 1 Factors and levels

表2 正交试验结果分析Table 2 Analysis of orthogonal test results
由表2可知,浸提液的料液比对花色苷提取的影响最大,其次是温度和时间,乙醇浓度对花色苷提取的影响最小,最佳提取工艺组合为A1B3C3D1,即乙醇浓度为60%,料液比为1∶40(g/mL),提取温度为50℃,提取时间为2.5 h。
按照此条件进行验证试验,结果得出,紫包菜花色苷含量可达到4.530mg/g,高于表2中任意一个组合,表明正交试验结果可行。
2.3 DPPH自由基清除试验结果
按照1.3.3.2试验步骤对所提取的紫包菜花色苷进行DPPH自由基清除作用试验,结果见图6。

图6 不同样液浓度下DPPH·的清除率Fig.6 Scavenging rate of DPPH·under the same liquid concentration
由图6可明显看出VC溶液的DPPH·清除率明显高于样品溶液。样品溶液在浓度低于0.04mg/mL,花色苷对DPPH·清除没有影响。浓度在高于0.04mg/mL时清除率开始上升,上升到0.09mg/mL时清除效果趋于平稳。VC和花色苷均对DPPH·的清除有影响。浓度越高清除越明显。当浓度达到0.1mg/mL时,花色苷和VC对自由基的清除率接近。
3 结论
文章利用pH示差法测定紫包菜中花色苷的含量,并对其提取工艺进行优化。试验结果表明,紫包菜中花色苷最佳提取条件为:pH值为1,提取温度50℃,料液比 1∶40(g/mL),提取时间 2.5 h,乙醇浓度 60%。在这种条件下,花色苷含量可达到4.530mg/g。DPPH自由基清除试验表明,紫包菜花色苷对DPPH自由基有较强的清除作用,并随着浓度的增加而增加。本试验表明紫包菜中的花色苷具有清除自由基的作用,为紫包菜中花色苷在不同领域的开发和研究提供了理论依据。
[1]尚宏丽,唐静,孟鑫.紫甘蓝花色苷提取及其稳定性研究[J].食品工业,2011(6):46-47
[2]王倩,汪云,宦卫青,等.紫甘蓝色素的提取及组分的研究[J].天然产物研究与开发,2010,22(6):1057-1060
[3]卢钰,董现义,杜景平,等.花色苷研究进展[J].山东农业大学学报(自然科学版),2004,35(2):315-320
[4]宋德群,孟宪军,王晨阳,等.蓝莓花色苷的pH示差法测定[J].沈阳农业大学学报,2013,43(2):231-233
[5]朱洪梅,赵锰.紫甘薯花色苷的组分及抗氧化活性研究[J].林产化学与工业,2009,29(1):39-45
[6]资名扬,王琴,温其标.紫甘薯花色苷光谱特性及抗氧化性的研究[J].现代食品科技,2009,25(11):1279-1281
Study on the Extraction and DPPH·Scavenging Activities of Anthocyanin from Purple Cabbage
SHI Xue-ping,ZHENG Ping
(School of Engineering and Technology of Jiangsu Vocational Institute of Commerce,Nanjing 211168,Jiangsu,China)
The purple cabbage as raw material,the anthocyanin was extracted by ethanol water extraction method.The appropriate range of process parameters of the extraction of anthocyanin from purple cabbage was determined through single factor test,and then the best extraction process was determined by orthogonal test.The results showed that the optimum conditions of anthocyanins extraction from purple cabbage was pH=1,extraction temperature 50℃,material liquid ratio 1∶40 (g/mL),extraction time 2.5 h,ethanol concentration 60%.Under these conditions,the anthocyanin content could be up to 4.530mg/g.The DPPH·scavenging activity was also studied to research the scavenging ability of anthocyanins in purple cabbage.The results showed that the higher the content of anthocyanin in the extract,the bigger the scavenging effect of DPPH·.
purple cabbage;anthocyanin;extract;DPPH·
石雪萍,郑萍.紫包菜花色苷提取工艺及其对DPPH·清除活性研究[J].食品研究与开发,2018,39(1):37-40
SHI Xueping,ZHENG Ping.Study on the Extraction and DPPH·Scavenging Activities of Anthocyanin from Purple Cabbage[J].Food Research and Development,2018,39(1):37-40
10.3969/j.issn.1005-6521.2018.01.008
石雪萍(1974—),女(汉),副研究员,博士,研究方向:功能成分研究与开发。
2016-07-27

