瓶内接种菌根真菌对毛棉杜鹃生长与抗性酶的影响
周玉洁,洪文君,黄久香,唐光大
(华南农业大学南方石灰岩植物研究中心,林学与风景园林学院,广东 广州 510642)
瓶内接种菌根真菌对毛棉杜鹃生长与抗性酶的影响
周玉洁,洪文君,黄久香*,唐光大
(华南农业大学南方石灰岩植物研究中心,林学与风景园林学院,广东 广州 510642)
【目的】研究毛棉杜鹃(Rhododendronmoulmainense)的接种效应,筛选较佳的菌种,为毛棉杜鹃高效育种提供参考,并初步揭示菌根提高植株抗性的机理。【方法】选用7种从野生毛棉杜鹃中分离并鉴定的杜鹃类真菌回接到毛棉杜鹃无菌组培苗中,定期观察生长情况,测定苗高与生物量增长率、菌根侵染率、病情指数、PAL酶与LOX酶活性。【结果】①对照组2周后枯萎,而接菌组均生长良好。②7号菌组苗高生长率与生物量增重率均为最高,分别为71.81 %与83.62 %,其次是17号与14号处理组。③16号的菌根侵染率最高,1号菌种最低。7号的病情指数最低,5号、3号病情指数最高。各接菌处理组的PAL酶和LOX酶活性均高于CK组,16号PAL酶、LOX酶活性最高,为4.82与0.88 U/mg,1号、5号、17号PAL酶活性最低,为1.90~2.20 U/mg,1号、3号LOX酶活性最低,为0.29~0.38 U/mg。相关性分析表明,侵染强度与PAL酶活性和LOX酶活性均有显著正相关,而病情指数与侵染强度、PAL酶活性和LOX酶活性均呈负相关。【结论】7种真菌均可与毛棉杜鹃无菌组培苗形成菌根共生体,但不同菌种对宿主植物的生长影响有差异, 7号(Bionectriaochroleuca)为最优的菌种,14号(Aspergillussydowii)与17号(Paecilomycesjavanicus)菌种为次优菌种。菌根侵染强度越大更加有益于PAL酶和LOX酶的产生,对植物的抗性与生长可能有一定程度的影响,但与真菌的种类有关。
毛棉杜鹃;杜鹃类真菌;菌根化育苗;生长效应;抗病性;抗逆性
【研究意义】杜鹃类菌根(ericoid mycorrhizas,简称为ERM),又被称为欧石楠类菌根。特指杜鹃花类植物上形成的菌根,属于一种特殊的内生菌根类型,对植株的生长产生影响,因此常被应用于菌根化育苗中[1]。几乎所有的杜鹃花科植物有明显的菌根结构,每种杜鹃花科植物的根系均寄生了多种菌种,不同菌种对植株的影响有所差异[2]。Vohnik M et al.[3]对Rhododendron‘Azurro’接种ERM菌种后发现不同菌种、菌种组合对营养吸收、根系生物量等有不同程度的影响,同一菌种的不同菌种的接种效应也有一定的差别。有些菌种对植株伤害较为严重,导致植株病害;而有些菌种对植株生长促进显著,或能够提高植株的抗性能力,表明了优良菌种筛选的重要性。【前人研究进展】为筛选出优良的菌种,通常先进行菌根分离,并运用形态与分子手段鉴定菌种种类[4-5];通过真菌回接实验探索各菌种的接种效应,从而筛选优良菌种[6-7]。欧静等[8]通过测定接种ERM 真菌对桃叶杜鹃幼苗体内的激素含量,表明IAA,GA,ZT,和ZR等激素是促进植株生长的重要原因。杜鹃花类植物多分布于较贫瘠的土壤,ERM对杜鹃植株的抗逆性与逆境环境的营养吸收具有重要的作用[9]。陈可等[10]证明西瓜接种菌根苗能够激活抗逆性有关的防御性酶,使根系对逆境产生快速反应,从而提高抗连作障碍的能力。【本研究切入点】目前针对菌根与杜鹃类植物抗逆性与抗病性的相关报道较少。毛棉杜鹃为杜鹃花科杜鹃属的常绿木本花卉,株形优雅,花繁茂而馨香,具有较高的园林应用价值,但由于野生毛棉杜鹃多分布于海拔700~1500 m的山谷[11],在低海拔地区生长易受到限制,高效菌种的筛选有益于毛棉杜鹃的工厂化育苗的实现。前期研究表明接种菌根有益于提高毛棉杜鹃的抗旱能力[12],而不同菌种的侵染与相关抗性酶活性的关系尚不清楚。【拟解决的关键问题】本研究以毛棉杜鹃组培苗为研究对象,探索菌根对毛棉杜鹃生长的影响,筛选出较佳的菌种,为毛棉杜鹃的高效育种提供参考;并进一步分析接种真菌后菌根结构对毛棉杜鹃抗逆性与抗病性相关酶的影响,以期初步揭示菌根化育苗提高植株抗性的机理。
1 材料与方法
1.1 试验材料
供试毛棉杜鹃为组织培养的无菌生根苗,苗龄为60 d。菌剂纯培养所采用的培养基为MMN培养基[13]。内生真菌菌种均从广东深圳梧桐山毛棉杜鹃野生植株须根中分离获得。经广东省微生物研究所的形态与分子测序鉴定,共有7个菌种(表1),均为子囊菌门,子囊菌类Hymenoscyphusericae(Read)Korf &Kernan是最早分离和鉴定的一类菌根真菌类型。很多杜鹃类植物都分离出这种内生菌,包括沙龙白珠树(Gaultheriashallon)[14]、澳石楠(Epacrisimpressa)[15]、Rhododendronobtusumvar.Kaempferi[16]等。
1.2 菌种的接种
将生长状态良好的组培苗转接于共生培养基中,每瓶接种4株苗,于室温条件培养15 d后,待接种。接种时,将5 mm×5 mm左右大小的菌块,置于装有生根苗的培养瓶中作为菌源,另将无菌剂的培养苗作为对照组。每个处理3个重复,每个重复15瓶,培养光照温度为25 ℃,光照培养强度2000 lx,光照时间为12 h/d。培养45 d后,检测其菌根侵染率、苗高增长率、生物量增重率、病情指数、苯丙氨酸解氨酶(PAL)和脂氧合酶(LOX)活性。
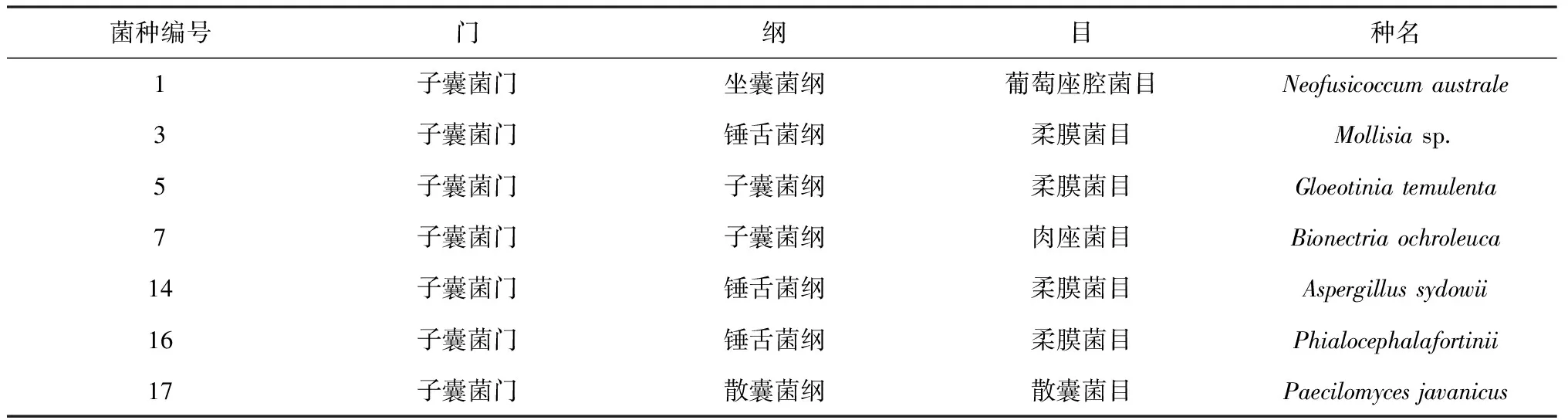
表1 菌种信息

表2 不同菌种对毛棉杜鹃组培苗生长形态比较
1.3 评价指标
苗高增长率( %)=接菌苗平均增高/接菌前幼苗平均高度×100 %
生物量增重率( %)=接菌苗平均增重/接菌前幼苗平均干重×100 %
菌根侵染率( %)=被侵染的根段数/镜检的总根段数×100 %
病情指数= 100×∑(各级病叶数×各级代表值)/(调查总叶数×最高级代表值)
1.4 数据统计分析方法
采用SPSS 19.0软件多重比较分析。
2 结果与分析
2.1 7种菌种对毛棉杜鹃幼苗形态特征的影响
从表2和图1可知,对照组幼苗在生长第8天后老叶开始变黄,第15天时多数幼苗全株枯萎,可能由于植株在无菌条件下无法独立在MMN培养基中进行营养吸收,导致植株呈现衰亡现象。其他接菌后的植株均表现正常,表明了接种菌种能够提高植株营养吸收能力。7种菌种对毛棉杜鹃幼苗反应模式主要呈现为3类:①对根系有促进作用,生长较多的须根,茎部健壮,叶片呈绿色,如7号、14号、17号菌种。②对根系有促进作用,生长较多的须根,茎部稍显细弱,老叶略显黄色,如3号、5号、16号菌种。③对根系促进不明显,茎部生长受到影响,叶片生长不良,如1号菌种。
2.2 7种菌种对毛棉杜鹃幼苗生长的影响
接菌45 d后,不同菌种组毛棉杜鹃组培苗的苗高增长率与生物量增重率存在差异(图2~3)。接种菌种7号的苗高增长率最大,为71.81 %,与其他处理组呈显著差异。其次是菌种17号、14号、3号处理组,苗高增长率为46.67 %~50.91 %。苗高增长率较低的为菌种5号、16号、1号与CK处理组,苗高增长率为32.00 %~35.75 %。其中1号处理组苗高增长率低于对照组,可能由于接种1号菌种后植株弯曲造成。不同菌种对毛棉杜鹃组培苗的生物量增重率也存在着差异。接种菌种后的生物量增重率均显著高于对照组,接种菌种7号的生物量增重率最大,为83.62 %。其他的接种菌种处理组增重率为69.27 %~75.24 %。对照组生物量增重率仅为55.26 %。

图1 不同菌种对毛棉杜鹃组培苗生长形态比较Fig.1 Comparative study on growth morphology of Rhododendron moulmainense after inoculated by different strains
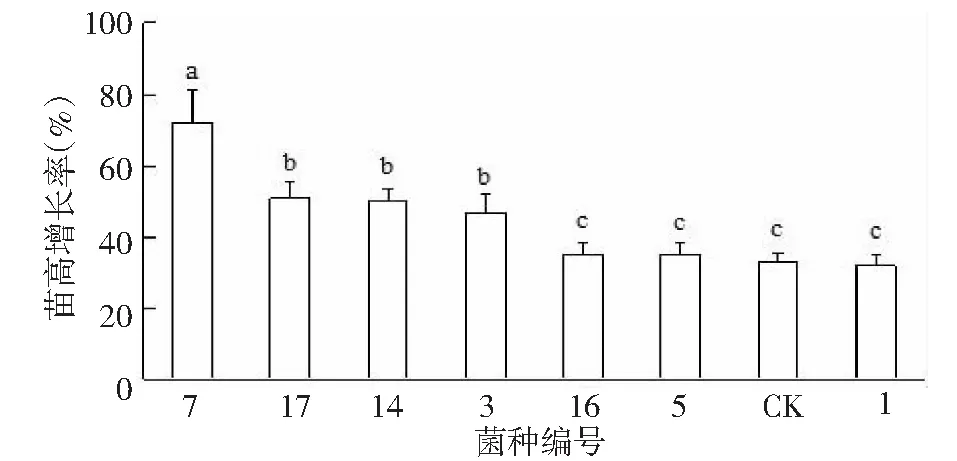
图2 接种7种菌种后毛棉杜鹃组培苗各处理组苗高增长率比较Fig.2 Comparative study on height growth rates of Rhododendron moulmainense after inoculated by different strains
2.3 7种菌种对毛棉杜鹃幼苗侵染特性与PAL和LOX酶活性的影响
所有菌种在MMN培养基上均能侵染毛棉杜鹃幼苗根系形成菌根,但不同菌种对毛棉杜鹃幼苗的侵染率存在显著差异(表3)。菌种16号的菌根侵染率最高,高达95.5 %,其次是菌种3、7、14号,侵染率为81.82 %~88.00 %,均显著高于其他菌种。1、5、17号侵染率最低,为60.00 %~70.00 %。病情指数是全面考虑发病率与严重度的综合指标,不同菌种对毛棉杜鹃幼苗产生一定伤害作用。菌种7号的病情指数最低,与其他处理组呈显著差异,其次是16、14、1、17号,病情指数介于37.50 %~47.50 %,接种菌种处理中病情指数较高的为5、3号,表明不同菌种对植株伤害作用各不相同,但各接菌处理组的病情指数均低于CK组,可能由于CK组缺乏营养而导致植物病态较为严重。苯丙氨酸解氨酶(PAL)是植物苯丙烷途径的关键酶和限速酶,与植物的抗逆境能力有着重要的关系。脂氧合酶(LOX)是植物合成愈创激素、愈创酸和茉莉酮酸等产物的限速酶,与植物的抗病性直接相关。试验结果表明,不同菌种对毛棉杜鹃幼苗PAL酶与LOX酶活性存在差异,各菌种的PAL酶和LOX酶活性均高于CK组(表3),表明菌根侵染诱导了PAL酶和LOX酶的产生。菌种侵染组中,16号PAL酶活性最高,为4.82 U/mg,其次是3、7、14号,为3.32~3.97 U/mg,PAL酶活性最低的为1、5、17号,为1.90~2.20 U/mg,16号LOX酶活性最高,为0.88 U/mg,其次是5、7、14、17号,为0.53~0.61 U/mg,LOX酶活性最低的为1、3号,为0.29~0.38 U/mg。从相关性分析看(表4),侵染强度与PAL酶活性和LOX酶活性均有较为显著的正相关性,而病情指数与侵染强度、PAL酶活性和LOX酶活性均呈显著负相关关系,表明了侵染的越强,对PAL酶与LOX酶活性生成起到促进作用,PAL酶与LOX酶活性升高,可能会一定程度上减少植株的病情指数,但并不是PAL酶与LOX酶活性越高,病情指数就越高,因此病情指数与真菌种类也有一定关系。

图3 接种7种菌种后毛棉杜鹃组培苗各处理组生物量增重率比较Fig.3 Comparative study on biomass growth rate of Rhododendron moulmainense after inoculated by different strains
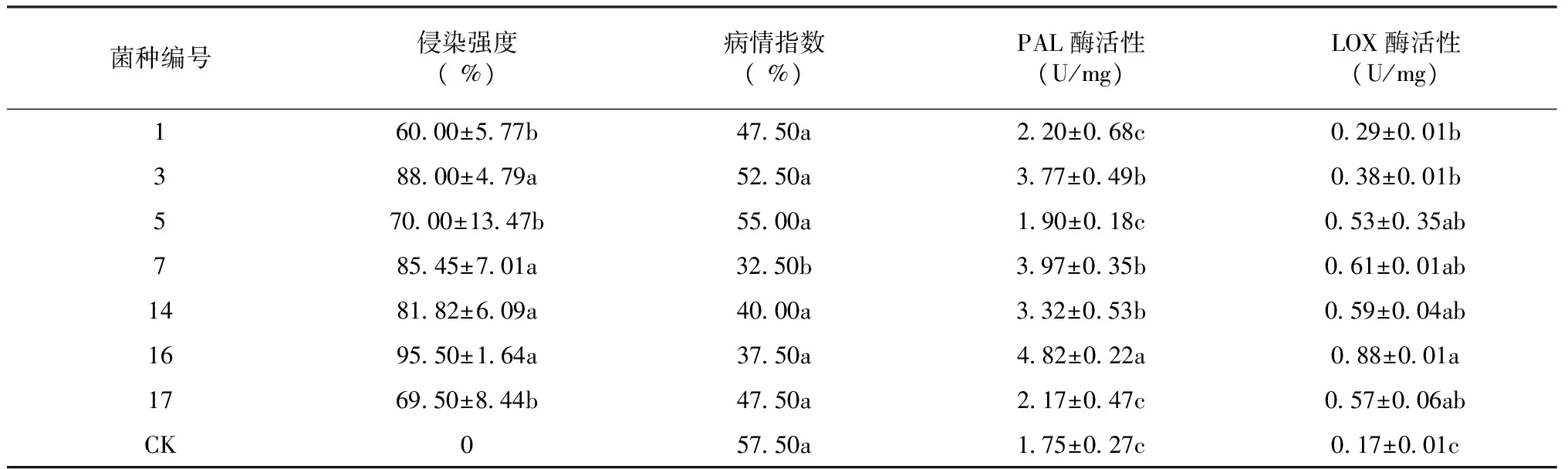
表3 不同菌种对毛棉杜鹃组培苗侵染特性与PAL和LOX酶活性的比较

表4 不同菌种对毛棉杜鹃幼苗侵染特性指标相关性分析
注:* 在置信度(双测)为 0.05 时,相关性是显著的。
3 讨 论
3.1 不同菌种对毛棉杜鹃生长的影响
近年来组培技术得到推广应用,但兰科、杜鹃花类等菌根类植物组培苗在无菌条件下繁殖,缺少菌根真菌侵染导致生长缓慢且质地细弱,移栽到田间后对自然环境适应力差,虽然在自然界中虽然能感染菌根真菌,但延长了缓苗期,且增加了死亡率[17]。因此,本研究在已有的组培技术上进行了瓶内接菌实验,以提高后期出苗成活率。试验结果表明,7个菌种对植株生长影响各有差异,Bionectriaochroleuca(7号)、Aspergillussydowii(14号)和Paecilomycesjavanicus(17号)菌种对毛棉杜鹃幼苗促生作用较好,可作为毛棉杜鹃组培苗的高效菌种。菌根结构有助于提高植株营养吸收能力,使植株能在逆境中生长。本研究结果表明,未接菌的对照组在不适宜生长的MMN培养基上无法正常生长,而接菌组均能生长良好。可能由于MMN培养基成分中的营养成分难以被植株直接吸收应用,接种菌根有益于难分解的营养成分被植株吸收应用[18],不同菌根对营养元素的利用率不同,有些杜鹃类菌根对无机氮的吸收率高,而有些对有机氮吸收率高[19],且不同菌种对营养成分的吸收不同[20],因此本研究中各植株呈现不同的生长情况。
3.2 不同菌种对毛棉杜鹃抗性影响
菌根结构能够提高植物的抗性酶活,从而提高植物的抗性能力[21]。研究[22-23]表明病虫感染,机械损伤等胁迫均能使植株的相关抗性酶增加[24]。本研究中菌根侵染与植物的抗病性与抗逆性酶活性具有显著的相关性,与梁军等[25]以杨树为研究材料接种菌根后菌根侵染率与抗性酶活性的变化性相似。由此推测菌根侵染过程中真菌对根系的机械损伤可能会使植株的抗性酶增加。杜鹃科植物中,黄酮类的积累是植株叶片呈现红色的重要次生物质[26],而苯丙氨酸正是调控黄酮类化合物的重要酶[27],因此本研究中PAL酶活性较高的7号与16号菌种处理组植株茎或叶出现明显的红色。不同菌种对植株的抗病性影响有所差异,虽与菌根侵染植株后植株产生的脂氧合酶有一定的关系,脂氧合酶在菌根真菌的影响下能够提高植株的抗病力[28-29],但真菌本身对植株的抗病能力影响较大。本研究中接种Bionectriaochroleuca菌组病情指数最低,此前在多种植物中均分离出此种菌种,此种菌所产生的抗生素类物质可以对某些病原菌起特异性拮抗作用,因此对枯萎病、赤霉病等有防御作用[30-31],因此,虽然7号菌处理组LOX酶活性低于16号,但却表现出较低的病情指数。
4 结 论
结果证实7个从毛棉杜鹃野生植物中分离的菌种均可与毛棉杜鹃形成菌根共生体,但不同菌种与宿主植物的亲和力存在显著差异,反映了不同的菌根真菌对毛棉杜鹃植物生长的有益性存在差异及高效菌种筛选的必要性。本次试验菌种中7号(Bionectriaochroleuca)为最优的菌种,14号(Aspergillussydowii)与17号(Paecilomycesjavanicus)菌种为次优菌种。菌根侵染有益于PAL酶和LOX酶的产生,对植物的抗性与生长可能有一定程度的影响,但与真菌的种类有关。
[1]Read D J. The structure and function of the ericoid mycorrhizal root[J]. Annals of Botany, 1996, 77(4): 365-374.
[2]Jansa J, Vosatka M. In vitro and post vitro inoculation of micropropagated Rhododendrons with ericoid mycorrhizal fungi[J]. Applied Soil Ecology, 2000, 15(2): 125-136.
[3]Vohnik M, Albrechtova J, Vosatka M. The inoculation with Oidiodendron maius and Phialocephala fortinii alters phosphorus and nitrogen uptake, foliar C: N ratio and root biomass distribution in Rhododendron cv. Azurro[J]. Symbiosis, 2005, 40(2): 87-96.
[4]Allen T R, Millar T, Berch S M, et al. Culturing and direct DNA extraction find different fungi from the same ericoid mycorrhizal roots[J]. New Phytologist, 2003, 160(1): 255-272.
[5]Persoh D. Plant-associated fungal communities in the light of meta'omics[J]. Fungal Diversity, 2015, 75(1): 1-25.
[6]欧 静, 韦小丽, 何跃军, 等. 接种ERM真菌对桃叶杜鹃幼苗的促生效应及生理生化影响[J]. 林业科学, 2013(7): 48-56.
[7]Starrett M C, Blazich F A, Shafer S R, et al. In vitro colonization of micropropagated Pieris floribunda by ericoid mycorrhizae. II. Effects on acclimatization and growth[J]. Hortscience, 2001, 36(2): 357-359.
[8]欧 静, 韦小丽, 何跃军, 等. 接种ERM真菌对桃叶杜鹃幼苗的促生效应及生理生化影响[J]. 林业科学, 2013(7): 48-56.
[9]Kosola K R, Workmaster B A, Spada P A. Inoculation of cranberry(Vaccinium macrocarpon) with the ericoid mycorrhizal fungus Rhizoscyphus ericae increases nitrate influx[J]. New Phytol, 2007, 176( 1):184-196.
[10]陈 可, 孙吉庆, 刘润进, 等. 丛枝菌根真菌对西瓜嫁接苗生长和根系防御性酶活性的影响[J]. 应用生态学报, 2013(1): 135-141.
[11]吴 志, 刘 念, 王定跃, 等. 深圳市小梧桐毛棉杜鹃种群现状分析[J]. 林业资源管理, 2009(5): 96-72.
[12]洪文君, 王 盼, 刘 强, 等. 毛棉杜鹃接菌苗对干旱胁迫的生理响应研究[J]. 西南农业学报, 2016(4): 805-809.
[13]宋慧娟, 赵富群, 洪文君, 等. 杜鹃花属植物内生真菌对毛棉杜鹃幼苗生长的影响[J]. 广东林业科技, 2015(4): 47-51.
[14]Xiao G, Berch S M. The ability of known ericoid mycorrhizal fungi to form mycorrhizae with Gaultheria shallon[J]. Mycologia, 1995, 87(4): 467-470.
[15]Mclean C, Lawrie A C, Blaze K L. The effect of soil microflora on the survival of cuttings of Epacris impressa[J]. Plant and Soil, 1994, 166(2): 295-297.
[16]Usuki F, Abe J P, Kakishima M. Diversity of ericoid mycorrhizal fungi isolated from hair roots ofRhododendronobtusumvar.kaempferiin a Japanese red pine forest[J]. Mycoscience, 2003, 44(2): 97-102.
[17]王真辉. 菌根真菌在植物组培苗生产技术中的应用[J]. 热带农业科学, 2001(5): 71-78.
[18]Kerley S J, Read D J. The biology of mycorrhiza in the Ericaceae. XVIII. Chitin degradation by Hymenoscyphus ericae and transfer of chitin-nitrogen to the host plant[J]. New Phytologist, 1995, 131(3): 369-375.
[19]尹丽娟,张春英,杨 兵. 云锦杜鹃菌根真菌吸收氮源特性及其接种效应[J]. 中国农业科学, 2010(4): 868-872.
[20]Talbot J M, Treseder K K. Controls over mycorrhizal uptake of organic nitrogen[J]. Pedobiologia, 2010, 53(3): 169-179.
[21]赵 忠, 王真辉. 菌根真菌与根际微生物间的关系及其对宿主植物的影响[J]. 西北林学院学报, 2001(1): 70-75.
[22]张 丽, 常金华, 罗耀武. 不同高粱基因型感蚜虫前后POD、PPO、PAL酶活性变化分析[J]. 中国农学通报, 2005(7): 40-42.
[23]王 祎, 张月玲, 苏建伟, 等. 施钾提高蚜害诱导的小麦茉莉酸含量和叶片相关防御酶活性[J]. 生态学报, 2014(10): 2539-2547.
[24]吴 琼, 方吴云, 王文杰. 机械损伤对茶树苯丙氨酸解氨酶活性及茶多酚含量的影响[J]. 安徽农业科学, 2016(5): 11-14.
[25]梁 军, 张 颖, 贾秀贞,等. 外生菌根菌对杨树生长及抗逆性指标的效应[J]. 南京林业大学学报(自然科学版), 2003(4): 39-43.
[26]张 梅. 杜鹃黄酮类化合物活性成分的动态变化及诱导子对其含量和相关酶活性影响的研究[D]. 福建农林大学, 2012.
[27]张宽朝, 金 青, 蔡永萍, 等. 苯丙氨酸解氨酶与其在重要次生代谢产物调控中的作用研究进展[J]. 中国农学通报, 2008(12): 59-62.
[28]Christensen S A, Nemchenko A, Borrego E, et al. The maize lipoxygenase, ZmLOX10, mediates green leaf volatile, jasmonate and herbivore-induced plant volatile production for defense against insect attack[J]. The Plant Journal, 2013, 74(1):59-73.
[29]Bruinsma M, van Broekhoven S, Poelman E H, et al. Inhibition of lipoxygenase affects induction of both direct and indirect plant defences against herbivorous insects[J].Oecologia, 2010, 162(2): 393-404.
[30]陈 秀, 李景富, 张丽莉, 等. 一株淡色生赤壳菌的生防作用分析及系统发育树构建[J]. 生物技术通报, 2014(5): 184-189.
[31]宋福强, 王占斌, 王倡宪, 等. 引进菌种Bionectria ochroleuca对几种植物病原真菌的拮抗效应[J]. 中国农学通报, 2014(18): 166-170.
ImpactofInoculationwithMycorrhizalFungiinvitroonGrowthandResistantEnzymesofRhododendronmoulmainense
ZHOU Yu-jie, HONG Wen-jun, HUANG Jiu-xiang, TANG Guang-da
(South China Limestone Plants Research Center, College of Forestry and Landscape Architecture, South China Agricultural University, Guangdong Guangzhou 510642, China)
【Objective】The study ofRhododendronmoulmainenseinoculation with mycorrhizal fungi was conducted to select the better strains, and to provide the reference for improving breeding efficiency, also to reveal the mechanism of improving plant resistance by mycorrhizal fungi. 【Method】7 kinds ericoid mycorrhizal fungis, separated from wildRhododendronmoulmainense, were used to inoculateRhododendronmoulmainensetissue culture seedling. Growth situation was observed regularly, and height growth rate, biomass growth rate, mycorrhizal infection rate, disease index, PAL and LOX activity were determined.【Result】(i) Plants of control group were wizened after 2 weeks, but plants of mycorrhizal inoculation treatment were viable.(ii) Height growth rates and biomass growth rates of No.7 treatment were the highest, 71.81 % and 83.62 % respectively, No.17 and No.14 treatment fllowed. Mycorrhizal infection rates of No.16 treatment were the highest, No.1 treatment were the lowest. Disease indexes of No.7 were the lowest, No.5 and No.3 were the highest. PAL and LOX activity of each mycorrhizal inoculation treatment all higher than control group. PAL and LOX activity of No.16 treatment were the highest, 4.82 and 0.88 U/mg respectively, PAL activity of No.1, No.5, No.17 were the lowest, 1.90-2.20 U/mg, LOX activity of No.1, No.3 were the lowest, 0.29-0.38 U/mg. The correlation analysis showed that, colonization intensity were positively correlated with PAL and LOX activity significantly, but disease index were negatively correlated with PAL and LOX activity. 【Conclusion】Each of the 7 kinds ericoid mycorrhizal fungi could form mycorrhizal symbionts withRhododendronmoulmainense, but different fungis had different impact on growth of host plants, the result showed that, No.7(Bionectriaochroleuca) was the optimal fungi, No.14(Aspergillussydowii)and No.17(Paecilomycesjavanicus) were the second choices. Higher mycorrhizal infection rate helped to improve PAL and LOX activity. It may have an impact on resistant and growth of plants, but resistant and growth of plants were more impacted by species of fungi.
Rhododendronmoulmainense; Ericoid mycorrhizal fungi; Seedling of mycorrhizal fungi; Growth effect; Disease resistance; Stress resistance
1001-4829(2017)12-2687-06
10.16213/j.cnki.scjas.2017.12.012
2017-02-17
广州市科技计划项目(11C12100776/L1110887)
周玉洁(1992-),女,重庆人,硕士研究生,主要从事园林植物运用研究;*为通讯作者:黄久香(1975-),女,副教授,E-mail:137877360@qq.com。
S685.21
A
(责任编辑李 洁)

