生石灰对酸性土壤pH值及微生物群落功能多样性的影响
淡俊豪,齐绍武,2*,黎 娟,靳辉勇,朱 益,梁仲哲
(1.湖南农业大学农学院,湖南 长沙 410128;2.湖南杂交水稻研究中心,湖南 长沙 410128;3.江苏省宿迁市宿豫区农业委员会,江苏 宿迁 223800;4.广东中烟工业有限责任公司,广东 广州 510000)
生石灰对酸性土壤pH值及微生物群落功能多样性的影响
淡俊豪1,齐绍武1,2*,黎 娟1,靳辉勇3,朱 益4,梁仲哲1
(1.湖南农业大学农学院,湖南 长沙 410128;2.湖南杂交水稻研究中心,湖南 长沙 410128;3.江苏省宿迁市宿豫区农业委员会,江苏 宿迁 223800;4.广东中烟工业有限责任公司,广东 广州 510000)
【目的】通过盆栽试验探讨了在施加不同水平的生石灰时,酸性土壤pH值及微生物群落功能多样性的变化量。【方法】本实验采用Biolog-ECO检测法,探究了在4种不同生石灰施用量CK、T1、T2、T3(0、1125、2250、3375 kg/hm2)下酸性土壤微生物群落碳源代谢的多样性变化。【结果】①在240 h的培养期内,施加不同量生石灰条件下微生物群落单孔平均颜色变化率AWCD值从高到低依次是T2>T1>T3>CK。②土壤pH值与AWCD值相关分析表明,两者呈中度正相关。③土壤微生物群落功能多样性指数结果显示,T1、T2、T3处理的Simpson指数显著高于CK处理,而Shannon指数与McIntosh指数在各处理之间的差异不显著。④主成分分析结果表明,T3、CK处理土壤微生物碳源利用方式相似,而T1、T2处理有不同的碳源利用方式。【结论】由此可见,每公顷施加2250 kg的生石灰(T2处理)能提高土壤pH值、土壤AWCD值、物种优势度指数与微生物群落碳源利用能力,对微生物多样性的提高有较大的促进作用。
Biolog-ECO;pH;石灰施用量;酸性土壤;微生物群落功能多样性
【研究意义】生态系统中,土壤微生物担任着举足轻重的角色,其多样性影响着全球生物多样性,是生态系统中的重要的组成部分[1]。土壤微生物用各种不同的形式影响并改变着土壤的物理、化学和生物学特性,它参与了土壤有机质转化、腐质化、养分释放与固定、土壤结构保持和污染物降解等过程,且在土壤生态系统的物质循环和能量流动及土壤可持续生产力中占重要地位[2-3]。土壤微生物群落组成及活性高低是衡量土壤肥力大小和土壤质量高低的一个关键性指标,它是由大量微生物种群构成的群落系统,土壤微生物群落的多样性和结构对外界环境条件的变化非常灵敏,能反映环境变化和生态功能[4-6]。在酸性土壤中施用生石灰可提高土壤pH值,改善酸性土壤,影响土壤微生物的数量、分布和组成[7]。不同生石灰的施用量对酸性土壤pH值的提高效果不同,且对土壤微生物代谢活性也有不同的影响[8]。【前人研究进展】熊德中等人在福建研究表明[9],生石灰适宜添加量为1350 kg/hm2,但在湖南地区研究较少,特别是对生石灰对微生物功能多样性的影响,本实验生石灰的施用量根据湖南地区具体情况和参照前人的研究而定[10]。因此探究施加不同量的生石灰对酸性土壤pH值及微生物群落功能多样性的影响,对改良酸性土壤具有重要意义。目前多采用Biolog-ECO微平板法测定各板孔的吸光值来反映微生物功能多样性,它是通过微生物对多种碳底物的不同利用类型来方便、快捷的测定微生物群落功能多样。Biolog法是微生物在对不同碳源的选择性利用的过程中产生自由电子,使四唑染料发生还原显色反应[11],形成了不同的代谢指纹,其单孔颜色变化率(AWCD)反映了微生物群落代谢活性和碳源利用能力[11-12]。【本研究切入点】本试验以湖南省长沙市湖南农业大学耘园试验田为材料,通过盆栽实验,利用Biolog微平板分析法研究施加不同水平的生石灰对土壤微生物群落多样性的影响。【拟解决的关键问题】可以为合理施用生石灰、改善酸性土壤提供参考。
1 材料与方法
1.1 供试土壤
供试土壤为湖南省长沙市湖南农业大学耘园试验用地,土壤类型为红壤土,土壤pH值为5.4,为酸性土壤,土壤肥力中等,供试土壤基本理化性质见表1。
1.2 试验设计
由表2可知,盆栽试验采取直径为26 cm、高为30 cm的塑料盆,每盆装15 kg已加入不同水平生石灰的酸性土壤。试验设计4个处理,每个处理设置3个重复,每个重复(盆)5盆,每盆种植1株烟草,无不种植烟草对照。将试验地划分为4个区组,每个区组内有4个小区,按照随机的原则随机排列每个小区内的处理。小区面积为100 m2(10 m×10 m),区组间设置50 cm的间隔,小区间间隔20 cm。田间管理按大田常规操作进行。
1.3 土样采集
在种植烟叶90 d后对土壤进行采样,供试土壤按照“S”型取样法选取6个点,对每个盆进行取样,根据“等量”、“随机”、“多点混合”的原则进行采取,采样深度为0~15 cm。土壤采集后,去除根系及土壤入侵物,将其混匀后过2 mm的筛,将1 kg土样装入无菌封口袋,将其分为两份,放入冰盒中带回实验室。根据测试目的不同,1份置于室内自然风干,研磨后过0.25和1.00 mm筛,用于土壤理化性质的测定;1份放入-20 ℃冰箱保存,第2天即用于土壤微生物多样性的多样性分析。
1.4 测定方法
1.4.1 供试土壤理化性质测定 土壤速效磷采用碳酸氢钠法测定;土壤有机质的测定采用重铬酸钾容量法;土壤速效钾用1 mol/L醋酸铵提取,火焰光度计法测定;土壤碱解氮的测定采用康维皿扩散法测定;土壤的pH值采用去离子水提取,电位法测定[12]。
1.4.2 土壤微生物群落功能多样性的测定 采用Biolog标准方法测定微生物群落功能多样性。本试验使用的Biolog-ECO测试板共有96个孔,测试板的第一孔是不添加任何碳源的对照,其余的孔都含有不同的单一碳源。具体操作是:①称取10 g鲜土到150 mL灭菌的三角瓶中,再向瓶中加入90 mL灭菌生理盐水;②将三角瓶用封口膜封口,放入旋涡震荡机上,以250 r/min转速震荡30 min,静置20 min;③吸取上清液5 mL于高压灭菌的新三角瓶中,再加入45 mL无菌生理盐水稀释至10-2,重复稀释至10-3;④取150 μl 10-3倍稀释液加入到Biolog-Eco微平板中;⑤在28 ℃下黑暗培养,分别在0、24、48、96、120、144、168、192、216、240 h在590 nm读取数据。

表1 供试土壤的基本性质
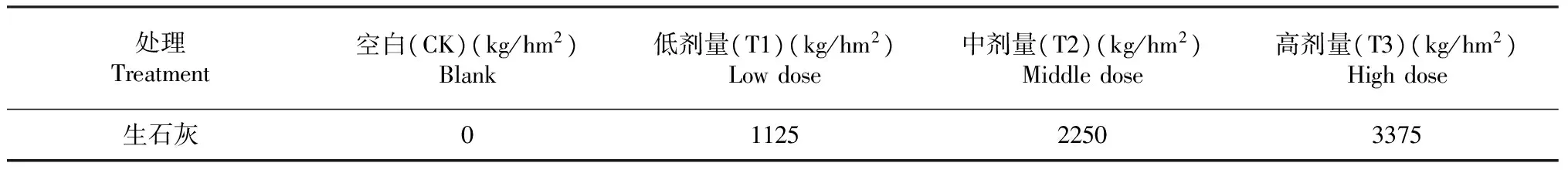
表2 供试生石灰施用水平
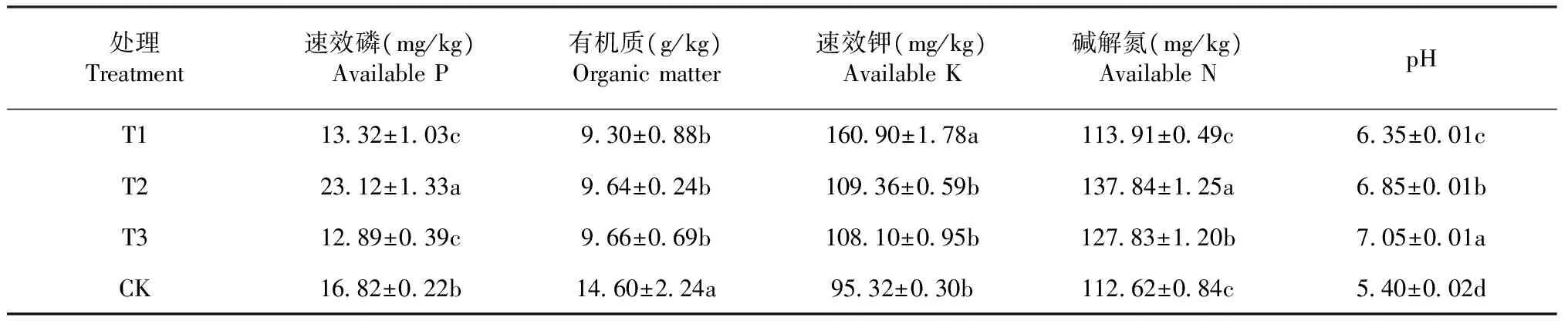
表3 不同水平的生石灰土壤理化性质
注:同列数字中不同字母表示差异达到显著水平(P<0.05)。下同。
Note: Means followed by different letters indicate significant differences at 0.05 level. The same as below.
1.5 数据处理
Biolog-ECO微平板中多底物酶联(ELISA)反应计算每孔平均颜色变化率(average well color development AWCD):AWCD=∑(C-R)/31
Shannon 丰富度指数:H=-∑PilnPi
式中,C为每个有单一碳源的吸光值;R为无碳源的对照孔的吸光值;Pi为第i个孔与所有反应孔的相对吸光值总和的比值;ni为第i个孔的相对吸光值;N为整个平板相对吸光值的总和;D为1/Simpson指数[13]。
试验数据采用Excel表进行初步运算,用SPSS 16.0进行方差分析、主成分分析及相关分析。
2 结果与分析
2.1 不同施加条件下土壤理化性质的变化
由表3可知,处理T3的最低,含量为12.89 mg/kg;处理T2的速效磷的含量最高,速效磷含量为23.12 mg/kg,相比处理T3提高了79.36 %,相比对照CK提高了37.44 %处理T2的土壤速效磷含量与处理T1、T3和对照CK差异显著,且处理T1与处理T3差异不显著。有机质含量CK处理最高,为14.60 g/kg;T2处理最低,其值为9.64 g/kg,且处理CK有机质含量相对处理T2提高了51.45 %。处理T1、T2、T3之间有机质含量差异不显著,而各处理与处理CK差异显著。速效钾含量从高到低排序是:T1>T2,T3,CK,处理T1速效钾含量最高为160.90 mg/kg;对照CK最低,其含量为95.32 mg/kg,且处理T1相比CK提高了68.79 %。从方差分析来看,处理T1的速效钾含量与处理T2、T3、CK的差异显著,而处理T2、T3、CK间的差异不显著。土壤中碱解氮含量T2处理最高,其值为137.84 mg/kg;处理CK的碱解氮含量最低,为112.62 mg/kg,较处理T2减少了22.39 %。方差分析显示,T2处理的碱解氮含量较对照CK的差异显著,处理T3与处理T1的差异显著,而处理T1与处理CK的差异不显著。T3处理的土壤pH值最高,其pH值为7.05;对照CK的PH值最低,其值为5.91,施加不同量的生石灰的土壤pH值从大到小依次是:T3>T2>T1>CK。方差分析表明,处理T1、T2、T3间的土壤pH值差异显著,且各处理的土壤pH值与对照CK的差异显著。
2.2 添加不同量的生石灰对土壤微生物群落AWCD值的影响
平均颜色变化率(AWCD)是体现土壤微生物群落代谢活性和对单一碳源的利用能力的一个关键性指标。土样开始培养后每隔1 d 测定 ECO微板孔的AWCD值,共计10 d。添加不同生石灰量,随培养时间的增加AWCD值变化如图1。AWCD值随培养时间增加,整体呈现上升趋势,在培养24 h内各处理的AWCD值均无明显变化,说明此时微生物几乎没有代谢碳源;在24~96 h内AWCD值快速增长,表明微生物在此刻进入指数生长期;96~240 h,AWCD值增加速度减慢,逐渐趋于平稳。不同施加水平下的AWCD值增长速率不同,表明不同处理间土壤微生物代谢活性与利用碳源能力有较大的差异。不同生石灰的量土壤微生物AWCD值从大到小依次为T2>T1>T3>CK。处理T1、T2、T3的AWCD值相对于CK都有较大提高,说明在土壤中施加生石灰可以提高土壤微生物代谢活性;其中处理T2的AWCD值高于其他处理,说明处理T2的土壤微生物群落代谢活性最快,碳源利用强度最高。
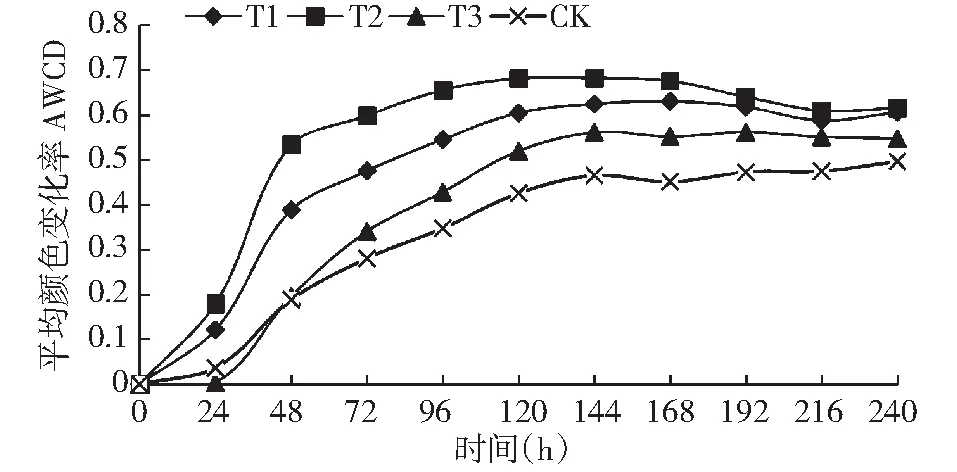
图1 土壤微生物群落AWCD值随培养时间的变化Fig.1 Change of AWCD of soil microbial community with culture time

回归方程Regressionequation相关系数CorrelationcoefficientAWCD0131x-03590506
2.3 添加生石灰后土壤pH值与AWCD值的相关性分析
土壤pH值是影响土壤微生物群落活性的重要因子[14],并对土壤养分有较大的影响。在酸性土壤中添加生石灰后,对土壤pH值与土壤微生物群落AWCD值进行相关性分析。由表4可知,土壤pH值与土壤微生物群落AWCD值正相关,且相关系数为0.506,为中度正相关。
说明施用生石灰后随着土壤pH值的增加,土壤中微生物群落的代谢活性也相应的增加。
2.4 不同生石灰的施加量对土壤微生物群落功能多样性的影响
土壤微生物分布规律对土壤生态环境改变起重要作用,其中土壤微生物数量和区系分布对土壤生态环境的影响最为关键。土壤微生物多样性是衡量土壤质量高低的关键指标[15]。土壤微生物群落的功能多样性可用多样性指数进行分析,多样性指数体现了土壤微生物群落多样性的各个方面。
Shannon指数是用于评价群落物种及个体数和分布均匀程度,主要反映了群落物种丰富度。McIntosh指数是基于群落多维空间上的Euclidian距离的多样性指数,是群落物种均一性的度量,Simpson指数用于评估群落最常见种的优势度[16]。采用前人的研究[13-20],实验选取第4天(96 h)的数据,计算Shannon指数、 McIntosh指数、 Simpson指数(表5)。处理T1的Shannon指数最高,指数值为3.32,处理CK的Shannon指数值最低,为3.13。添加了生石灰处理的Shannon指数高于对照CK,说明施用生石灰对土壤微生物群落的丰富度有一定的影响,各处理之间无显著性差异;4个处理T1、T2、T3、CK的McIntosh指数未达到显著水平;处理T1的Simpson指数最高,其值为0.99;处理CK的Simpson指数最低,为0.18;处理T1的Simpson指数值是对照CK的5.58倍。处理T1、T2、T3的Simpson指数显著高于对照处理,表明生石灰对土壤微生物群落的优势度的影响较大。
2.5 主成分分析
2.5.1 施加不同水平生石灰的条件下土壤微生物群落碳源利用类型的主成分分析 根据提取的主成分个数一般要求累计方差达到85 %的原则[21],总共选取了3个成分,累计贡献率达到86.562 %。其中第1主成分(PC1)的方差贡献率为54.736 %;第2主成分(PC2)为20.25 %;第3主成分贡献率为11.575 %;3个成分的累计贡献率为86.561 %。因此选取2个主成分进行分析,以PC1为横轴,PC2为纵轴,根据不同处理在2个主成分上的得分值的不同,绘制主成分分析图(图2)。
主成分分析结果显示,不同水平的生石灰在PC轴上的分布出现了明显的差异,T1处理分布在PC1轴的正方向上、PC2轴的正方向上,即位于第二象限;T2处理分布在PC1轴的正方向上、PC2轴的负方向上,即处在第三象限;处理T3和CK分布在PC1轴的负方向上、PC2轴的正方向上,均位于第一象限。
不同生石灰施用量处理的分布差异表明,T1处理对PC1相关碳源利用较多,对PC2相关碳源利用较少;T2处理对PC1相关碳源利用最多、对PC2相关碳源利用最少; 生石灰施加量处理T3与处理CK对PC1、PC2相关碳源的利用能力相似,2个处理对PC1相关碳源的利用能力都较弱,且CK处理对PC2相关碳源的利用能力大于T3处理。
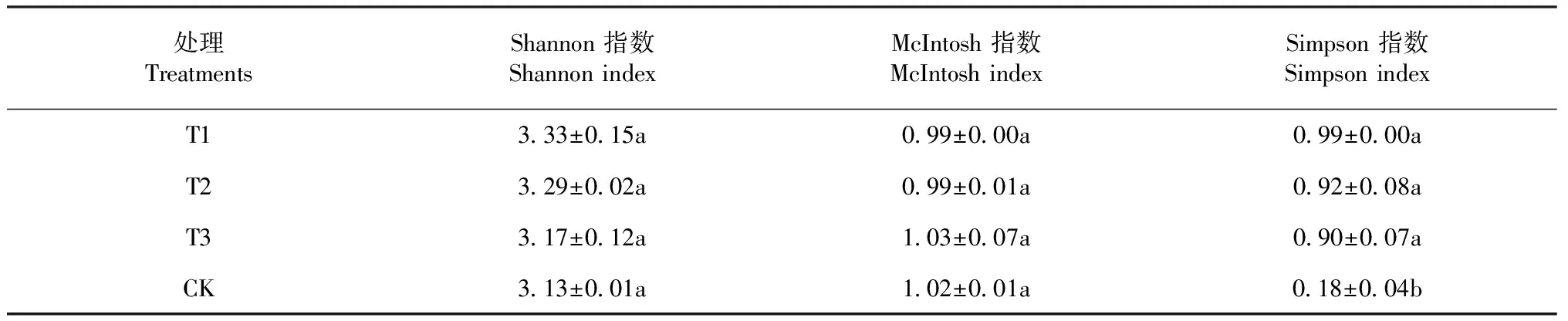
表5 土壤微生物群落功能多样性指数
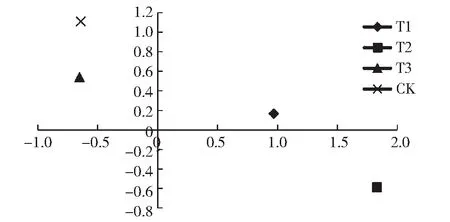
图2 土壤微生物碳源利用类型的主成分分析Fig.2 Principal components analysis of soil microbial carbon utilization
2.5.2 主成分中不同碳源的载荷值 初始载荷因子是体现主成分相关性大小与碳源利用的相关系数,载荷因子的载荷值越大,表示该种碳源对主成分的影响越大[22]。本实验利用第4天(96 h)的AWCD值做主成分分析。Biolog 微孔板上PC1与PC2的载荷因子(表6,以PC1载荷值降序排列)。由表6可知,对第一主成分(PC1)贡献较大的碳源种类有25种,糖类在PC1的相关性较高,即11种糖类;氨基酸类对PC1的贡献其次,主要包括6种;脂类与其他类与PC1的相关相关性较小,均有4种。而与第二主成分(PC2)相关性较大(≥0.5)的碳源种类有7种,主要包括1种糖类,1种氨基酸类,1种脂类和4种其他类。在PC1上权重最大的碳源是糖类,其次是氨基酸类;而对PC2贡献较大的碳源是其他类。表明糖类、氨基酸类和其他类是对PC1与PC2起分异作用的主要碳源。且糖类、脂类、氨基酸类、其他类在PC1上的权重均大于其在PC2的权重。
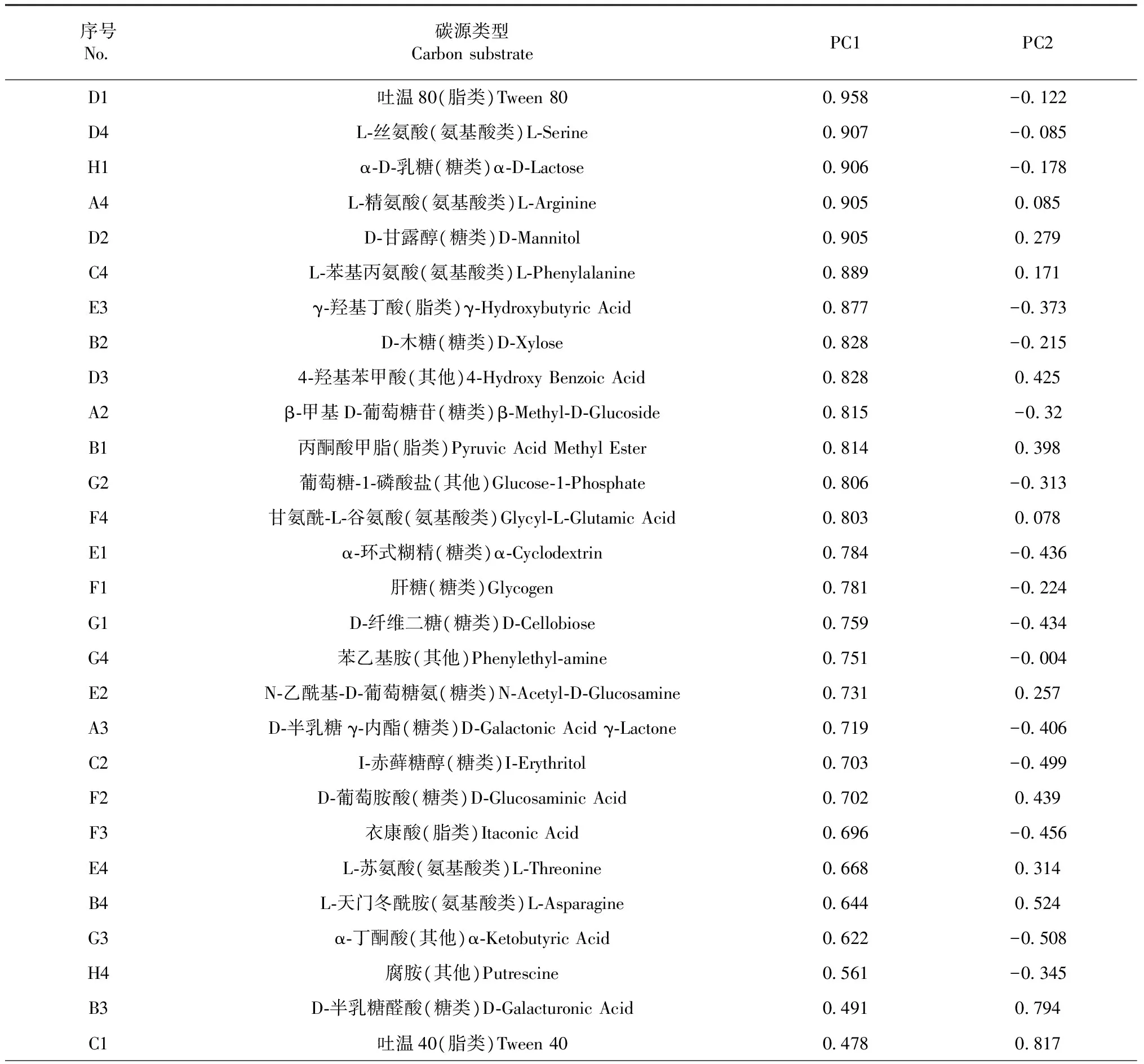
表6 Biolog微孔板上PC1和PC2载荷因子
续表6 Continued table 6

序号No碳源类型CarbonsubstratePC1PC2H3D⁃苹果酸(其他)D⁃MalicAcid04390827C32⁃羟基苯甲酸(其他)2⁃HydroxyBenzoicAcid0329082H2D,L⁃α⁃磷酸甘油(其他)D,L⁃α⁃GlycerolPhosphate00210816
3 讨 论
土壤的基本理化性质反映了土壤的肥力和质量[23-24]。本试验表明,不同的生石灰的施加量,土壤的速效磷、有机质、速效钾、碱解氮、pH值等都有不同的变化。在土壤中施加生石灰能有效地提高土壤的pH值,降低土壤酸性[25],因此土壤里pH值在添加了生石灰后相对于对照CK都有较大的提高。施加了生石灰的处理的土壤速效钾含量和碱解氮含量比不施加生石灰的处理高,且每公顷施加2250 kg的生石灰的处理(T2处理)对碱解氮的提高较明显,与对照CK的差异较显著,所以在土壤中施加合理剂量的生石灰可以能有效的改善土壤基本理化性质,创造良好的土壤生态环境,这也与前人的研究一致[26]。
土壤微生物是构成土壤生物活性的重要组成成分[27]。不同的生石灰的施加量会导致土壤微生物群落功能多样性的系统变化。微生物代谢活性的大小由AWCD值体现,由本试验结果可见,不同生石灰的施加量微生物群落单孔颜色变化率不同。AWCD值总体变化趋势为T2>T1>T3>CK,即每公顷施加2250 kg的生石灰(T2处理)的微生物平均颜色变化率(AWCD)值最高,说明在T2处理的生石灰施用水平下土壤微生物群落对碳源的利用能力最强,微生物代谢活性最大。崔红标等研究表明在土壤中施加生石灰后能提高土壤微生物的碳源利用率,进而增加了土壤中微生物能对单一碳源底物进行利用的数量[28]。
土壤微生物多样性指数的分析表明,从土壤微生物群落的Shannon指数和Simpson指数来看,施加生石灰后能对土壤丰富度产生影响并明显提高土壤的优势度。徐光泽等研究指出适当施用生石灰,能提高土壤中微生物的多样性与土壤酶活性[29]。分析其原因可能是在土壤中施加生石灰会增加土壤中某些细菌的数量,从而提高了土壤微生物群落的丰富度[30]。而不同生石灰的施用水平下各处理间的McIntosh指数的差异不显著,可能是由于在土壤中添加生石灰后,土壤内原有的一些微生物种群数量减少,而一些新的微生物种群数量增加,因此土壤的均一度指数稳定。
主成分分析结果显示(图2),农田土壤在施加不同生石灰量的处理下对PC1和PC2相关碳源的利用能力不同。处理TI和处理T2对第一主成分(PC1)相关碳源的利用率较大;处理T3和对照CK对与第二主成分(PC2)相关的碳源的利用能力较高,对与第一主成分相关碳源的利用率较低。由表6可知,第一和二主成分的碳源都包括了糖类、氨基酸类、脂类和其他类,表明土壤中添加了生石灰后,土壤中微生物群落生物组成被改变,使得土壤中主要以糖类、氨基酸类和其他类为碳源的微生物群落生长发育得到了较大的促进作用。从PC1和PC2的载荷因子值可看出,糖类、氨基酸类和其他类是对PC1与PC2起分异作用的主要碳源。
综合表5和图2可知,处理T3和对照CK的Shannon指数较为接近,两者对PC1和PC2相关碳源的利用能力也类似,说明处理T3(3375 kg/hm2)对微生物的影响不明显。分析其原因可能是施用高剂量的生石灰会使土壤的通透性变差,造成土壤板结,影响土壤酶活性[29],土壤的基本理化性质被改变后,土壤微生物群落活性的大小也被相应的改变,导致土壤微生物的丰富度增加不明显,碳源利用方式也发生改变。因此在实际生产中,应适量添加生石灰。
4 结 论
在酸性土壤中施用生石灰可有效提高土壤pH值。不同水平的生石灰对农田植烟土壤微生物群落功能多样性的改变量不同,处理T2(2250 kg/hm2)的生石灰施用量对土壤微生物代谢活性和种群优势度都有显著提高,并能有效地提高土壤微生物的碳源利用率,进而对土壤微生物多样性明显提高。本研究为酸性土壤合理施用生石灰的方式提供了一定的理论基础。
[1]秦燕燕. 添加豆科植物对弃耕地土壤微生物多样性的影响[D]. 兰州大学,2009.
[2]贺纪正. 面向未来的土壤微生物生态学研究[C]. 面向未来的土壤科学,2012.
[3]李 靖. 白云山土壤原生动物群落生态学研究[D]. 中山大学,2010.
[4]王长庭,龙瑞军,刘 伟,等. 高寒草甸不同群落类型土壤碳分布与物种多样性、生物量关系[J]. 资源科学,2010,32(10):2022-2029.
[5]董 萍,孙寓姣,王红旗,等. 利用T-RFLP技术对温榆河微生物群落结构研究[J]. 中国环境科学,2011,31(4):631-636.
[6]王长友,王修林,于文金,等. 污染物环境生态效应评价研究进展[J]. 生态学报,2009, 29(9):5081-5087.
[7]刘琼峰,蒋 平,李志明,等. 湖南省水稻主产区酸性土壤施用石灰的改良效果[J]. 湖南农业科学,2014(13):29-32.
[8]吕绍华,范美玲. 不同石灰施用量对大棚番茄土壤酸化的影响研究[J]. 现代农业科技,2013(16):235-235.
[9]熊德中,李春英,黄光伟,等. 施用石灰对福建低pH植烟土壤的效应[J]. 中国烟草学报,1999(1):28-29.
[10]史吉平,张夫道,林 葆. 长期施肥对土壤有机质及生物学特性的影响[J]. 中国土壤与肥料,1998(3):7-11.
[11]沙月霞. 红枣贮藏期果面微生物对碳源的利用及主成分分析[J]. 微生物学通报, 2011,38(1):35-44.
[12]胡君利,林先贵,褚海燕,等. 种植水稻对古水稻土与现代水稻土微生物功能多样性的影响[J]. 土壤学报,2007,44(2):280-287.
[13]赵 宁. 营林用火对不同林型土壤理化性质影响的研究[D]. 江西农业大学,2011.
[14]闫 冰,肖能文,齐 月,等. 北京城市发展对土壤微生物群落功能多样性的影响[J]. 环境科学研究,2016,29(9):1325-1335.
[15]魏迎春,唐 琳. 杨凌大棚土壤微生物区系变化研究[J]. 西藏农业科技,2008,30(3):14-18.
[16]郝晓晖,胡荣桂,吴金水,等. 长期施肥对稻田土壤有机氮、微生物生物量及功能多样性的影响[J]. 应用生态学报,2010,21(6):1477-1484.
[17]时亚南. 不同施肥处理对水稻土微生物生态特性的影响[D]. 浙江大学,2007.
[18]陈 琳,谷 洁,高 华,等. 含铜有机肥对土壤酶活性和微生物群落代谢的影响[J].生态学报,2012,32(12):3912-3920.
[19]赵 艳,李锋民,王昊云,等. 好氧/厌氧潜流湿地微生物多样性与净化能力的关系[J]. 环境科学学报,2011,31(11):2423-2431.
[20]申卫收,林先贵,张华勇,等. 不同施肥处理下蔬菜塑料大棚土壤微生物活性及功能多样性[J]. 生态学报,2008,28(6):2682-2689.
[21]田雅楠,王红旗. Biolog法在环境微生物功能多样性研究中的应用[J]. 环境科学与技术,2011,34(3):50-57.
[22]郝黎仁,樊 元,郝哲欧. SPSS实用统计分析(21世纪高等院校计算机系列教材)[M].北京:水利水电出]版社, 2005.
[23]赵晓琛,刘红梅,皇甫超河,等. 贝加尔针茅草原土壤微生物功能多样性对养分添加的响应[J]. 农业环境科学学报,2014(10):1933-1939.
[24]陈桂芬,刘 忠,黄雁飞,等.不同施肥处理对连作蔗田土壤微生物量、土壤酶活性及相关养分的影响[J].南方农业学报,2015,46(12):2123-2128.
[25]刘占锋,傅伯杰,刘国华,等. 土壤质量与土壤质量指标及其评价[J]. 生态学报, 2006,26(3):901-913.
[26]肖文芳. 施用石灰和磷矿粉对桃园土壤养分和树体营养的影响[D]. 华中农业大学,2009.
[27]Insam H, Mitchell C C, Dormaar J F. Relationship of soil microbial biomass and activity with fertilization practice and crop yield of three ultisols[J]. Soil Biology & Biochemistry,1991, 23(5):459-464.
[28]崔红标,范玉超,周 静,等. 改良剂对土壤铜镉有效性和微生物群落结构的影响[J].中国环境科学,2016(1):197-205.
[29]徐光泽,席飞虎,张重义. 施用生石灰对烤烟根际生物学特征及烟叶产质量的影响[J].江西农业学报,2014(7):67-70.
[30]邢世和,熊德中,周碧青,等. 不同土壤改良剂对土壤生化性质与烤烟产量的影响[J].土壤通报,2005,36(1):72-75.
EffectofQuicklimeonAcidSoilpHandMetabolicFunctionalDiversityofMicrobialCommunity
DAN Jun-hao1, QI Shao-wu1.2*, LI Juan1, JIN Hui-yong3, ZHU Yi4, LIANG Zhong-zhe1
(1.College of Agronomy, Hunan Agricultural University,Hunan Changsha 410128,China;2.Hunan Hybrid Rice Research Center,Hunan Changsha 410128,China;3.Agricultural Committee of Suyu Distriction in Suqian City,Jiangsu Suqian 223800,China;4.China Tobacco Guangdong Industrial Co., Ltd,Guangdong Guangzhou 510000,China)
【Objective】The effects of different levels of quicklime fertilizer on acid soil pH and soil microbial community functional diversity were investigated with pot experiments.【Method】The experiment of Biolog-Eco microplate technical to was carried out to study the changes of soil microbialcommunity carbon metabolism diversity under four different treatments[CK (0 kg/hm2), T1(1125 kg/hm2), T2(2250 kg/hm2) and T3(3375 kg/hm2)]. 【Result】(i)During the culture period of the 240 hours, the AWCD values of the acid soil microbial communities followed the order:T2>T1>T3>CK. (ii)The canonical analysis of soil pH and AWCD showed that they were moderate correlation between soil pH and AWCD. (iii)Soil microbial community functional diversity index showed that T1, T2 and T3 treatments significantly higher than CK treatment of Simpson index, however, there were not significant differences in Shannon index and McIntosh index among the four treatments. (iv)Principal component analysis showed that microbial carbon utilization was similar to T3 and CK treatments and different from T1 and T2 treatments. 【Conclusion】It was concluded that T2 treatment with 2250 kg quicklime per hectare could significantly improve the soil pH, the metabolic activity of microorganism, the dominance, the carbon utilization styles of soil microbial community, which would increase the soil microbial diversity.
Biolog-ECO; pH; Quicklime addition; Acid soil; Microbial community functional diversity
1001-4829(2017)12-2739-07
10.16213/j.cnki.scjas.2017.12.021
2017-01-10
湖南省科技计划项目(2015NK3002)
淡俊豪(1995-),女,贵州贵阳人,硕士在读,主要从事烟草品质与生态安全、耕地重金属污染治理等研究,E-mail:335094608@qq.com,*为通讯作者。
S154.3
A
(责任编辑陈 虹)

