西藏尼木县绵羊背带属线虫形态及分子分类鉴定
夏晨阳,刘建枝*,胡 敏,杨 新,石 斌,唐文强
(1.西藏自治区农牧科学院畜牧兽医研究所,西藏 拉萨 850009;2.华中农业大学动物医学院,湖北 武汉 430070)
西藏尼木县绵羊背带属线虫形态及分子分类鉴定
夏晨阳1,刘建枝1*,胡 敏2,杨 新2,石 斌1,唐文强1
(1.西藏自治区农牧科学院畜牧兽医研究所,西藏 拉萨 850009;2.华中农业大学动物医学院,湖北 武汉 430070)
【目的】2014年在西藏尼木县绵羊皱胃收集到红褐色线虫830余条,对其进行形态及分子分类鉴定。【方法】首先进行了形态学鉴定,之后提取DNA,用特异性引物扩增ITS-2基因,并进行测序,与GenBank中的相关序列进行了同源性比较,建立了系统发育树。【结果】西藏尼木县绵羊体内感染的寄生虫为背带属普通背带线虫Teladorsagiacircumcincta。【结论】首次在西藏发现背带属普通背带线虫Teladorsagiacircumcincta。家畜寄生虫分子分类学研究今后将成为西藏寄生虫病研究重要组成。
背带属;核糖体DNA;进化树分析;西藏
【研究意义】寄生虫命名、诊断、治疗与控制对于寄生虫基础生物学与流行病学研究至关重要[1-2]。传统的线虫种类鉴定以形态学鉴定为主。分子生物学诊断技术是形态学鉴定的重要补充,寄生虫虫种鉴定已成功利用基因标记物(线粒体DNA、内部转录间隔区ITS、核糖体DNA等)开展线虫分子分类学研究[3-6]。核糖体第二内转录间隔区(rDNA ITS-2)基因在核糖体DNA(rDNA)中是介于18S和28S之间的内转录间隔区,在生物进化过程中,其进化速度快,种内具有高度保守性,而在不同种间又有不同程度的变异,因此为理想的种间鉴定遗传标记[7]。【前人研究进展】肠道线虫引起的家畜及人缓慢消瘦在全世界均有发生,是造成绵羊养殖业经济损失的主要寄生虫[8]。肠道线虫对绵羊养殖主要危害有食欲减退,体重减轻,毛、肉及乳产量减少,甚至导致死亡[9-12]。在寒温带地区绵羊主要寄生线虫虫种是圆线科背带属(Teladorsagia)线虫[8,13],易感动物以瘦弱的羔羊为主[14]。奥斯特属线虫(Ostertagia)与背带属线虫很难从形态上加以区分,背带属线虫主要寄生于绵羊和山羊,而奥斯特属线虫主要寄生于牛[15]。虫体长小于14 mm,褐色,口腔短小宽大,交合刺末端有2个或3个短小分支,常见于反刍动物的真胃内。雌虫尾部末端具环纹,排卵器内的虫卵是圆线科虫卵代表,阴门具阴门盖。背带属线虫是温带[16-17]和许多国家[18-21]山羊、绵羊[22]重要的寄生线虫,严重影响羊生产性能[16-17]。【本研究切入点】本文主要目的是研究西藏尼木县绵羊体内采集到的背带属线虫形态学及其分子分类学特性。
1 材料与方法
1.1 虫体标本
线虫标本2013年12月采自西藏尼木县绵羊真胃,生理盐水洗涤干净后保存于盛有75 %酒精的20 mL EP管内,室温保存。
1.2 主要试剂
DNA提取试剂盒WizardTMDNA Clean-Up System 为Promega公司产品;ExTaq、PCR缓冲液、MgCl2、dNTPs均为上海生工生物工程技术服务有限公司产品;其余试剂均由华中农业大学实验室提供。
1.3 引物合成
参照国外文献报道的序列引物[3-5,20],设计ITS-2上游引物NC1:5’-ACGTCTGGTTCAGGGTTGTT-3’;ITS-2下游引物NC2:5’-TTAGTTTCTTTTCCTCCGCT-3’,引物由生工生物工程(上海)股份有限公司合成。
1.4 虫株DNA的提取
按照虫株DNA提取试剂盒的操作步骤,将已鉴定的虫株样品用无菌水清洗干净,除去表面黏液,取15条线虫,在无菌条件下解剖取出内容物,剪碎,提取虫株DNA,用琼脂糖凝胶电泳鉴定后-20 ℃保存备用。
1.5 目的基因片段的PCR扩增
分别以各分离株的DNA为模板,用上述引物进行PCR扩增。50 μl PCR反应体系:DNA模板1 μl,10×缓冲液(含Mg2+)5 μl, 2.5 mmol/L dNTPs 4 μl,引物各1 μl,TaqDNA聚合酶(5 U/μl)0.3 μl,最后加灭菌双蒸水至总体积为50 μl。
扩增条件:94 ℃预变性5 min, 94 ℃变性30 s,54.3 ℃退火30 s,72 ℃延伸1 min,进行35个循环,然后72 ℃再延伸7 min,4 ℃保存备用。取上述PCR产物5 μl在1.0 %的琼脂糖凝胶(含0.5 μg/mL溴化乙锭)中,进行电泳分析,观察扩增结果并拍照。
1.6 鉴定
扩增产物送上海生工生物工程技术服务有限公司测序,然后进行序列比较和分析。将测序所得的正确序列和从GenBank下载的ITS-2基因的相关序列(表1)进行分析,利用MEGA 5.05采用极大似然法(ML)和UPGMA 法构建进化树。
2 结果与分析
2.1 形态学鉴定
虫体线虫形态学鉴定主要参考吴淑卿[23],张路平[24],黄兵[25]等人的文献,逐条鉴定。如无特定说明长度单位为微米。
总体描述:普通背带线虫T.circumcincta活虫卷曲,红褐色。颈乳突显著,食道-肠联合显著(图1)。雄虫:小,交合伞明显。虫体长(n=33)8578~11 373(9754.22±1011.21),虫体最宽处(n=33)131~223 (163.28±26.69),食道长(n=31) 512~821 (680.03±93.03),食道膨大部(n=31) 48~67 (59.06±8.91),颈乳突距头端长(n= 31) 271~456 (349.51±55.65)。交合伞对称,分叶不明显,具横纹,背肋明显,内含背辐肋,背肋60~72处分支。交合刺,细长,末端分三支,右支长(n=32) 273~349 (320.20±22.25),右交合刺分支处至末端长67~95 (86.06±9.61);左支长(n=32) 273~349 (324.00±21.93),右交合刺分支处至末端长67-95 (85.86±9.47);引器球拍状,前部宽大,头部尖细,后部丝状,长(n= 23) 95~116 (100.23±9.14)。
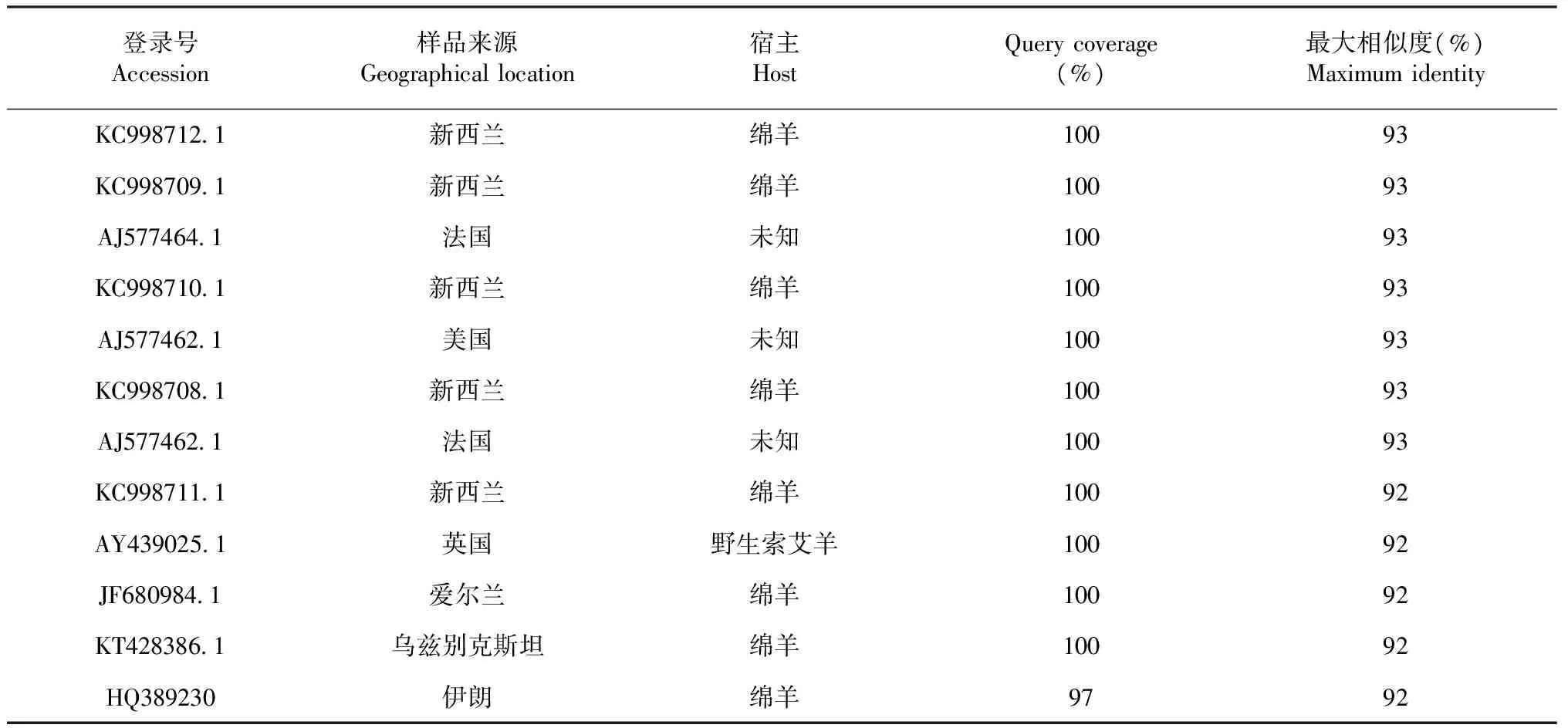
表1 普通背带线虫T. circumcincta同源性比较

1.头部;2.颈乳突;3.肛门;4.阴门盖;5.交合刺;6.引起;7.交合伞;8.背肋;9.交合伞横纹1.Anterior and Cervical;2.Cervical papillae;3.Anus;4.Vulva;5.Spicule;6.Gubernaculum;7.Copulatory bursa; 8.Dorsal ray; 9.Copulatory bursa with cross striation图1 普通背带线虫T. circumcincta形态特征Fig.1 Morphological character of T. circumcincta
雌虫:小,线状。虫长:(n=31) 11518~15783 (13204.82±1791.82),虫体最宽部位于阴门盖附件;食道长(n=30) 640~916 (763.15±138.90),最宽部48~77 (66.02±12.66);颈乳突距头端长(n=30) 349~475 (398.06±47.06)。
2.2 序列同源性比对
参照Genbank中已公布的普通背带线虫T.circumcincta序列及其他虫株序列进行比对分析显示,西藏普通背带线虫T.circumcincta样本与其他地域样本同源性最高达93 %(表1)。
2.3 进化树的构建
以长刺后圆线虫作为系统发育分析的外类群, 构建ML树,各分支均进行1000次重复检验,其他对比线虫包括艾克(氏)毛圆线虫Trichostrongylusaxei(KF880746.1,KJ755059.1,伊朗), 细刺奥斯特线虫Ostertagialeptospicularis(DQ354334.1,法国), 格氏奥斯特线虫Ostertagiagruehneri(AJ400716.1, 挪威), 北方奥斯特线虫Ostertagiaarctica(AJ250657.1, 挪威),捻转血矛线虫Haemonchuscontortus(KU558759.1,中国; FN432336.1, 意大利), 蛇形毛圆线虫Trichostrongyluscolubriformis(HF 678107.1, 印度; KC337068.1, 老挝), 香柏马歇尔线虫Marshallagiaoccidentalis(AY013244.1, AJ400715.1,挪威),指形长刺线虫Mecistocirrusdigitatus(AB114420.1, 日本; AJ577468.1, 法国),Teladorsagiacircumcincta(KC998712.1, 新西兰), 长刺后圆线虫Metastrongyluselongates(AJ305378.1,爱沙尼亚)。
进化树结果显示,西藏绵羊体内采集样本与新西兰发现的绵羊株(KC998712.1)同源性最高(图2)。
3 讨 论
3.1 背带线虫同源性
背带属线虫世界上共有2种,我国寄生于绵羊和山羊体内主要是达氏背带线虫(Teladorsagiadavtiani),该寄生虫呈世界性分布,澳大利亚、加拿大、美国、智利、挪威、英国、荷兰,我国分布于内蒙古、新疆、甘肃[23]。2016年我国首次报道利用COI发现普通背带线虫Teladorsagiacircumcincta[26]。本研究首次利用ITS-2基因在青藏高原重要区域西藏发现普通背带线虫Teladorsagiacircumcincta。本研究以ITS-2作为遗传标记,在分析序列变异的基础上建立了区分背带属线虫的PCR方法,从而为背带属线虫分子生物学的进一步研究奠定了基础,并为建立背带属线虫的分子鉴别和快速诊断的PCR检测方法提供了遗传标记。

图2 基于ITS-2基因序列的ML树Fig.2 ML tree based on ITS2 gene sequences
3.2 分子技术在西藏寄生虫研究中的应用前景
传统形态学鉴定寄生虫方法已无法适应现代寄生虫分类研究,应采取形态与分子结合的方式对所在区域内的寄生虫进行精确分类,这对于寄生虫进化史研究具有重要的生物学意义,西藏家畜寄生虫的分子分类研究今后必将成为家畜寄生虫病研究领域重要组成。
以皮蝇蛆为例,通过分子技术手段证明中华皮蝇为一个独立虫种,不应归类到纹皮蝇高山亚种,完全将其与纹皮蝇、牛皮蝇区分开来[27-31],笔者等人[32]也通过分子分类研究首次对西藏当雄牦牛体内采集的皮蝇样本进行了分类研究,最终确定西藏当雄牦牛体内寄生的皮蝇蛆为牛皮蝇(Hypodermabovis)和中华皮蝇(Hypodermasinence),并且首次在西藏发现中华皮蝇。
4 结 论
通过分子生物学技术手段,首次在西藏发现背带属普通背带线虫Teladorsagiacircumcincta。家畜寄生虫分子分类学研究今后将成为西藏寄生虫病研究重要组成。通过不断深入的调查研究,分子生物技术今后必将对西藏寄生虫的分类研究产生深远影响,取得重要的进展,寄生虫虫种的分类将更科学、更系统。
[1]Criscione C D, Poulin R, Blouin M S. Molecular ecology of parasites: elucidating ecological and microevolutionary processes[J]. Mol Ecol, 2005, 14: 2247-2257.
[2]Lichtenfels J R, Hoberg E P. The systematics of nematodes that cause ostertagiasis in domestic and wild ruminants in North America: an update and a key to species[J]. Vet Parasitol, 1993, 46:33-53.
[3]Stevenson L A, Gasser R B, Chilton N B. The ITS-2 rDNA ofTeladorsagiacircumcincta,T.trifurcataandT.davtiani(Nematoda: Trichostrongylidae) indicates that these taxa are one species[J]. Int J Parasitol, 1996, 26: 1123-1126.
[4]Hasheminasab S S. Molecular characterization of the first internal transcribed spacer of rDNA ofParabronemaskrjabinifor the first time in sheep[J]. Ann Parasitol, 2015, 61: 241-246.
[5]Holguin C M, Baeza J A, Mueller J D, et al. High genetic diversity and geographic subdivision of three lance nematode species (Hoplolaimusspp.) in the United States[J]. Ecol.Evol., 2015, 5: 2929-2944.
[6]Lott M J, Hose G C, Power M L. Parasitic nematode communities of the red kangaroo,Macropusrufus: richness and structuring in captive systems[J]. Parasitol Res., 2015, 114: 2925-2932.
[7]林瑞庆, 蔡天城, 吴桂英,等. 鸡蛔虫ITS rDNA的PCR扩增克隆及序列分析[J]. 中国兽医杂志, 2008, 44(3):24-25.
[8]RV B. The economic impact of nematode infection in sheep: implications for future research and control[A]. Edited by Heath ACG. In The economic importance of parasites of livestock in New Zealand[C]. New Zealand: New Zealand Society for Parasitology, 1988: 4-16.
[9]Alberti E Z S, Ferrari N, Bruni G, et al. Effects of gastrointestinal nematodes on milk productivity in three dairy goat breeds[J]. Small Rumin Res, 2012, 106: S12-S17.
[10]Coop R L, Kyriazakis I. Influence of host nutrition on the development and consequences of nematode parasitism in ruminants[J]. Trends Parasitol, 2001, 17: 325-330.
[11]Roeber F, Jex A R, Gasser R B. Impact of gastrointestinal parasitic nematodes of sheep, and the role of advanced molecular tools for exploring epidemiology and drug resistance-an Australian perspective[J]. Parasites & Vectors, 2013(6):153.
[12]Zajac A M. Gastrointestinal nematodes of small ruminants: life cycle, anthelmintics, and diagnosis[J]. Vet Clin North Am Food Anim Pract, 2006, 22: 529-541.
[13]Urquhart G M, Armour J, Duncan J L, et al. Veterinary parasitology Second Edition[M]. Blackwell Science, Oxford, 2007:1-307.
[14]Wilkie H, Gossner A, Bishop S, et al. Variations in T Cell Transcription Factor Sequence and Expression Associated with Resistance to the Sheep NematodeTeladorsagiacircumcincta[J]. PloS one, 2016, 11: e0149644.
[15]Bowman D D. Georgis′ Parasitology for Veterinarians[M]. W.B. Saunders Company, 2014: 162-164.
[16]Morgan E R, Van D J. Climate and the epidemiology of gastrointestinal nematode infections of sheep in Europe[J]. Vet Parasitol, 2012, 189: 8-14.
[17]Stear M J, Bairden K, Bishop S C, et al. The processes influencing the distribution of parasitic nematodes among naturally infected lambs[J]. Parasitology, 1998, 117: 165-171.
[18]Barrett M, Jackson F, Huntley J F. Pathogenicity and immunogenicity of different isolates ofTeladorsagiacircumcincta[J]. Vet Parasitol, 1998,76: 95-104.
[19]Cabaret J, Morales G, Gruner L.Characterization ofTeladorsagiacircumcinctaandT.trifurcata. I. Epidemiological and biological aspects][J]. Ann Parasitol Hum Comp, 1984, 59: 607-617.
[20]Leignel V, Humbert J F. Mitochondrial DNA variation in benzimidazole-resistant and-susceptible populations of the small ruminant parasiteTeladorsagiacircumcincta[J]. J Hered, 2001, 92: 503-506.
[21]Stear M J, Henderson N G, Kerr A, et al. Eosinophilia as a marker of resistance toTeladorsagiacircumcinctain Scottish Blackface lambs[J]. Parasitology, 2002, 124: 553-560.
[22]Gasnier N, Cabaret J. Evidence for the existence of a sheep and a goat line ofTeladorsagiacircumcincta(Nematoda)[J]. Parasitol Res, 1996, 82: 546-550.
[23]吴淑卿. 中国动物志 线虫纲 杆形目 圆线亚目(一)[M]. 北京:科学出版社,2001.
[24]张路平,孔繁瑶. 中国动物志 线虫纲 杆形目 圆线亚目(二)[M]. 北京:科学出版社,2014.
[25]黄 兵,沈 杰. 中国畜禽寄生虫形态分类图谱[M]. 北京:中国农业科学技术出版社,2006:265-504.
[26]Lv J, Zhang Y, Feng C, et al. Species discrimination in the subfamily Ostertagiinae of Northern China: assessment of DNA barcode in a taxonomically challenging group[J]. Parasitol Res, 2016, 115: 987-996.
[27]Otranto D, Stevens J R. Molecular approaches to the study of myiasis-causing larvae[J]. Int J Parasitol, 2002, 32(11): 1345-1360.
[28]Otranto D, Colwell D D, Traversa D, et al. Species identification ofHypodermaaffecting domestic and wild ruminants by morphological and molecular characterization[J]. Med Vet Entomol, 2003, 17(3): 316-325.
[29]Otranto D, Traversa D, Guida B, et al. Molecular characterization of the mitochondrial cytochrome oxidase I gene of Oestridae larvae causing obligate myiasis[J]. Med Vet Entomol, 2003, 17(3): 307-315.
[30]Otranto D, Traversa D, Colwell D D, et al. A third species ofHypoderma(Diptera: Oestridae) affecting cattle and yaks in China: molecular and morphological evidence[J]. J Parasitol, 2004, 90(5): 958-965.
[31]Otranto D, Colwell D D, Pape T.Hypodermasinense: solving a century-old enigma[J]. Med Vet Entomol, 2005, 19 (3): 315-321.
[32]刘建枝,色 珠,关贵全,等. 西藏当雄牦牛皮蝇蛆病病原的分子分类鉴定[J]. 中国兽医科学,2012,42(3):238-242.
MolecularandMorphologicallyClassificationofTeladorsagiafromSheepinNimuCountyofTibetAutonomousRegion
XIA Chen-yang1, LIU Jian-zhi1*, HU Min2, YANG Xin2, SHI Bin1, TANG Wen-qiang1
(1. Institute of Animal Science,Tibet Academy of Agricultural and Animal Husbandry Science,Tibet Lhasa 850009, China; 2. College of Veterinary Medicine, Huazhong Agricultural University, Hubei Wuhan 430070, China)
【Objective】830 reddish-brown nematodes were collected at Nimu county of Tibet in 2014 and morphologically characterized, and analysis molecular and morphologically classification ofTeladorsagia. 【Method】The genomic DNA of the nematode was extracted. Internal transcribed spacer 2(ITS-2)gene was amplified by specific primers sequenced and compared with that in GenBank. The phylogenetic tree based on the ITS-2 gene was constructed. 【Result】The specimens from the county wereTeladorsagiacircumcincta, for the first time founded in Tibet. 【Conclusion】The molecular classification of parasites from livestock in Tibet will be important part of study of Tibet parasitic diseases in future.
Teladorsagia; Nuclear ribosomal DNA; Phylogenetic analysis; Tibet
1001-4829(2017)12-2838-05
10.16213/j.cnki.scjas.2017.12.038
2017-02-12
公益性行业(农业)科研专项(201303037)
夏晨阳(1980-),男,满族,黑龙江明水人,副研究员,研究方向为西藏家畜寄生虫病防控,E-mail:13518978860@163.com。*为通讯作者:刘建枝,研究员,主要从事家畜寄生虫病防控研究,Tel:13659526886,E-mail:13659526886@163.com。
S432.4+5
A
(责任编辑李 洁)

