强化代谢控制对2型糖尿病并肾脏疾病患者IL—6、IL—18水平的影响
郭星荣+吴标良+王民登+周连吉+黄键生

【摘要】目的观察强化代谢控制对2型糖尿病并肾脏疾病(Type 2 diabetic kidney disease,T2DKD)患者白细胞介素6(IL-6)、白细胞介素18(IL-18)的影响,探讨强化代谢控制对延缓DKD进展的作用。方法选择2013年1月至2015年12月在右江民族医学院附属医院住院的T2DKD Ⅲ~Ⅳ期患者120例,随机分成两组,常规治疗组(A组)及强化治疗组(B组),每组60例,分别给予常规治疗及强化治疗6个月,使用酶联免疫吸附法(ELISA)检测两组治疗前后血清IL-6、IL-18水平,同时检测糖化血红蛋白(HbA1c)、空腹血糖(FBG)、餐后2 h血糖(2 h PG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)、血压水平。结果综合代谢控制6个月后,常规治疗组收缩压(SBP)无明显变化(P>005),两组其余各代谢、血压及炎症指标水平均明显下降(P<0.05或0.01),与治疗前相比,强化治疗组各代谢指标、血压下降更为显著,且IL-6、IL-18水平显著降低(P<0.05或0.01),而常规治疗组IL-6、IL-18无明显变化(P>005)。结论强化代谢控制可降低IL-6、IL-18水平,有利于延缓T2DKD进展。
【关键词】强化代谢控制;糖尿病肾脏疾病;白细胞介素6;白细胞介素18
中图分类号:R587.2文献标识码:ADOI:10.3969/j.issn.1003-1383.2017.06.004
【Abstract】ObjectiveTo observe the effect of intensive metabolic control on the levels of IL-6 and IL-18 in T2DKD(Type 2 diabetic kidney disease)patients,so as to investigate the effect of intensive metabolic control on delaying the progression of DKD.Methods120 patients with T2DKD stage Ⅲ to Ⅳ and hospitalized in Affiliated Hospital of Youjiang Medical University from January,2013 to December,2015 were selected.All patients were randomly divided into conventional treatment group(group A) and intensive treatment group(group B),with 60 cases in each group,and the two groups were given conventional treatment and intensive treatment for 6 months,respectively.Enzyme linked immunosorbent assay(ELISA)was used to detect the levels of serum IL-6 and IL-18 in the two groups before and after treatment.Meanwhile,glycosylated hemoglobin(HbA1c),fasting blood glucose(FBG),2 h postprandial blood glucose(2 h PG)total cholesterol(TC),low density lipoprotein(LDL-C),triglyceride(TG)and blood pressure levels were also detected.ResultsAfter 6 months of intensive metabolic control,the systolic blood pressure(SBP)did not change significantly in the conventional treatment group(P>0.05),the levels of other metabolism,blood pressure and inflammatory indexes in the two groups significantly decreased(P<0.05 or 001).Compared with those before treatment,the indexes of metabolism and blood pressure in the intensive treatment group decreased more significantly,and the levels of IL-6 and IL-18 significantly decreased (P<0.05 or 0.01),but there was no significant change in IL-6 and IL-18 levels in the conventional treatment group(P>0.05).ConclusionIntensive metabolic control can reduce the levels of IL-6 and IL-18,which is beneficial to delay the progression of T2DKD.
【Key words】intensive metabolic control;DKD;IL-6;IL-18
近年來糖尿病(diabetes mellitus,DM)的患病率逐渐上升,而糖尿病肾脏疾病(diabetic kidney disease,DKD)是DM最为常见且严重的并发症之一,是糖尿病患者致残、致死的重要原因。在发达国家,DKD已经上升为终末期肾病(ESRD)的首位原因,而在我国由DKD所导致的ESRD患者以每年8%~10%的速度递增,但DKD的发病机制至今仍未阐明,DKD治疗难度大、效果不佳,国内外研究显示炎症因子白细胞介素6(IL-6)、白细胞介素18(IL-18)在DKD的发生、发展中起关键作用[1],强化代谢控制是目前糖尿病治疗的重要手段。本研究拟通过观察强化代谢控制对IL-6、IL-18的影响,以探讨强化代谢控制对延缓DKD进展的作用。1资料与方法1.1 一般资料选择2013年1月至2015年12月在右江民族医学院附属医院内分泌科住院诊断为2型糖尿病(T2DM)合并DKDⅢ~Ⅳ期的患者共120例,随机分成两组,T2DKD常规治疗组(A组)60例,男33例,女27例,平均年龄(57.8±8.1)岁,平均病程(8.4±7.4)年;T2DKD强化治疗组(B组)60例,男32例,女28例,平均年龄(55.1±11.3)岁,平均病程(7.5±6.1)年。诊断依据1999年WHO糖尿病诊断与分型标准、2013年中国2型糖尿病防治指南[2]及2007年美国肾脏病基金会(NKF)肾脏病生存质量指南[3]。排除以下情况患者:(1)心、脑、肝、肺、肾等器官功能衰竭及血液风湿疾病;(2)泌尿系统结石、肾炎以及非DKD引起的高血压及其他原因引起的肾病;(3)糖尿病酮症酸中毒;(4)肾功能在短时间内迅速恶化、糖尿病病程不长、肾功能无异常而伴有突然出现的水肿、大量蛋白尿、无视网膜病变,伴有明显的血尿、合并明显的异常管型等。本研究经过医院医学伦理委员会批准,所有入选患者签署知情同意书。endprint
1.2治疗方法A组常规控制血糖、血压、血脂,B组强化控制血糖、血压、血脂至目标值, 根据2013版中国2型糖尿病控制指南[2],强化控制目标如下:空腹血糖(FBG)<6.1 mmol/L、餐后2小时血糖(2hPG)<8.0 mmol/L、糖化血红蛋白(HbA1c)<65%、总胆固醇(TC)<4.5 mmol/L、甘油三酯(TG)<1.7 mmol/L、低密度脂蛋白胆固醇(LDL-C)<1.8 mmol/L、血压(BP)<130/80 mmHg。
1.3标本采集①空腹状态下抽取静脉血4 ml,25℃左右静置30 min,然后离心20 min(3000转/min);测定血糖、糖化血红蛋白、血脂组合、肾功能等生化指标(使用美国贝克曼COULTER LX20全自动生化分析系统);留取晨尿测定尿白蛋白与肌酐比值。②测定血清IL-6和IL-18:使用ELISA专用试剂盒,试剂分别由上海西门子医学诊断产品有限公司、厦门慧嘉生物科技有限公司提供。
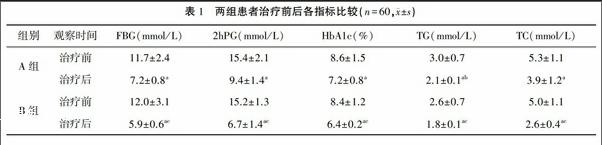
1.4统计学方法采用SPSS 13.0进行统计分析,计量资料采用(±s)表示,组间比较采用t检验,检验水准:α=0.05,双侧检验。2结果两组患者性别、年龄、糖尿病病程相比差异无统计学意义(P>0.05),具有较好可比性。治疗前两组患者糖代谢指标(FBG、2hPG、HbA1c)、脂代谢指标(TC、TG、LDL-C)及血压(SBP、DBP)、炎症指标(IL-6、IL-18)相比均无统计学意义(P>0.05)。治疗后,A组SBP无明显变化(P>0.05),两组其余各代谢、血压及炎症指标水平均明显下降(P<0.05或P<001),与治疗前相比,B组各代谢指标、血压下降更为显著,且IL-6、IL-18水平显著降低(P<0.05或P<0.01),A组IL-6、IL-18无明显变化(P>0.05)。见表1。
3讨论T2DM是以慢性持续血糖升高为主要特征的代谢性代谢综合征,T2DM的发病率越来越高,DKD等T2DM并发症的发病率也与日俱增,DKD给人民群众带来的危害成为公共卫生事业的棘手问题[4]。尽管如此,T2DM、DKD的具体发病机制尚未得到阐明,各种治疗方案总体疗效不佳,长期的临床实践显示传统的治疗方法并不能明显延缓DKD的进程。近年来,T2DM、DKD发病机制方面的研究热点之一为微炎症反应及针对抗炎症反应治疗的新措施。
本研究探讨了强化综合代谢控制对T2DKD患者炎症因子IL-6、IL-18表达的影响,ELISA结果显示强化综合代谢控制6个月后,IL-6、IL-18在强化治疗组血清中的表达水平明显下降,与常规治疗组比较差异有统计学意义,强化血糖、血脂、血压这些基础的代谢指标治疗达标可能可以减轻、延缓DKD,其机制可能是:①强化血糖控制使T2DKD患者血糖平稳、快速下降,抑制了“高糖毒性”促发的微炎症反应:研究表明,“高糖毒性”的内环境可刺激AGEs形成,同时刺激肾脏固有细胞释放和表达多种细胞炎性因子(如IL-18、NO、IL-6、IL-1等)[5]。②调脂治疗抑制“脂毒性”所促发的炎症反应:脂毒性可促发炎症反应[11],导致肾损伤,脂毒性对肾小球内皮细胞功能损害主要使血管内皮功能紊乱,这也是T2DKD患者血管并发症产生的基础[6]和并发症发展恶化的始动及关键因素,血管内皮细胞通过分泌如内皮素、血管性假血友病因子、前列环素及血管内皮舒张因子等一系列生物活性物质,促进炎症及免疫反应,血栓形成、血管壁病变等病理过程也加剧[7~8]。而T2DM长期存在的高代谢综合——糖毒性、脂毒性和高血压又进一步损害血管内皮细胞功能[9~10]。氧化LDL(ox-LDL)本身具有趨化单核/巨噬细胞、淋巴细胞、中性粒细胞的作用,脂蛋白被单核/巨噬细胞摄取后变为泡沫细胞,释放溶酶体酶、中性蛋白酶、β-葡萄糖醛酸酶等多种蛋白酶和活性氧分子,介导肾脏损伤;泡沫细胞还可以通过产生趋化蛋白,吸引各种炎性细胞浸润。另外,位于GBM的葡萄糖胺与修饰的LDL过多结合,使GBM对蛋白的通透性增加,蛋白漏出,促发肾间质组织类似细胞炎症反应,促进肾小管间质发生纤维化。过度堆积的脂肪组织被脂毒性的FFA激发,大量释放IL-6、肿瘤坏死因子α(TNF-α)、巨噬细胞趋化蛋白 (MCP-1)等炎症因子[12~14],这些炎症因子与脂肪组织和其他组织细胞的模式识别受体、经典细胞因子受体结合,干扰机体的糖、脂正常代谢及损害肾脏功能。
鉴于IL-6、IL-18与DKD发生发展的密切相关性,强化代谢控制可能通过降低与DKD进展密切相关的炎症因子IL-6、IL-18水平,从而延缓T2DKD患者病情的进展。
参考文献
[1] 崔燕,王慧敏,魏玮.老年慢性肾脏病的常见病因及首发症状分析[J].中国全科医学,2012,15(4B):1244-1245.
[2] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013年版)[J].中国糖尿病杂志,2014,22(8):2-22.
[3] KDOQI.KDOQI Clinical Practice Guidelines and Clinical Practice Recommendations for Diabetes and Chronic Kidney Disease[J].Am J Kidney Dis,2007,49(2 Suppl 2):S12-154.
[4] 翁建平.对糖尿病流行病学循证医学及基础研究的探索[J].中山大学学报(医学科学版),2010,31(2):166-171,178.
[5] Antonioli L,Blandizzi C,Pacher P,et al.Immunity,inflammation and cancer:a leading role for adenosine[J].Nat Rev Cancer,2013,13(12):842-857.endprint
[6] Csóka B,KoscsóB,Toro G,et al.A2B adenosine receptors prevent insulin resistance by inhibiting adipose tissue inflammation via maintaining alternative macrophage activation[J].Diabetes,2014,63(3):850-866.
[7] Tan KC,Chow WS,Tam SC,et al.Atorvastatin lowers C-reactive protein and improves endothelium-dependent vasodilation in type 2 diabetes mellitus[J].J Clin Endocrinol Metab,2002,87(2):563-568.
[8] Tan KC,Wat NM,Tam SC,et al.C-reactive protein predicts the deterioration of glycemia in chinese subjects with impaired glu-cose tolerance[J].Diabetes Care,2003,26(8):2323-2328.
[9] Canivell S,Gomis R.Diagnosis and classification of autoimmune diabetes mellitus[J].Autoimmun Rev,2014,13(4-5):403-407.
[10] American Diabetes Association.Diagnosis and classification of diabetes mellitus[J].Diabetes Care,2013,36(Suppl 1):S67-74.
[11] Elsherbiny NM,Abd El Galil KH,Gabr MM,et al.Renoprotective effect of NECA in diabetic nephropathy:implication of IL-18 and ICAM-1[J].Eur Cytokine Netw,2012,23(3):78-86.
[12] 李燕云,唐偉.非诺贝特在治疗糖尿病肾病中的作用的研究进展[J/OL].中华临床医师杂志(电子版),2013,7(6):2595-2597.
[13] 杨姗姗,胡秀芬,温宇.脂毒性-炎症反应与胰岛素抵抗的关系研究进展[J].生理科学进展,2011,42(2):112-116.
[14] Staiger H,Staiger K,Stefan N,et al.Palmitate induced interleukin-6 expression in human coronary artery endothelial cells[J].Diabetes,2004,53(12):3209-3216.
[15] Najafian B,Alpers CE,Fogo AB.Pathology of human diabetic nephropathy[J].Contrib Nephrol,2011,170:36-47.
(收稿日期:2017-07-02修回日期:2017-08-25)
(编辑:潘明志)endprint

