解淀粉芽孢杆菌L-H15的促生与抗病特性研究
张 莹 秦宇轩 尚庆茂 张志刚 赖孟瑄 李平兰
(1.中国农业大学食品科学与营养工程学院, 北京 100083; 2.中国农业科学院蔬菜花卉研究所, 北京 100081)
引言
植物根际促生菌(Plant growth promoting rhizobacteria,PGPR)是指附生于植物根际的生防微生物,一般能够促进植物生长,增强矿质营养吸收和利用,促进有益微生物的根际定殖,抑制有害微生物[1]。PGPR可以通过多种机制来促进植物的生长,如分泌植物激素、增强植物对水分和营养物质的吸收、固氮作用、分泌ACC脱氨酶(1-氨基环丙烷-1-羧酸脱氨酶)降解乙烯、溶磷作用、分泌铁载体等,并且还能够通过分泌一些抗菌物质来抑制病原菌的生长繁殖。目前已开发为生物防治剂和热门研究的PGPR主要为荧光假单胞菌(Pseudomonasfluorescens)和芽孢杆菌属(Bacillussp.)。
芽孢杆菌作为一种重要的植物根际促生菌,主要优势在于其能够产生抑制病原微生物的抗菌脂肽,主要包括Surfactin(表面活性素)、Iturin(伊枯草素)、Fengycin(丰原素)3大类[2]。此外,由于其具有产孢能力,能够在胞内形成抗逆性休眠体,具有耐热、紫外线、多种有机溶剂、酸、碱等多重抗逆性,作为生防菌具有理想的保存优势。因此,将具有良好促生抗病效果的芽孢杆菌开发成生物防治剂具有重要的实际应用价值。
解淀粉芽孢杆菌(Bacillusamyloliquefaciens) L-H15为实验室前期分离筛选自草炭土育苗基质中的一株优良的植物根际促生菌,该菌株能够分泌高活性抗菌脂肽,对草酸青霉(Penicilliumoxalicum)、串珠镰刀菌(Fusariummoniliforme)、尖孢镰刀菌(Fusariumoxysporum)和黑曲霉(Aspergillusniger)等病原真菌均有抑制作用[3]。为了进一步探究该菌株的生防潜力,本文主要分析菌株全基因组序列中与促生抗病相关的基因,测定菌株形成生物被膜、根际定殖、固氮溶磷解钾、分泌铁载体和植物激素等相关的促生抗病特性,证明该菌株具有良好的生防潜力,以期为该菌株的实际应用奠定理论基础。
1 材料和方法
1.1 试验材料
解淀粉芽孢杆菌(Bacillusamyloliquefaciens) L-H15,由中国农业大学食品科学与营养工程学院应用微生物研究室提供。
立枯丝核菌(Rhizoctoniasolani)和尖孢镰刀菌(Fusariumoxysporum)由中国农业微生物菌种保藏管理中心(ACCC)提供,编号分别为36124和37438。
黄瓜(CucumissativusL.)品种为“中农6号”,由中国农业科学院蔬菜花卉研究所提供。
1.2 基于全基因组测序的植物促生抗病相关基因分析
本实验室前期已经完成了解淀粉芽孢杆菌L-H15(GenBank:CP010556)的全基因组测序工作,利用NCBI网站(https:∥www.ncbi.nlm.nih.gov/)的基因组BLAST功能,将得到的全基因组测序结果中与标准菌株解淀粉芽孢杆菌FZB42(GenBank:CP000560)已报道的抗病促生相关的基因进行对比分析并注释。
1.3 菌株形成生物被膜能力的测定
将供试菌株培养至菌体数约为108CFU/mL后分别接种于新鲜的TSBG[4]和MSgg液体培养基中,按照每孔6 mL将菌液转至6孔细胞培养板中;将供试菌株菌液点接种于含有6 mL LB固体培养基的6孔细胞培养板上。将细胞培养板在30℃静置培养5 d,取出培养板后,观察在TSBG培养基底部的潜底型(submerged)生物被膜、MSgg表面的薄皮型(pellicle)生物被膜及在LB固体培养基表面的群落型(colony)生物被膜的形成情况。
1.4 菌株根际表面定殖能力的测定
参照IDRIS等[5]的方法,将培养至活菌数为108CFU/mL菌液用生理盐水洗涤2~3次后10倍稀释,吸取1 mL至垫有无菌水润湿的滤纸培养皿中,每皿放置15粒消毒的黄瓜种子,室温放置1 h后转至暗处,28℃生长4 d,待根长1 cm时,切取1 g置于9 mL无菌生理盐水中,涡旋1 min,平板计数。
1.5 菌株固氮、溶磷、解钾能力的测定
菌株固氮能力的定性测定:取5 μL菌液(活菌数108CFU/mL)点接种于无氮固体培养基[6]表面的灭菌滤纸片上,待菌液晾干后置于28℃培养箱中培养3 d,观察能否在选择培养基上生长。
菌株溶磷能力的测定:①定性测定:取5 μL菌液(活菌数108CFU/mL)点接种于PKO无机培养基[7]和蒙金娜有机培养基[8]表面的灭菌滤纸片上,待菌液晾干后置于28℃培养箱中培养3 d,观察有无溶磷圈,并根据溶磷圈的大小初步确定菌株解磷能力。②定量测定:将菌株以活菌数约为108CFU/mL按2%接种量(体积分数,下同)接种于液体培养基中,28℃、200 r/min培养5 d,以加入等量无菌水的培养基为对照,超声波破碎20 min后4℃、8 000 r/min离心10 min,取上清液采用钼锑抗比色法测定可溶性磷的含量。
菌株解钾能力的测定:①定性测定:取5 μL菌液(活菌数108CFU/mL)点接种于解钾筛选培养基[9]表面的灭菌滤纸片上,待菌液晾干后置于28℃培养箱中培养3 d,观察挑选大型、透明、隆起、有粘性的菌落,即为有解钾能力的菌株。②定量测定:将菌株以活菌数约为108CFU/mL按2%接种量于液体培养基中,37℃、200 r/min培养7 d,以加入等量无菌水的培养基为对照,超声破碎20 min后4℃、8 000 r/min离心10 min,取上清液采用原子吸收法测定钾的含量。
1.6 菌株分泌铁载体能力的测定
定性测定:采用双层平板法,下层平板采用CAS琼脂,按5 mL CAS检测液[10]+100 mL 1%的琼脂的比例混合;上层平板LB固体。取5 μL菌液(活菌数108CFU/mL)点接种于双层平板表面的灭菌滤纸片上,待菌液晾干后置于28℃培养箱中培养3 d后观察,若菌株产生铁载体,下层CAS平板应由蓝色变为橙色,根据橙色铁载体晕圈的大小初步确定菌株分泌铁载体的能力。
定量测定:MKB液体培养基[11]每瓶50 mL分装备用,2%接种量(菌株用生理盐水洗2次后加入),28℃,150 r/min培养48 h,3 500 r/min离心15 min,将pH值调至6.8后取3 mL上清液与3 mL CAS检测液混合均匀,室温下反应1 h,以去离子水作为对照调零,测定630 nm波长处的吸光度,以未接菌的MKB液体培养基上清液作为空白对照,菌株铁载体的相对表达量计算公式为
式中X——铁载体的相对表达量
Ar——待测样的吸光度,OD
As——空白对照的吸光度,OD
1.7 菌株分泌植物激素能力的测定
采用双抗夹心酶联免疫吸附法(Sandwich ELISA)测定菌株分泌吲哚乙酸(IAA)、细胞分裂素(CTK)和赤霉素(GA)这3种植物激素的能力。将供试菌株(活菌数108CFU/mL)以0.5%的接种量在LB液体培养基中37℃、200 r/min培养6、12、24、36、48 h,3 000 r/min离心20 min,取上清液作为待测样品。具体操作参照ELISA试剂盒说明书进行测定。
1.8 菌株抑菌能力的测定
将病原真菌转接至PDA平板中央。采用对峙法将供试菌株菌液(活菌数108CFU/mL)5 μL点接在距病原真菌菌饼2.5 cm处的无菌滤纸片上,以LB液体培养基为对照,28℃培养。当对照平板中病原真菌爬满平板时计算抑制率,立枯丝核菌培养4 d,尖孢镰刀菌培养7 d后,测量抑菌带直径,抑菌带直径为抑菌圈直径与拮抗菌菌落直径的差值。
2 结果与分析
2.1 基于全基因组测序的植物促生抗病相关基因分析
基于NCBI网站上的BLAST功能比较分析,解淀粉芽孢杆菌L-H15与标准菌株FZB42在植物促生抗病相关的典型基因上具有很大的相似性,L-H15具有全部FZB42中已知功能的与植物互作相关的基因,具体注释结果如表1~5所示。

表1 与根际定殖、集群运动、生物被膜形成相关基因Tab.1 Genes involved in root colonization, swarming motility and biofilm formation

续表1

表2 与植物可利用矿质元素相关基因Tab.2 Genes involved in mineral availability for plants

表3 与植物生长调节和诱导系统抗性相关基因(植物激素及其他成分)Tab.3 Genes involved in production of plant growth regulators and induced systemic resistance

表4 与植物环境胁迫的抗逆能力相关基因Tab.4 Genes involved in response to environmental stress

表5 与抑菌功能相关基因Tab.5 Genes involved inantibiosis
2.2 L-H15形成生物被膜的能力
采用定性观察的方式来确定解淀粉芽孢杆菌L-H15是否具有形成生物被膜的能力,试验结果如图1所示。L-H15不能够在TSBG液态培养基的底部形成潜底型生物被膜,只能够在培养基表面聚集形成物明显褶皱状的薄皮型生物被膜;而在MSgg液态培养基与LB固体培养基的表面,L-H15都能够形成表面凹凸不平、布满褶皱、立体结构较为复杂的薄皮型生物被膜和群落型生物被膜。

图1 L-H15形成生物被膜的能力Fig.1 Biofilm formation capability of L-H15
2.3 L-H15的根系表面定殖能力
通过活菌计数的方式测定解淀粉芽孢杆菌L-H15的根系在根系表面定殖的活菌数为1.39×105CFU/g,根据IDRIS等[5]的研究,超过105CFU/g可认为该菌株具有在黄瓜植株根系表面定殖的能力。
2.4 L-H15的固氮、溶磷、解钾能力
L-H15的固氮能力:将解淀粉芽孢杆菌L-H15接种于无氮培养基上,结果如图2e所示,L-H15能够在无氮培养基上生长且长势良好,说明该菌株具有一定的固氮能力,但其具体的固氮能力需要进一步通过定量试验进行测定。
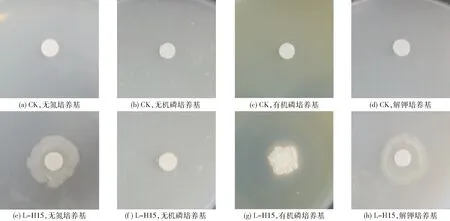
图2 L-H15在无氮培养基、无机磷培养基、有机磷培养基及解钾培养基上的生长情况Fig.2 Growth of L-H15 on nitrogen free medium plate, inorganic phosphorus medium plate, organic phosphorus medium plate and potassium solubilization medium plate
L-H15的溶磷能力:①定性试验:本试验将解淀粉芽孢杆菌L-H15接种于无机磷培养基及有机磷培养基上,结果如图2f、2g所示,L-H15在无机磷培养基上无明显的透明圈,说明该株菌无较强的溶解无机磷的能力;而在有机磷培养基上有显著的透明圈,说明该菌株有较强的溶解有机磷能力。②定量试验:本试验采用钼锑抗比色法进行测定,L-H15对无机磷溶解量为(10.37±0.97) μg/mL,验证了定性试验中该菌株溶解无机磷的能力较弱的结果;而在溶解有机磷能力方面,该菌株对有机磷能力的溶解量为(-26.77±0.57) μg/mL,为负值,即L-H15培养液中可溶性磷的含量小于空白培养液,但L-H15定性试验的结果显示其具有溶解有机磷的能力,所以推测可能是由于L-H15虽然具有很强的溶解有机磷能力但其对有机磷的利用能力和需求也很强,所以检测值会小于空白对照。赵小蓉等[33]也发现某些微生物细胞能够以多聚磷酸盐的形态贮藏磷,用氯仿进行熏蒸处理时,这部分磷会从细胞中释放出来。
L-H15的解钾能力:①定性试验:将解淀粉芽孢杆菌L-H15接种于解钾培养上,结果如图2h所示,L-H15能够在解钾培养基上生长,但均无明显的隆起状态,推测该菌株无明显的解钾能力。②定量试验:采用原子吸收法进行测定,L-H15对钾的溶解量为(2.00±0.40) μg/mL,验证了定性试验中该菌株解钾能力较为微弱的结果。
2.5 L-H15分泌铁载体的能力
定性试验:将解淀粉芽孢杆菌L-H15接种于CAS双层平板上,结果如图3所示,解淀粉芽孢杆菌L-H15能够在CAS检测平板上产生橙色铁载体晕圈,说明该菌株具有分泌铁载体的能力。

图3 L-H15在CAS检测平板上的显色情况Fig.3 Coloration of L-H15 on CAS test plate
定量试验:采用CAS检测法测定菌株分泌铁载体的能力,L-H15分泌铁载体的相对表达量为(60.22±0.01)%,根据赵翔等[34]的研究结果,铁载体相对表达量超过50%可认为其作为植物根际促生菌具有较强分泌铁载体的能力。
2.6 L-H15产植物激素能力的测定
采用ELISA试剂盒测定解淀粉芽孢杆菌L-H15产生植物激素的能力,由图4可知, 解淀粉芽孢杆菌L-H15具有分泌IAA、CTK、GA这3种植物激素的能力。在LB液体培养基中,培养时间为12 h时,L-H15分泌IAA的量最多,可达61.35 pmol/L;培养时间为24 h时,分泌CTK的量最多,可达48.93 ng/mL;培养时间为36 h时,分泌GA的量最多,可达82.46 pmol/L。而随着培养时间的延长,这3种植物激素的含量均出现逐渐降低的现象。
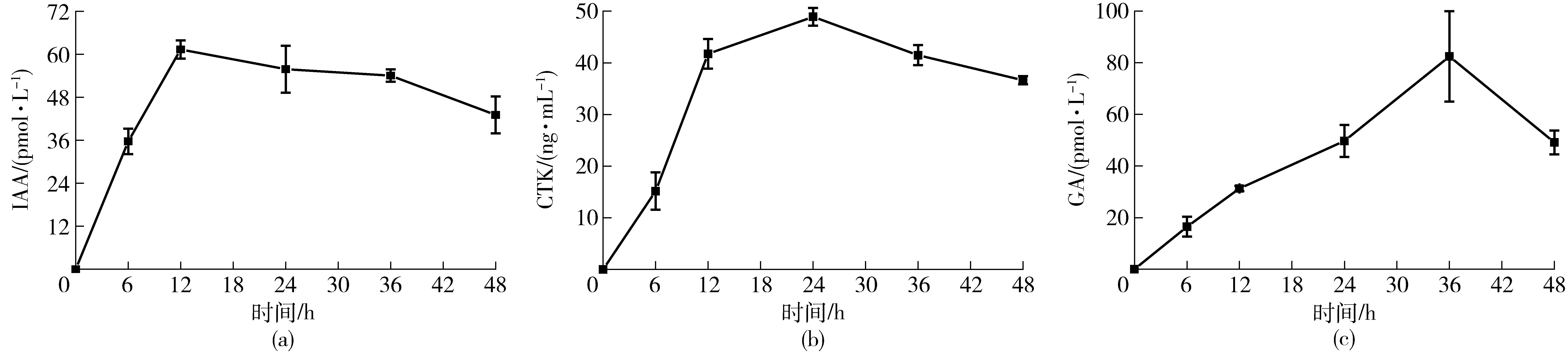
图4 L-H15分泌IAA、CTK和GA的能力Fig.4 Capabilities of L-H15 to produce IAA, CTK and GA
2.7 L-H15的抑菌能力
采用平板对峙法测定L-H15的抑菌能力,抑菌效果见图5,解淀粉芽孢杆菌L-H15对尖孢镰刀菌和立枯丝核菌均有较强的抑制效果。其中,L-H15拮抗立枯丝核菌能力较强,抑菌带直径为(8.67±1.15) mm,而拮抗尖孢镰刀菌的能力相对较弱,抑菌带直径为(2.50±0.50) mm。

图5 L-H15对立枯丝核菌、尖孢镰刀菌的抑菌效果Fig.5 Inhibiting effects of L-H15 against Rhizoctonia solani and Fusarium oxysporum
3 讨论
3.1 基于全基因组测序的植物促生抗病相关基因分析
基于全基因组序列分析的结果说明,解淀粉芽孢杆菌L-H15具有与植物互作相关的基因。该菌株的基因组中包含与生物被膜形成相关的一套完整的基因及基因簇,例如其中非常重要的产孢的全局调控因子spo0A及生物被膜重要组分胞外多糖合成操纵子epsA-O,说明从基因的角度上分析,该菌株具有形成生物被膜的能力,且能够在植物根系表面定殖,发挥其生防作用;L-H15含有植酸酶基因phy和合成Bacillibactin(嗜铁素)的dhb操纵子,能够促进植物对于矿质元素的吸收;L-H15含有合成植物生长素IAA的关键基因dhaS、ysnE和yhcX,以及合成2,3-丁二醇的关键基因alsD、alsS和alsR,促进植物生长并且诱导植物产生抗性;L-H15含有的非核糖体合成酶srfA操纵子、bmy操纵子和fen操纵子分别合成Surfactin、Bacillomycin D和Fengycin,含有的bac操纵子能够合成二肽类抗生素Bacilysin,含有聚酮类合成酶mln操纵子、bae操纵子和dfn操纵子分别合成Macrolactin、Bacillaene和Difficidin,这些物质均能够起到抑制病原微生物的作用。综合以上分析结果表明,解淀粉芽孢杆菌L-H15从基因分析的角度上均具有促生抗病的能力,作为植物生防菌具有很大的应用潜力。
3.2 解淀粉芽孢杆菌L-H15形成生物被膜及根际定殖的能力
在自然环境中,植物的生长与微生物密切相关,植物根系分泌营养物质促进微生物的生长并驱使微生物在根系表面形成结构复杂的生物被膜,牢固地定殖于植物根系[35]。因此,植物根际促生菌的根系定殖能力是起到生防作用的前提,是限制植物根际促生菌发挥促生作用的重要因素,是植物根际促生菌拮抗作用和竞争作用的基础,而生物被膜则是根际定殖的重要表现形式。综上所述,衡量植物根际促生菌形成生物被膜及根际定殖能力具有非常重要的意义。本试验测定结果表明,解淀粉芽孢杆菌L-H15具有一定的形成生物被膜的能力及植物根系定殖能力,在实际应用于植物根际时具有发挥生防作用的潜力。
3.3 解淀粉芽孢杆菌L-H15分泌铁载体的能力
铁是植物生长必需的营养元素,但土壤中的铁多为氧化物,植物却只能吸收利用可溶性的铁离子。而一些植物根际促生菌具有分泌高特异螯合铁离子小分子化合物(分子量1 000)的能力,即分泌铁载体的能力[34]。植物根际促生菌分泌的铁载体所形成的铁-铁载体复合物具有可溶性,能被植物细胞外膜上的特异性受体识别和吸收,利于植物摄入铁元素,为植物的生长发育起到促进作用。此外,铁元素对于微生物来说也是生长必须的营养元素,而这些由植物根际促生菌分泌的铁载体能够与病原微生物争夺有限的铁营养,进而起到拮抗病原微生物的作用。本试验测定结果表明,解淀粉芽孢杆菌L-H15具有较强分泌铁载体的能力,具有良好的促生及抗病潜力。
3.4 解淀粉芽孢杆菌L-H15分泌植物激素的能力
植物激素是由植物自身代谢产生的一类有机物质,在低浓度的情况下调控着植物的多种发育及生理过程,如种子的萌发、叶绿体的分化、顶端优势、植物-病原菌间的互作、花和果实的发育以及叶片的衰老等生理过程。而研究表明,很多植物根际促生菌会通过分泌植物激素的方式直接起到促进植物生长的作用,例如Acetobacterdiazotrophicus和Herbaspirillumseropedicae具有分泌吲哚乙酸(IAA)的能力[36];Azospirillumsp.具有分泌细胞分裂素(CTK)的能力[37];Azospirillumlipoferumop33具有分泌赤霉素(GA3)的能力[38]。这些植物激素经由定殖在植物根系表面及内部的植物根际促生菌分泌并且被植物根系吸收,进而起到调节植物生长发育的作用。本试验测定结果表明,解淀粉芽孢杆菌L-H15具有分泌IAA、CTK、GA这3种植物激素的能力,在促进植物生长方面具有极大的应用潜力。
4 结束语
通过对解淀粉芽孢杆菌L-H15的促生抗病特性研究,确定了L-H15具有与植物互作相关的基因,从基因分析的角度上具有促生抗病的潜力。通过对L-H15促生抗病相关特性测定的结果可以确定,该菌株具有形成生物被膜的能力,且在根系表面定殖的菌数超过105CFU/g,分泌铁载体的相对表达量为60.22%,分泌IAA、CTK和GA的含量最多可达到61.35 pmol/L、48.93 ng/mL和82.46 pmol/L,对立枯丝核菌和尖孢镰刀菌的抑菌带直径分别为(8.67±1.15) mm和(2.50±0.50) mm。综上所述,解淀粉芽孢杆菌L-H15具有多重促生抗病能力,具有良好的生防潜力及未来开发成植物促生菌剂的商业应用价值。当然,该菌株的具体促生抗病机制及实际生防应用效果需要进一步的研究与验证。
1 KLOEPPER J W. Plant growth-promoting rhizobacteria as biological control agents[M]∥METTING F B Jr. Soil Microbial Ecology:Applications in Agricultural and Environmental Management. New York:Marcel Dekker, Inc., 1992: 255-274.
2 CHEN H, WANG L, SU C X, et al. Isolation and characterization of lipopeptide antibiotics produced byBacillussubtilis[J]. Letters in Applied Microbiology, 2008, 47(3): 180-186.
3 韩玉竹, 邓钊, 张宝, 等. 解淀粉芽孢杆菌H15产抗菌肽的发酵和提取条件[J]. 食品科学, 2015, 36(15): 135-141.
HAN Yuzhu, DENG Zhao, ZHANG Bao, et al.Fermentation and extraction technology for antifungal peptides production byBacillusamyloliquefaciensH15[J]. Food Science, 2015, 36(15): 135-141. (in Chinese)
4 FOULSTON L, ELSHOLZ A K, DEFRANCESCO A S, et al. The extracellular matrix ofStaphylococcusaureusbiofilms comprises cytoplasmic proteins that associate with the cell surface in response to decreasing pH[J]. mBio, 2014, 5(5): e01667-14.
5 IDRIS H A, LABUSCHAGNE N, KORSTEN L. Screening rhizobacteria for biological control ofFusariumroot and crown rot of sorghum in Ethiopia[J]. Biological Control, 2007, 40(1): 97-106.
6 孙建光, 张燕春, 徐晶, 等. 高效固氮芽孢杆菌筛选及其生物学特性[J]. 中国农业科学, 2009, 42(6): 2043-2051.
SUN Jianguang, ZHANG Yanchun, XU Jing, et al. Isolation and biological characteristic investigation on efficient nitrogen-fixing bacilli[J]. Scientia Agricultura Sinica, 2009, 42(6): 2043-2051. (in Chinese)
7 张小兰, 韦中, 梅新兰, 等. 一种基于根际定殖能力筛选溶磷菌的方法[J]. 南京农业大学学报, 2014, 37(2): 79-84.
ZHANG Xiaolan, WEI Zhong,MEI Xinlan, et al. A method for screening phosphate solubilizing bacteria based on the rhizosphere colonization ability of strains[J]. Journal of Nanjing Agricultural University, 2014, 37(2): 79-84. (in Chinese)
8 MEHTA S, NAUTIYAL C S. An efficient method for qualitative screening of phosphate-solubilizing bacteria[J]. Current Microbiology, 2001, 43(1): 51-56.
9 阳洁, 江院, 王晓甜, 等. 几株高效溶磷解钾药用稻内生固氮菌的筛选与鉴定[J]. 农业生物技术学报, 2016, 24(2): 186-195.
YANG Jie, JIANG Yuan, WANG Xiaotian, et al. Screening and identification of several endophytic diazotrophs with high capability of phosphate solubilizing and potassium decomposing fromOryzaofficinalis[J]. Journal of Agricultural Biotechnology, 2016, 24(2): 186-195. (in Chinese)
10 SCHWYN B, NEILANDS J B. Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry, 1987, 160(1): 47-56.
11 王平, 董飚, 李阜棣, 等. 小麦根圈细菌铁载体的检测[J]. 微生物学通报, 1994, 21(6): 323-326.
WANG Ping, DONG Biao, LI Fudi, et al. Detection and determination of the siderophores produced by wheat rhizobacteria[J]. Microbiology China, 1994, 21(6): 323-326. (in Chinese)
12 BEZZATE S, AYMERICH S, CHAMBERT R, et al. Disruption of thePaenibacilluspolymyxalevansucrase gene impairs its ability to aggregate soil in the wheat rhizosphere[J]. Environmental Microbiology, 2000, 2(3): 333-342.
13 WIPAT A, HARWOOD C R. TheBacillussubtilisgenome sequence: the molecular blueprint of a soil bacterium[J]. FEMS Microbiology Ecology, 1999, 28(1): 1-9.
14 STRAIGHT P D, WILLEY J M, KOLTER R. Interactions betweenStreptomycescoelicolorandBacillussubtilis: role of surfactants in raising aerial structures[J]. Journal of Bacteriology, 2006, 188(13): 4918-4925.
15 KEARNS D B, CHU F, RUDNER R, et al. Genes governing swarming inBacillussubtilisand evidence for a phase variation mechanism controlling surface motility[J]. Molecular Microbiology, 2004, 52(2): 357-369.
16 HEERKLOTZ H. Interactions of surfactants with lipid membranes[J]. Quarterly Reviews of Biophysics, 2008, 41(3-4): 205-264.
17 TSUGE K, OHATA Y, SHODA M. GeneyerP, involved in surfactin self-resistance inBacillussubtilis[J]. Antimicrobial Agents & Chemotherapy, 2001, 45(12): 3566-3573.
18 BRANDA S S, GONZALEZPASTOR J E, BENYEHUDA S, et al. Fruiting body formation byBacillussubtilis[J]. Proceedings of the National Academy of Sciences, 2001, 98(20): 11621-11626.
19 STANLEY N R, BRITTON R A, GROSSMAN A D, et al. Identification of catabolite repression as a physiological regulator of biofilm formation byBacillussubtilisby use of DNA microarrays[J]. Journal of Bacteriology, 2003, 185(6): 1951-1957.
20 KEARNS D B, CHU F, BRANDA S S, et al. A master regulator for biofilm formation byBacillussubtilis[J]. Molecular Microbiology, 2005, 55(3): 739-749.
21 BRANDA S S, GONZALEZPASTOR J E, DERVYN E, et al. Genes involved in formation of structured multicellular communities byBacillussubtilis[J]. Journal of Bacteriology, 2004, 186(12): 3970-3979.
22 CHU F, KEARNS D B, BRANDA S S, et al. Targets of the master regulator of biofilm formation inBacillussubtilis[J]. Molecular Microbiology, 2006, 59(4): 1216-1228.
23 IDRISS E E, MAKAREWICZ O, FAROUK A, et al. Extracellular phytase activity ofBacillusamyloliquefaciensFZB45 contributes to its plant-growth-promoting effect[J]. Microbiology, 2002, 148(7): 2097-2109.
24 CHEN X H, KOUMOUTSI A, SCHOLZ R, et al. Comparative analysis of the complete genome sequence of the plant growth-promoting bacteriumBacillusamyloliquefaciensFZB42[J]. Nature Biotechnology, 2007, 25(9): 1007-1014.
25 HOTTA K, KIM C Y, FOX D T, et al. Siderophore-mediated iron acquisition inBacillusanthracisand related strains[J]. Microbiology, 2010, 156(7): 1918-1925.
26 IDRIS E E, IGLESIAS D J, TALON M, et al. Tryptophan-dependent production of indole-3-acetic acid (IAA) affects level of plant growth promotion byBacillusamyloliquefaciensFZB42[J]. Molecular Plant-microbe Interactions: MPMI, 2007, 20(6): 619-626.
27 RYU C M, FARAG M A, HU C H, et al. Bacterial volatiles promote growth in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(8): 4927-4932.
28 ABRAMOVITCH R B, ANDERSON J C, MARTIN G B. Bacterial elicitation and evasion of plant innate immunity[J]. Nature Reviews Molecular Cell Biology, 2006, 7(8): 601-611.
29 MOYNE A L, SHELBY R, CLEVELAND T E, et al. Bacillomycin D: an iturin with antifungal activity againstAspergillusflavus[J]. Journal of Applied Microbiology, 2001, 90(4): 622-629.
30 HOFEMEISTER J, CONRAD B, ADLER B. Genetic analysis of the biosynthesis of non-ribosomal peptide- and polyketide-like antibiotics, iron uptake and biofilm formation byBacillussubtilisA1/3[J]. Molecular Genetics and Genomics, 2004, 272(4): 363-378.
31 CHEN X H, SCHOLZ R, BORRIS M, et al. Difficidin and bacilysin produced by plant-associatedBacillusamyloliquefaciensare efficient in controlling fire blight disease[J]. Journal of Biotechnology, 2009, 140(1-2): 38-44.
32 CHEN X H, VATER J, PIEL J, et al. Structural and functional characterization of three polyketide synthase gene clusters inBacillusamyloliquefaciensFZB42[J]. Journal of Biological Chemistry, 2006, 188(11): 4024-4036.
33 赵小蓉, 林启美, 孙焱鑫, 等. 细菌解磷能力测定方法的研究[J]. 微生物学通报, 2001, 28(1): 1-4.
ZHAO Xiaorong, LIN Qimei, SUN Yanxin, et al. The methods for quantifying capacity of bacteria in dissolving P compounds[J]. Microbiology China, 2001, 28(1): 1-4. (in Chinese)
34 赵翔, 谢志雄, 陈绍兴, 等. 适合高产铁载体细菌筛选、检测体系的改进与探析[J]. 微生物学通报, 2006, 33(6): 95-98.
ZHAO Xiang, XIE Zhixiong, CHEN Shaoxing, et al. Improvement and analysis in over-siderophores production bacteria filtrating and detecting[J]. Microbiology China, 2006, 33(6): 95-98. (in Chinese)
35 DAVEY M E, O’TOOLE G A. Microbial biofilms: from ecology to molecular genetics[J]. Microbiology & Molecular Biology Reviews: MMBR, 2001, 64(4): 847-867.
36 BASTIAN F, COHEN A, PICCOLI P, et al. Production of indole-3-acetic acid and gibberellins A1 and A3 byAcetobacterdiazotrophicusandHerbaspirillumseropedicaein chemically-defined culture media[J]. Plant Growth Regulation, 1998, 24(1): 7-11.
37 STRZELCZYK E, KAMPERT M, LI C Y. Cytokinin-like substances and ethylene production byAzospirillumin media with different carbon sources[J]. Microbiological Research, 1994, 149(1): 55-60.
38 BOTTINI R, FULCHIERI M, PEARCE D, et al. Identification of Gibberellins A1, A3, and Iso-A3in cultures ofAzospirillumlipoferum[J]. Plant Physiology, 1989, 90(1): 45-47.

