小麦热激转录因子基因TaHsfB2d的克隆和特性及其对耐热性的调控
赵立娜 刘子会 段硕楠 张园园,2 李国良,* 郭秀林,*
小麦热激转录因子基因的克隆和特性及其对耐热性的调控
赵立娜1,2,**刘子会1,**段硕楠1张园园1,2李国良1,*郭秀林1,*
1河北省农林科学院遗传生理研究所 / 河北省植物转基因中心重点实验室, 河北石家庄 050051;2河北师范大学生命科学学院, 河北石家庄 050024
植物热激转录因子(heat shock transcription factor, Hsf)是响应热胁迫的主要调节因子, 通过调节热激蛋白基因表达进而增强植物耐热性。小麦Hsf家族至少含有56个成员, 其中B族11个, 含B2亚族5个。本研究采用同源克隆技术, 从37°C热处理的二叶一心小麦幼叶中克隆获得(序列号为AK331994) cDNA序列, 序列长1191 bp, 编码396个氨基酸。蛋白序列包括DNA结合结构域DBD和核定位信号序列NLS。同源分析表明, TaHsfB2d蛋白与大麦未知蛋白的相似性最高, 为92%。荧光定量分析表明,在小麦多个组织器官中组成型表达, 其中在成熟植株根系中表达量较高。37°C热胁迫、外源水杨酸(SA)和H2O2处理均能不同程度上调的表达, 热激能显著增强SA和H2O2对表达的诱导。H2O2合成抑制剂DPI和羟自由基清除剂DMTU联合处理显著抑制热激对表达的上调作用、完全抑制SA对表达的上调。通过在洋葱内表皮瞬时表达并观察GFP荧光发现, 正常条件下, TaHsfB2d蛋白定位于细胞核。酵母中耐热性鉴定表明, 正常条件下, 转的酵母细胞与转空载体对照酵母细胞的长势没有明显差异, 热激处理同时降低, 但前者的长势相对更强,的导入不影响细胞的生长发育。推测通过水杨酸途径介导植株耐热性调控过程, 该过程依赖于H2O2存在。
小麦;; 定量表达; 亚细胞定位; 耐热性
植物热激蛋白(heat shock protein, Hsp)与植株耐热性密切相关, 而植物热激转录因子(heat shock transcription factor, Hsf)是热激蛋白基因及耐热性相关基因表达调控的中心环节, 是植物对高温胁迫反应的关键因子。自20世纪80年代后期酵母Hsf被首先克隆以来, 动植物多个物种的基因被相继获得[1-3]。热激转录因子在植物中普遍存在, 首个植物基因来自番茄[4]。与其他生物体相比, 植物是一个多基因家族, 依据结构分为A、B、C族和多个亚族。家族基因在不同物种中数目差异较大, 果蝇和酵母中只有1个, 而小麦中至少有56个[5], 远远多于已知的其他生物体。对该基因家族研究主要集中于模式植物的A1和A2亚族[6-8]。
B族的研究见报不多, 该族成员因不含激活结构域而不能直接激活下游基因的表达。早期研究认为其作用更多表现为抑制热响应基因的表达[9-10], 近年来越来越多的功能被报道。模式拟南芥中有5个B族, 其中和属于热诱导型, 主要在热激反应后期起作用, 但其热激诱导表达的前提是与HsfA1a和HsfA1b结合。和被定位在细胞核, 正常生长和热恢复阶段直接抑制热激转录因子的活性, 进而抑制一系列基因的表达, 从而钝化热激反应。但在热激条件下, HsfB1和HsfB2b可能通过抑制某些干扰HsfA1转移入核的基因的表达, 促进HsfA1进入核内而激活其的活性, 进而提高耐热能力[10], 表现出正向调控功能。和还参与的表达和抗病反应[11], 过表达可导致细胞死亡[12]。转鹰嘴豆的拟南芥表现较强的抗旱和耐热性[13]。组成型表达可降低节律相关基因Pseudo response regulator 7 (PRR7)的表达, 使植株延迟开花, 下胚轴伸长, 在调控逆境条件下植株生物钟变化方面起重要作用[14]。番茄作为共激活因子可增强和/或的活性, 热激条件下可保持和恢复某些重要基因或持家基因的表达[15-16]。另外, 过表达拟南芥可特异性诱导根系发育[17], 水稻可通过结合特异HSE (Heat shock elements, HSE)而调控病程防御反应[18]。可见, B族Hsf在植物抗逆、抗病过程中也发挥着重要的调控作用, 随着研究的逐步深入, 越来越多B族的特性和功能将得以解析。
小麦的研究起步晚, 对其家族基因及个体特性和功能了解甚少。Qin等[19]利用材料TAM107 (耐热)和中国春(热敏感)研究热胁迫条件下的基因表达谱, 共鉴定6560个热胁迫响应基因, 包括7个热激转录因子, 其中一个转录因子在40°C热胁迫后上调表达128倍, 暗示该类基因在小麦耐热性中的调控作用。Shim报道[20]小麦受镉胁迫上调, 参与小麦耐镉反应。Chauhan等[21]从小麦种子中克隆了基因, 并将其转入拟南芥, 转基因植株耐高温、耐盐和抗旱性提高, 中等高温条件下生长植株能积累相对较高的生物量和产量。Zhang等[22]在拟南芥中过表达小麦基因中发现, 转基因植株耐热性和抗冻性提高。Xue等[5]利用电子表达技术, 从小麦中识别出A、B、C家族的56个成员, 多个基因组成型表达, A2、B2和A6亚族基因受热激显著上调;直接调控小麦和类基因, 并增强植株耐热性。
本实验室在多年研究玉米的基础上, 克隆获得小麦的完整编码序列, 并研究了该基因的表达模式、亚细胞定位以及在高温胁迫响应过程中的作用, 为进一步解析的生物学功能及调控机制提供理论依据, 同时也为小麦耐热性遗传改良挖掘优异基因资源。
1 材料与方法
1.1 材料培养
沧6005为半冬性小麦品种, 晚熟, 耐热性较强, 由河北省沧州市农业科学院提供。精选的种子经表面消毒, 再用自来水反复冲洗, 浸泡吸胀12 h后, 播至Hoagland营养液中, 置25°C培养箱中培养。待二叶一心时进行不同处理, 取样进行表达分析。另于2015年10月上旬播种于河北省农林科学院大河试验站, 常规种植, 不同生育期取样并于液氮中速冻, 用于组织器官表达分析。
1.2 热胁迫处理
参照李慧聪等[23]描述的方法进行热胁迫处理, 方法略有改进。将小麦幼苗培养在Hoagland营养液中, 将生长一致的幼苗分为7组进行不同处理, 以25°C正常生长的幼苗作对照。第1组热胁迫处理, 营养液于37°C培养箱预热, 第2组在培养液中加入水杨酸(0.8 mmol L–1), 第3组在培养液中加入H2O2(10 mmol L–1), 处理时间为0.5、1、1.5、2和4 h; 第4组先用0.8 mmol L–1水杨酸预处理1.5 h, 再移至与第2组成分相同培养液中, 37°C热处理1.5 h; 第5组先用10 mmol L–1H2O2预处理1.5 h, 然后移入与第3组成分相同营养液中, 37°C热处理1.5 h; 第6组经150 µmol L-1二苯基碘(diphenylene iodonium, DPI)和20 mmol L–1二甲基硫脲(dimethylthiourea, DMTU)预处理2 h; 第7组经150 µmol L-1二苯基碘(diphenylene iodonium, DPI)和20 mmol L–1二甲基硫脲(dimethylthiourea, DMTU)预处理2 h后, 于37°C培养箱中热激处理1 h; 第8组经150 µmol L-1二苯基碘(diphenylene iodonium, DPI)和20 mmol L–1二甲基硫脲(dimethylthiourea, DMTU)预处理2 h后, 用0.8 mmol L–1水杨酸处理1.5 h。DPI为H2O2合成抑制剂, DMTU为羟自由基清除剂。所有处理均取第2展开叶, 液氮速冻, 用于RNA提取。
1.3 TaHsfB2d的cDNA序列扩增与测序
采用RNArose Reagent Systems试剂盒(上海华舜生物工程公司)提取总RNA, 经DNaseI(TaKaRa)处理除去残留的基因组DNA, 然后取1 μg RNA, 用SuperScript IV First-Strand Synthesis System反转录试剂盒(Invitrogen)合成cDNA第一链。设计特异引物(F: 5′-ATCGGGAAGCTACTACGGGGTTC-3′; R: 5′-GCTTCTACAACATCGTCCAC-3′), 利用高保真酶Pyrobest (TaKaRa)进行PCR扩增。PCR体系25 µL, 含10× Pyrobest buffer 2.5 µL、dNTP mixture (2.5 mmol L-1) 2 µL、1st strand cDNA 2 µL、20 µmol L-1forward primer 0.25 µL、20 µmol L-1reverse primer 0.25 µL、pyrobest DNA polymerase 0.25 µL和ddH2O 17.75 µL。反应程序为98°C 10 s, 55°C 15 s, 72°C 2 min, 30个循环。将扩增产物连接T载体(pEasy-Blunt Simple Cloning Kit, TransGen Biotech)后, 送上海生工生物工程技术服务有限公司测序。
1.4 qRT-PCR分析
依据Xue等[5]对小麦的分析结果, 设计的特异引物(F: 5′-CGTCTCCATCGGGCT GAA-3′; R: 5¢-CGTCGCCGTCTTCTTCCTC-3′), 内参基因为(F: 5¢-GCACACGTGCTTTGCAGA TAAG-3¢; R: 5¢-GCCCTCAAGCTCAACCATAACT- 3¢)。PCR体系20 µL, 含SYBR Premix ExII 10 µL、10 µmol L–1Forward primer 0.8 µL、10 µmol L–1Reverse primer 0.8 µL、1st strand cDNA 1 µL和ddH2O 7.4 µL。反应在7500 Real-time PCR System (Applied Biosystems, USA)上进行PCR, 反应程序为预变性95°C 10 min; 变性 95°C 5 s; 退火/延伸60°C 1 min, 45个循环。反应结束后, 采用2–ΔΔCt法分析数据。每组实验设3个生物学样本, 每个生物学样本设3次技术重复。数据为3个生物学重复平均值±标准误, 组织表达试验以幼根表达量为1, 其余设置0 min的表达量为1。
1.5 TaHsfB2d亚细胞定位分析
带有绿色荧光蛋白()基因的植物表达载体pJIT163-hGFP (由中国科学院遗传与发育生物学研究所范仁春博士提供)通过35S启动子驱动目的基因和基因的融合表达[24], 显示目的蛋白的亚细胞定位。通过设计特异引物(F: 5′-GAGAACACGGGGG ACTCTAGAATGTCGGCCGAGCAT-3′; R: 5′-GCCC TTGCTCACCATGGATCCCCTCGAGTTGGATCT-3′), 扩增编码区, 产物经限制性内切酶d III和H I消化后, 连接到表达载体pJIT163- hGFP上。参照李慧聪等[25]描述的方法进行金粉包埋和基因枪转化。经瞬时表达处理的洋葱表皮细胞于22°C暗培养16 h, 然后放入浓度为10 µg mL–1的4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole, DAPI)染色液中染色3~5 min, 用生理盐水冲洗干净, 于激光共聚焦显微镜(Zeiss META510)下观察荧光。
1.6 构建酵母表达载体
酵母表达载体pYES2 (Invitrogen, 美国)用于酿酒酵母中目的蛋白的表达, 其特点在于GAL1启动子能够在酿酒酵母中被半乳糖高水平诱导从而驱动目的蛋白表达, 同时能够被葡萄糖抑制表达, 可利用URA3基因筛选带有基因型的酵母宿主菌株转化子。结合ClonExpress II重组反应系统(诺唯赞生物科技有限公司)设计扩增特异引物(F: 5¢-GGGAATATTAAGCTTGGTACCATGGCGGCCGAGCATGGC-3¢; R: 5¢-TGATGGATATCTGCAGAATT CTCAACCTCGAGTTGGATCT-3¢), 利用高保真PCR聚合酶扩增, 获得的PCR产物。利用限制性内切酶I和R I (NEB公司)对载体pYES2进行酶切, 电泳后回收得到线性化载体。将PCR产物与线性化载体按1∶2的摩尔比混合, 利用ClonExpress II快速克隆技术进行重组反应。于冰水浴中配制如下反应体系, 即4 µL 5× ClonExpress II buffer, 50~200 ng线性化载体, 20~200 ng插入片段扩增产物, 2 µL Exnase II, 加无菌水至总体积2 µL。混匀各组分后, 于37°C反应30 min, 之后立即置冰浴中冷却5 min, 然后利用热激法将反应产物直接转化大肠杆菌TOP10感受态细胞, 37°C倒置培养过夜。用无菌的牙签将单个菌落挑至100 µL新鲜的LB培养基中, 混匀, 取2 µL作为模板进行PCR扩增, 根据电泳条带大小选择正确的克隆进行序列测定。
1.7 TaHsfB2d在酵母中转化及耐热性鉴定
参照Gietz等[26]的方法, 将测序正确的重组载体转化酵母INVSc1感受态细胞, 然后将细胞均匀涂抹在SC-Glu-Ura-筛选平板上, 30°C培养2~3 d。采用菌落PCR方法鉴定阳性克隆。
分别以重组载体pYES2-TaHsfB2d和空载体pYES2转化酵母细胞INVSc1, 筛选阳性酵母克隆。分别挑选2个菌系的阳性克隆, 在SC-Glu-Ura-液体培养基振荡(250 r min–1)培养过夜, 检测OD600值。用SC-Glu-Ura-液体培养基将酵母菌液稀释到OD600值为0.2, 重新振荡(200 r min–1)培养2~3 h, OD600值达到0.4~0.8之间即酵母指数生长期, 离心收集菌体, 无菌水洗涤两遍, 除去培养基, 然后梯度稀释到0.1、0.05和0.01共3个OD值, 分成2组, 一组作为对照, 另一组于50°C水浴中热激处理15 min。吸取8 μL, 分别点在加入半乳糖的SC-Gal-Ura-固体培养基上, 30°C生长2~3 d, 观察并拍照。另外, 将指数生长期的酵母细胞稀释到SC-Gal-Ura-液体培养基中, 分成2组, 一组作为对照, 另一组于50°C水浴中热激处理45 min, 振荡(200 r min–1)培养24 h, 期间每间隔3 h测定一次OD600值, 计算生长速率。采用Microsoft Excel软件分析数据, 计算标准误差。采用SPSS 19.0统计方法分析差异显著性。
2 结果与分析
2.1 小麦热激转录因子TaHsfB2d的cDNA序列扩增与分析
将二叶一心小麦幼苗于37°C热胁迫处理1.5 h, 提取叶片总RNA, 以此为模板, 利用特异性引物, 扩增获得基因的cDNA序列(图1), 序列全长1191 bp, 编码396个氨基酸残基。通过结构分析发现, TaHsfB2d蛋白序列包含DNA结合结构域(DNA binding domain, DBD, NCBI网站分析, 下画线部分)和核定位信号序列KRAR (nuclear localization signal, NLS, NucPred软件分析)序列。蛋白相似性分析表明, TaHsfB2d蛋白与大麦未知蛋白(序列号为BAJ85352.1)、大麦HvHsfB2c (序列号为AEB 26596.1)和二穗短柄草BdHsfB2c (序列号为XP_ 003578478.1)的相似性分别为92%、85%和80% (图2)。

图1 小麦TaHsfB2d的核苷酸和氨基酸序列
下画线表示Hsf家族保守的DNA结合结构域; 灰色区域显示核定位信号序列(NLS)。
The conserved DNA binding domain of Hsf family is underlined, and the nuclear localization signal (NLS, KRAR) is in grey background.
2.2 小麦热激转录因子TaHsfB2d在不同组织器官中的表达
qRT-PCR分析发现, 在检测的小麦幼苗期根、茎和叶片, 开花期根、茎、叶片、雌雄蕊和萼片, 以及生育后期幼嫩和成熟种子中,均有不同程度表达, 与幼嫩根系中表达相比, 成熟根系中表达量最高, 为幼根的33倍; 幼茎和萼片中次之, 数值约达到18倍和15倍; 接近于幼嫩根系, 幼叶和雌蕊中的表达量较低(图3)。
2.3 不同逆境对小麦热激转录因子TaHsfB2d表达的调控
分别提取不同逆境胁迫下小麦幼苗叶片的总RNA, 定量分析表达量的变化表明, 37°C热处理(图4-A)、0.8 mmol L–1水杨酸(图4-B)和10 mmol L–1H2O2(图4-C)单独处理均能不同程度上调表达, 处理1.5 h时达到峰值, 最大表达量分别为正常对照的34、8和61倍, 热胁迫和H2O2处理诱导作用强于水杨酸处理, 处理4 h时,仍能保持较高的表达水平。
用水杨酸和H2O2预处理1.5 h后再于37°C热激(图4-D)发现, 热激能显著增强SA和H2O2对表达的诱导作用, 表达量约分别达到单独SA和H2O2处理时的19.5倍和3.0倍, 该数值显著高于单独热胁迫处理。

图2 小麦TaHsfB2d编码蛋白与其他蛋白的相似性比较
NCBI同类蛋白包括大麦未知蛋白Hv predicted protein (BAJ85352.1)、大麦HvHsfB2c (AEB26596.1)和二穗短柄草BdHsfB2c (XP_003578478.1)。
Proteins for alignment in NCBI were Hv predicted protein (BAJ85352.1), HvHsfB2c (AEB26596.1), and BdHsfB2c (XP_003578478.1).
用150 µmol L–1H2O2合成抑制剂DPI和20 mmol L–1羟自由基清除剂DMTU联合处理2 h (图4-E),表达与正常对照差异不明显, 二者预处理后再热激1 h时,的表达显著低于单独热处理, 热激上调表达被显著抑制; 如果预处理后再用SA处理1.5 h,上调表达完全被抑制。
2.4 小麦热激转录因子TaHsfB2d的亚细胞定位
构建瞬时表达载体pJIT163-TaHsfB2d-hGFP并转化洋葱内表皮, 通过融合基因表达显示目的蛋白的亚细胞定位。利用激光共聚焦显微镜观察荧光发现, 正常条件下, 观察到GFP绿色荧光只分布在细胞核, 且与核特异染料DAPI荧光完全重合(图5), 表明TaHsfB2d蛋白定位于细胞核。
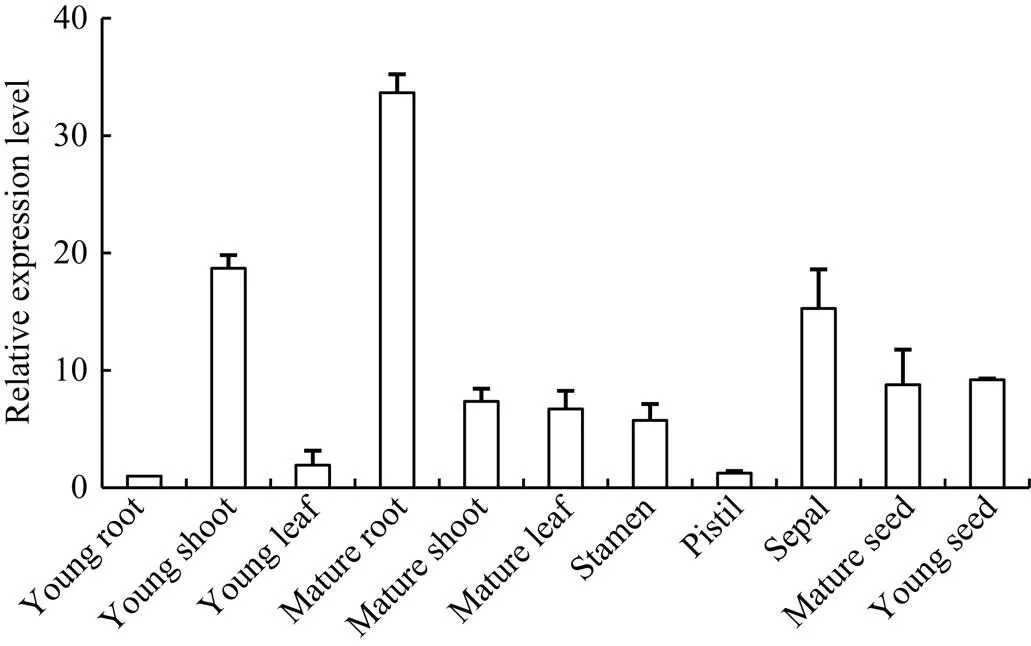
图3 TaHsfB2d在小麦不同组织器官中的定量表达
数据为3个生物学重复平均值±标准误。
Each bar value represents ± SD of triplicate experiments.
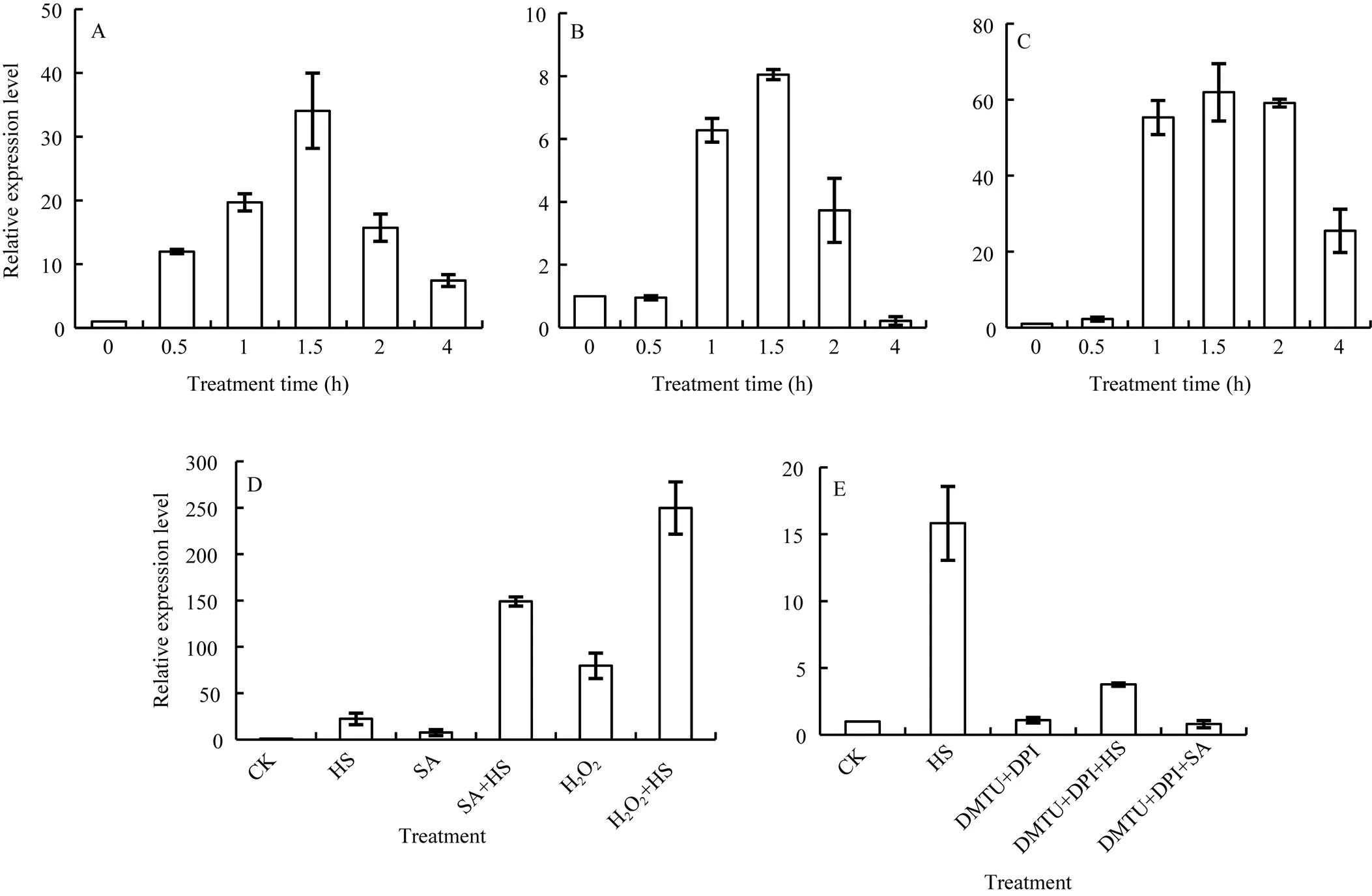
图4 37°C热胁迫, 0.8 mmol L–1 SA和10 mmol L–1 H2O2分别处理和联合处理对小麦叶片TaHsfB2d表达量的影响
A: 单独37°C热处理; B: 单独0.8 mmol L–1SA处理; C: 单独10 mmol L–1H2O2处理; D: SA和H2O2分别预处理1.5 h后再于37°C热激处理; E: H2O2合成抑制剂DPI和清除剂DMTU预处理2 h后, 再分别于37°C热激1 h和SA处理1.5 h。数据为3个生物学重复平均值±标准差。
A: HS at 37°C; B: 0.8 mmol L–1SA treatment; C: 10 mmol L–1H2O2treatment; D: HS at 37°C after pretreatment with SA and H2O2for 1.5 h, respectively; E: Treatments under 37°C heat shock for 1 h and 0.8 mmol L–1SA for 1.5 h, respectively, after pretreated with DPI and DMTU for 2 h. Each bar value represents mean±SD of triplicate experiments.
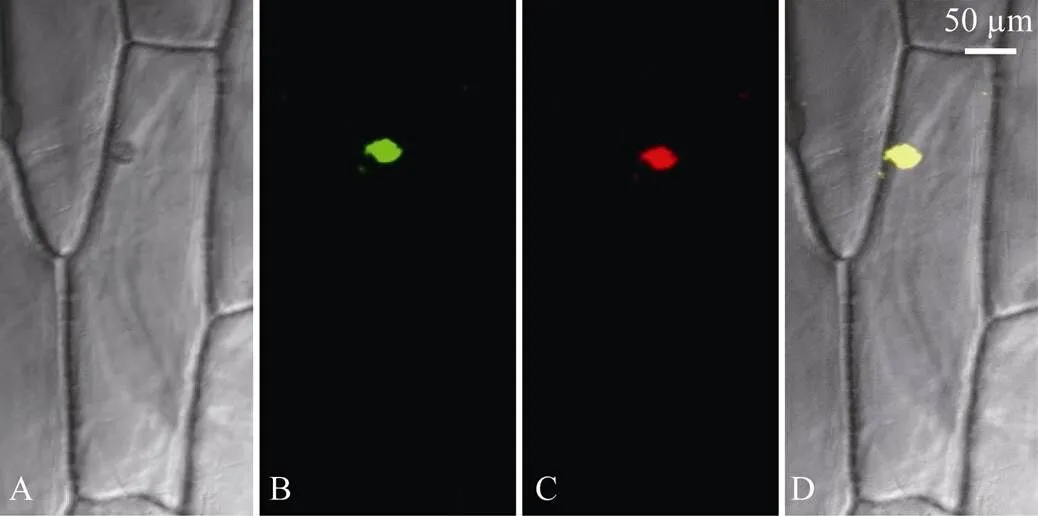
图5 小麦TaHsfB2d蛋白在洋葱表皮细胞中的亚细胞定位
A: 明视野下35S:TaHsfB2d-hGFP荧光; B: 35S:TaHsfB2d-hGFP绿色荧光; C: 35S:TaHsfB2d-hGFP的DAPI红色荧光; D: 叠加图像。
A: epidermal cells of onion expressing 35S:TaHsfB2d-hGFP under white light; B: epidermal cells of onion expressing 35S: TaHsfB2d-hGFP under green channel florescence; C: epidermal cells of onion expressing 35S: TaHsfB2d-hGFP under DAPI red florescence; D: merge of DAPI and green channel florescence.
2.5 小麦热激转录因子TaHsfB2d在酵母中的耐热性调控分析
将小麦在酵母中转化并进行热激处理,在正常生长条件下, 在半乳糖诱导培养基上, 转与转空载体pYES2的酵母细胞的长势和大小无明显差异(图6-A); 经50°C热激处理45 min后, 转基因酵母细胞和转空载体对照细胞的生长速度均受到抑制, 但是转基因酵母细胞的生长受抑制程度明显小于转空载体对照细胞, 细胞数目明显多于对照, 细胞大小没有明显差异(图6-B)。从酵母细胞生长曲线也可看出, 正常培养条件下转pYES2和pYES2-TaHsfB2d酵母细胞生长较快, 生长速度没有明显差异(图6-C); 50°C热激处理后细胞生长速度均降低, 但处理15 h后转pYES2- TaHsfB2d酵母细胞生长速率明显高于转空载体对照细胞(图6-D), 表明能在酵母细胞中被诱导表达, 且能显著提高酵母细胞的耐热性。
3 讨论
2014年, Xue等[5]通过生物信息学分析推测小麦中含有56个Hsf成员, 其中A、B、C族各占33个、11个和12个, B2亚族有5个, 多个基因呈组成型表达。关于小麦Hsf家族结构和个体功能了解甚少, 仅对、、()和进行了功能分析, 其中介导了小麦耐镉反应[20]; 转可提高拟南芥植株的耐热、耐盐和抗旱性[21]; 过表达可增强拟南芥植株的耐热和抗冻性[22]; 过表达可激活下游热激蛋白基因的表达[5]。
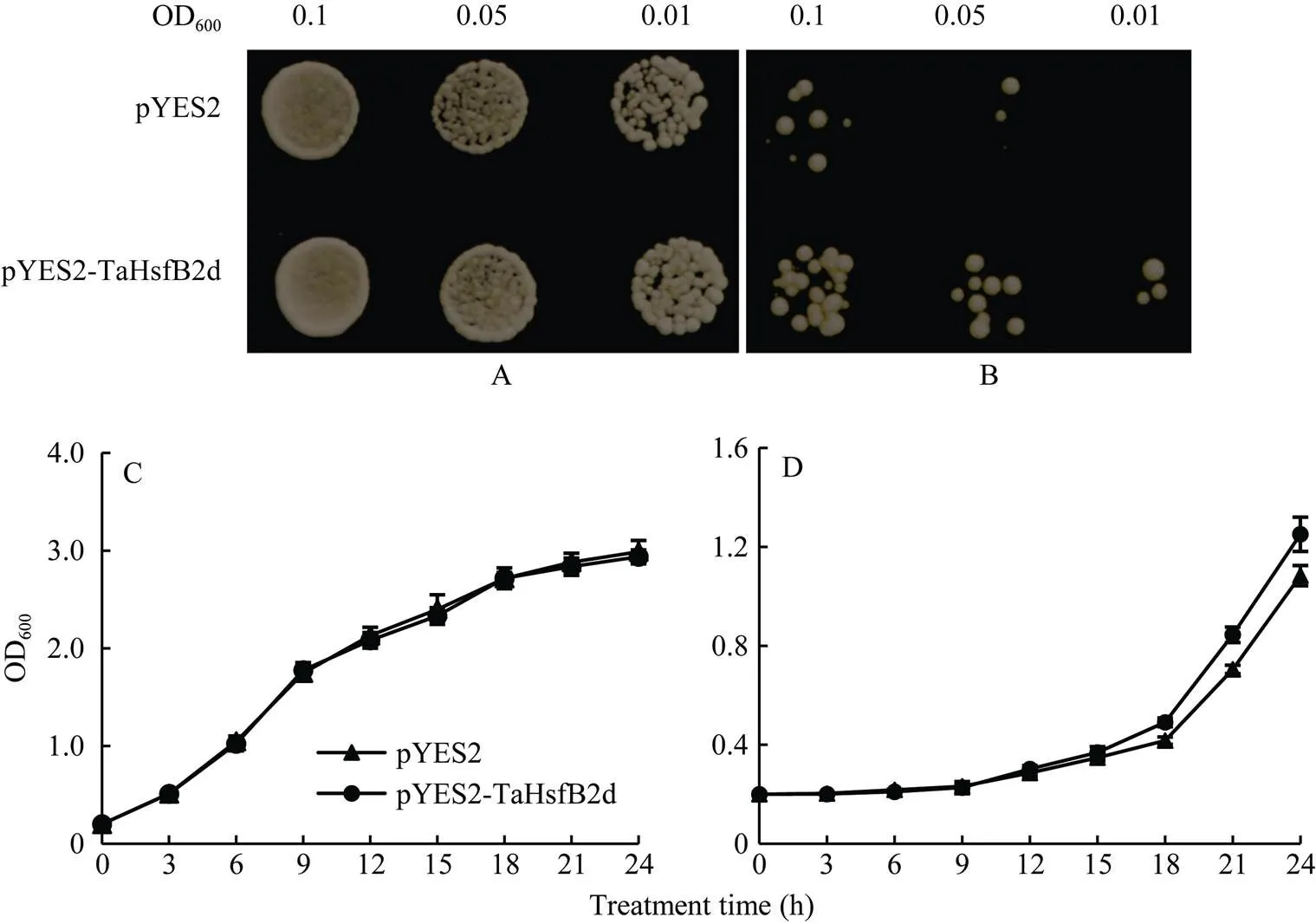
图6 正常培养和50°C热激处理转pYES2和pYES2-TaHsfB2d酵母细胞生长势比较
A: 30°C下正常生长, B: 50°C热胁迫45 min, 于30°C恢复生长3 d; C: 30°C下正常生长测定酵母细胞OD600值; D: 50°C热胁迫45 min后于30°C恢复生长测定酵母细胞OD600值。数据为3个生物学重复平均值±标准差。
A: culture at 30°C; B: HS at 50°C for 45 min, then culture at 30°C for 3 days; C: OD600of transformed yeast cells at 30°C; D: OD600of transformed yeast cells at 50°C for 45 min and then culture at 30°C. The error bar represents ±SD of triplicate experiments.
本实验室在前期研究玉米A1亚族[25,27]的基础上, 从小麦幼叶中克隆获得的cDNA序列, 分析表明, 该序列全长为1191个核苷酸, 编码396个氨基酸残基。蛋白质结构含有完整的DNA结合结构域和核定位信号序列, 正常生长条件下, TaHsfB2d蛋白定位在细胞核, 与小麦()定位保持一致。同源分析表明, TaHsfB2d蛋白与大麦未知蛋白的相似性最高, 达92%, 与大麦HvHsfB2c和二穗短柄草BdHsfB2c的相似性分别为85%和80%。拟南芥、番茄和大豆HsfB1的C末段均含有一段保守序列, 即11个氨基酸GEGLKLFGVWL的BRD抑制域, 为基因HsfB1抑制热诱导基因表达所必需[28-29]。但是, 作为HsfA1共激活因子, 番茄HsfB1依赖于C末段一段类组氨酸序列(GRGKMMK), 该序列为植物CBP/HAC1的结合位点[30]。可见, C末段氨基酸序列不同导致基因功能的差异性。通过比对,与番茄和拟南芥同源性较低, C末段既不含有11个氨基酸的保守序列, 也不含有类组氨酸序列。那么, TaHsfB2d的C末段结构上的不同是否导致功能特异尚未见报道。
早期研究认为B族Hsf成员主要抑制热响应基因的表达[9-10], 随着研究的深入, 越来越多的研究发现B族Hsf受多种逆境胁迫诱导表达, 参与植株耐热、抗旱和抗病等多种生物和非生物胁迫及生长发育过程[10-13,31]。非胁迫条件下, 拟南芥HsfB1和HsfB2b定位在细胞核, 直接抑制HsfA2、HsfA7a、HsfB1和HsfB2b的表达[10]。小麦在多个器官中表达, 但在小穗中高表达, 且高、低温和干旱、NaCl均能上调的表达[22]。本研究结果显示,在小麦不同时期的多种组织器官中均有表达, 在成熟植株根系中表达量较高。37°C热胁迫、水杨酸和H2O2处理均能显著上调叶片的表达, 同时热激能显著增强SA和H2O2对表达的诱导作用, 表明属于热诱导型, 可能参与多种逆境胁迫响应过程水杨酸介导植物耐热性尤其是植株获得耐热性的过程[32-33], 水杨酸可上游调控拟南芥的表达, 该过程需要借助H2O2信号途径, 同时依赖相关热激蛋白基因的表达[34]。我们前期研究也表明, 42°C热激和H2O2处理均能显著上调玉米的表达, 热激上调的表达依赖于H2O2的存在[25]。模式植物拟南芥受热诱导和氧化胁迫诱导高表达[35-36], 在介导植株获得耐热性过程中[33], 水杨酸在上游调控的表达, 该过程借助H2O2信号途径[32,34]。本研究结果中, 用H2O2合成抑制剂DPI和自由基清除剂DMTU联合预处理后再热激处理, 发现热激对的上调表达作用被显著抑制, 如果预处理后再用SA处理, SA对的上调表达作用被完全抑制, 说明热激上调的表达部分依赖于H2O2的存在, 而正常条件下SA上调的表达完全依赖于H2O2的存在。推测可能通过水杨酸途径介导植株耐热性调控过程, 该过程依赖于H2O2的存在。
20世纪80年代后期酵母被首先克隆, 之后, 越来越多动植物物种的基因被相继获得和注释。酵母中只有1个, 相对简单, 以酵母为转化系统来验证的功能越来越得到应用[37]。本研究通过转化酵母发现, 正常生长条件下, 转基因酵母和转空载体对照细胞的长势没有明显差异; 经50°C热激处理45 min后, 转基因酵母细胞和转化空载体对照细胞的生长速度均受到抑制, 但是前者受抑制程度明显小于后者。表明能在酵母细胞中被诱导表达, 且能显著提高酵母细胞的耐热性, 初步证实的耐热性调控功能。热胁迫后, 转基因酵母菌斑与对照没有明显差异, 说明的导入不影响酵母细胞的生长发育进程。Ogawa等[38]在拟南芥中过表达发现,表达量越高, 植株矮化越明显, 但基础耐热性却显著增强。目前正在通过转基因拟南芥植株对的耐热性功能进行深入的研究。
4 结论
小麦B族热激转录因子基因的cDNA序列全长1191 bp, 编码396个氨基酸残基。蛋白质序列含有DNA结合结构域和核定位信号序列。TaHsfB2d与大麦未知蛋白的相似性最高, 达92%。正常条件下,在小麦多个组织器官中组成型表达, 基因表达受37°C热胁迫、外源水杨酸和H2O2显著上调, 且热激上调的表达部分依赖于H2O2存在, 而水杨酸上调的表达完全依赖于H2O2存在。TaHsfB2d定位于细胞核。转酵母的耐热性被显著提高。
[1] Nover L, Scharf K D, Gagliardi D, Vergne P, Czarnecka-Verner E, Gurley W B. The HSF world: classification and properties of plant heat stress transcription factors., 1996, 1: 215–223
[2] Nover L, Bharti K, Döring P, Mishra S K, Ganguli A, Scharf K D.and the heat stress transcription factor world: how many heat stress transcription factors do we need?, 2001, 6: 177–189
[3] Guo M, Liu H J. Ma X, Luo D X, Gong Z H, Lu M H. The plant heat stress transcription factors (HSFs): structure, regulation and function in response to aboitic stresses., 2016, 7: 114
[4] Scharf K D, Rose S, Zott W. Three tomato genes code for heat stress transcription factors with a region of remarkable homology to the DNA-binding domain of the yeast HSF., 1990, 9: 4495–4501
[5] Xue G P, Sadat S, Drenth J, Mclntyre C L. The heat shock factor family fromin response to heat and other major abiotic stresses and their role in regulation of heat shock protein genes., 2014, 65: 539–557
[6] Nishizawa A, Yabuta Y, Yoshida E, Maruta T, Yoshimura K.heat shock transcription factor A2 as a key regulator in response to several types of environmental stress., 2006, 48: 535–547
[7] Heerklotz D, Döring P, Bonzelius F. The balance of nuclear import and export determines the intrancellular distribution and function of tomato heat stress transcription factor HsfA2., 2001, 21: 1759–1768
[8] Liu H C, Liao H T, Charng Y Y. The role of class A1 heat shock factors () in response to heat and other stresses in., 2011, 34: 738–751
[9] Wunderlich M, Groß-Hardt R, Schöff F. Heat shock factor HSFB2a involved in gametophyte development ofand its expression is controlled by a heat-inducible long non-coding antisense RNA., 2014, 85: 541–550
[10] Ikeda M, Mitsuda N, Ohme-Takagi M. Arabidopsis HsfB1 and HsfB2b act as repressors for the expression of heat-inducible Hsfs but positively regulate the acquired thermotolerance., 2011, 157: 1243–1254
[11] Kumar M, Busch W, Birke H, Kemmerling B, Nürnberger T, Schöffl F. Heat shock factors HsfB1 and HsfB2b are involved in the regulation of Pdf1.2 expression and pathogen resistance in., 2009, 2: 152–165
[12] Zhu X, Thalor S K, Takahashi Y, Berberich T, Kusano T. An inhibitory effect of the sequence-conserved upstream open- reading frame on the translation of the main open-reading frame of HsfB1 transcripts in, 2012, 35: 2014–2030
[13] Ma H, Wang C T, Yang B, Cheng H Y, Wang Z, Mijiti A, Ren C, Qu G H, Zhang H, Ma L. CarHSFB2, a Class B Heat shock transcription factor, is involved in different developmental processes and various stress responses in chickpea (L.)., 2016, 34: 1–14
[14] Kolmos E, Chowa B Y, Pruneda-Pazb J L, Kay S A. Kolmos HsfB2b-mediated repression of PRR7 directs abiotic stress responses of the circadian clock., 2014, 111: 16173–16177
[15] Bharti K, Von Koskull-Döring P, Bharti S, Kumar P, Tintschlkörbitzer A, Treuter E, Nover L. Tomato heat stress transcription factor HsfB1 represents a novel type of general transcription coactivator with a histone-like motif interacting with HAC1/CBP., 2004, 16: 1521–1535
[16] Hahn A, Bublak D, Schleiff E, Scharf K D. Crosstalk between Hsp90 and Hsp70 chaperones and heat stress transcription factors in tomato., 2011, 23: 741–755
[17] Begum T, Reuter R, Schöff F. Overexpression of AtHsfB4 induces specific effects on root development of, 2012, 130: 54–60
[18] Mittal D, Chakrabarti S, Sarkar A, Singh A, Grover A. Heat shock factor gene family in rice: genomic organization and transcript expression profiing in response to high temperature, low temperature and oxidative stresses., 2009, 47: 785–795
[19] Qin D D, Wu H Y, Peng H R, Yao Y Y, Ni Z F, Li Z X, Zhou C L, Sun Q X. Heat stress-responsive transcriptome analysis in heat susceptible and tolerant wheat (L.) by using Wheat Genome Array., 2008, 9: 432–450
[20] Shim D, Hwang J U, Lee J, Lee S, Choi Y. Orthologs of the class A4 heat shock transcription factorconfer cadmium tolerance in wheat and rice., 2009, 21: 4031–4043
[21] Chauhan H, Khurana N, Agarwal P, Khurana J P, Khurana P. A seed preferential heat shock transcription factor from wheat provides abiotic stress tolerance and yield enhancement in transgenicunder heat stress environment., 2013, 8: e79577
[22] Zhang S X, Xu Z S, Li P S, Yang L, Wei Y Q, Chen M, Li L C, Zhang G S, Ma Y Z. Overexpression ofin transgenic Arabidopsis enhances tolerance to extreme temperatures., 2013, 31: 688–697
[23] 李慧聪, 李国良, 郭秀林. 玉米热激转录因子基因对逆境胁迫响应的信号途径. 作物学报, 2014, 40: 622–628 Li H C, Li G L, Guo X L. Signal transduction pathway ofgene responding to different abiotic stresses., 2014, 40: 622–628 (in Chinese with English abstract)
[24] Li H X, Fan R C, Li L B, Wei B, Li G L, Gu L Q, Wang X P, Zhang X Q. Identification and characterization of a novel copper transporter gene familyin common wheat., 2014, 37: 1561–1573
[25] 李慧聪, 李国良, 郭秀林. 玉米热激转录因子基因()的克隆、表达和定位分析. 农业生物技术学报, 2015, 23: 41–51 Li H C, Li G L, Guo X L. Cloning, expression characteristics and subcellular-location of heat shock transcription factorin., 2015, 23: 41–51 (in Chinese with English abstract)
[26] Gietz D, Jean A S, Woods R A, Schiestl R H. Improved method for high transformation of intact yeast cells., 1992, 20: 1425
[27] Li H C, Zhang H N, Li G L, Liu Z H, Zhang Y M, Zhang H M. Expression of maize heat shock transcription factor geneenhances the thermotolerance and drought-stress tolerance of transgenic., 2015, 42: 1080–1090
[28] Czarnecka-Verner E, Pan S, Salem T, Gurley W B. Plant class B HSFs inhibit transcription and exhibit affinity for TFIIB and TBP., 2004, 56: 57–75
[29] Ikeda M, Ohme-Takagi M. A novel group of transcriptional repressors in Arabidopsis., 2009, 50: 970–975
[30] Bharti K, von Koskull-Doring P, Bharti S, Kumar P, Tintschl Korbitzer A, Treuter E, Nover L. Tomato heat stress transcription factor HsfB1 represents a novel type of general transcription coactivator with a histone-like motif interacting with the plant CREB binding protein ortholog HAC1., 2004, 16: 1521–1535
[31] Xiang J, Ran J, Zou J, Zhou X, Liu A. Heat shock factor OsHsfB2b negatively regulates drought and salt tolerance in rice., 2013, 32: 1795–1806
[32] Gaffney T, Friedrich L, Vernooij B, Negrotto D, Nye G, Uknes S, Ward E, Ryals J. Requirement of salicylic acid for the induction of systemic acquired resistance., 1993, 261: 6
[33] Larkindale J, Hall J D, Knight M R, Vierling E. Heat stress phenotypes ofmutants implicate multiple signaling pathways in the acquisition of thermos tolerance., 2005, 138: 882–897
[34] Snyman M, Cronjé M J. Modulation of heat shock factors accompanies salicylic acid-mediated potentiation of Hsp70 in tomato seedlings., 2008, 59: 2125–2132
[35] 李春光, 陈其军, 高新起, 祁碧菽, 陈乃芝, 许守明, 陈珈, 王学臣. 拟南芥热激转录因子调节胁迫反应基因的表达并提高热和氧化胁迫耐性. 中国科学C辑: 生命科学, 2005, 35: 398–407 Li C G, Chen Q J, Gao X Q, Qi B S, Chen N Z, Xu S M, Chen J, Wang X C. Heat shock transcription factorregulating genes expression related to stresses and increase endurance to heat and oxidation stress in.,, 2005, 35: 398–407 (in Chinese with English abstract)
[36] Liu H C, Charng Y Y. Common and distinct functions ofclass A1 and A2 heat shock factors in diverse abiotic stress responses and development., 2013, 163: 276–290
[37] Ayarpadikannan S, Chung E, Cho C W, So H A, Kim S O, Jeon J M, Kwak M H, Lee S W, Lee J H. Exploration for the salt stress tolerance genes from a salt-treated halophyte,., 2012, 31: 35–48
[38] Ogawa D, Yamaguchi K, Nishiuchi T. High-level overexpression of thegene confers not only increased themotolerance but also salt/osmotic stress tolerance and enhanced callus growth., 2007, 58: 3373–3383
Cloning and Characterization of Heat Shock Transcription Factor Geneand Its Regulating Role in Thermotolerance
ZHAO Li-Na1,2,**, LIU Zi-Hui1,**, DUAN Shuo-Nan1, ZHANG Yuan-Yuan1,2, LI Guo-Liang1,*,and GUO Xiu-Lin1,*
1Institute of Genetics and Physiology, Hebei Academy of Agriculture and Forestry Sciences / Plant Genetic Engineering Center of Hebei Province, Shijiazhuang 050051, Hebei, China;2College of Life Sciences, Hebei Normal University, Shijiazhuang 050024, Hebei, China
Heat shock transcription factors (Hsfs) are key components of heat shock signal transduction pathways involved in the activation of Hsp genes in response to heat stress in plants. There are at least 56 members in wheat Hsf family. Eleven of them belong to class B, among which 5 members belong to subclass B2. In this study,was isolated from wheat (L.) young leaves treated by heat shock at 37°C for 1.5 h using homologous cloning methods. Sequence analysis showed that the coding sequence (CDS) ofwas 1191 bp encoding a protein of 396 amino acids. The amino acid sequence analysis demonstrated that TaHsfB2d contained a DNA-binding domain (DBD) and nuclear localization signal (NLS). TaHsfB2d protein sequence shared 90%, 85%, and 80% identities with the proteins from predicted protein of, HsfB2c ofand, respectively. The qRT-PCR results showed thatwas expressed in multiple tissues and organs of wheat, and the relative expression level ofwas higher in roots at anthesis stage.was up-regulated by 37°C heat shock (HS), salicylic acid (SA) and H2O2in leaves. Furthermore, HS significantly enhanced the expression ofpretreated with SA or H2O2, the up-regulation expression ofby HS was significantly inhibited by the combined treatment of 150 µmol L–1DPI and 20 mmol L–1DMTU, and the up-regulation expression by SA was completely inhibited. Through transient reporter assay with onion (L.) epidermal cells, we found that TaHsfB2d localized in the nuclei. Yeast overexpressingshowed stronger growth potential than the control cells overexpressing pYES2 after HS at 50°C for 45 min, and overexpression ofhad no effect on the growth and development of yeast cells. The results revealed that TaHsfB2d perhaps plays a key role in regulating the response to HS through SA signal pathway in plants, which was dependent on existence of H2O2. These results will provide theoretical basis for analysing biological functions and regulating mechanism offurther.
wheat;; subcelullar-localization; quantitative expression; thermotolerance
2017-03-13;
2017-09-10;
2017-09-29.
10.3724/SP.J.1006.2018.00053
通信作者(Corresponding authors): 李国良, E-mail: guolianglili@163.com, Tel: 0311-87652127; 郭秀林, E-mail: myhf2002@163.com, Tel: 0311-87269032
**同等贡献(Contributed equally to this work)
本研究由河北省自然科学基金重点项目(C2016301085), 河北省现代农业科技创新工程项目(2017038997, F17C10006), 河北省财政专项(494-0402-JBN-VT68)和河北省高层次人才项目(A201500130)资助。
This study was supported by the Key Project of Natural Science Foundation of Hebei Province (C2016301085), the Technological Innovation Project of Modern Agriculture of Hebei Province (2017038997, F17C10006), the Key Research Project of Hebei Province (494-0402- JBN-VT68), and the High-level Talent Project of Hebei Province (A201500130).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20170929.0218.002.html

