一株耐高矿化菌株产生的表面活性剂性质的研究
李 伟,李梦雪,张方荣,王 亮,黄建新
(西北大学 生命科学学院, 陕西 西安 710069)
生物表面活性剂,指微生物在一定条件下,在其代谢过程中产生的包括亲水基和疏水基结构的两性化合物,是一种天然的表面活性剂[1-2]。作为提高原油采收率和原油污染土壤生物修复的主要机制之一,生物表面活性剂因具有成本低、活性强、不造成二次污染等优点而得到广泛应用[3-4]。
目前,对于普通油藏与土壤环境而言,微生物采油与土壤修复菌剂已有规模化产品,并在实际应用方面也已取得理想效果[5-8]。但是,随着世界范围内很多油田都表现出地层水矿化度过高、石油污染土壤盐碱化严重的问题,使得耐高矿化采油与土壤修复的微生物研究越来越受到重视。 Makkar等人报道的芽孢杆菌、Kumar等人报道的假单胞菌以及Gesheva等人报道的红球菌,菌种本身以及其所产生物表面活性剂均有一定耐盐性[9-11],黄杨等报道的磷脂类生物表面活性剂可以在20 g/L的盐浓度下仍保持其生物活性[12]。目前,高矿化的水体和土壤对表面活性剂影响的研究,主要是通过利用不同浓度NaCl对表面活性剂活性影响的不同来进行研究。实际应用中,驱油微生物或生物表面活性剂所直接接触的是油藏地层以及表层土壤的高矿化环境,因而该方法必然忽略了高矿化条件中其他无机盐离子对驱油微生物或生物表面活性剂的影响。
位于渤海湾沿岸的胜利油田和冀东油田、位于典型的内陆盐碱湿地的松嫩平原上的大庆油田和吉林油田、以及我国西北内陆的各大油田,很多都表现出油井地层水矿化度高、周围土壤盐碱化严重的问题[13],其中部分油藏的地层水矿化度可达10%~17%,甚至更高。本研究从我国西北某高矿化油田的油水混合物中分离筛选得到一株高效生物表面活性剂产生菌K1,在高矿化条件下,对其所产表面活性剂乳化性及其温度、酸碱度(pH)对表面活性剂的影响进行研究,为高矿化条件下利用生物表面活性剂提高石油采收率以及进行石油污染土壤修复提供了有效菌源与理论依据。
1 材料与方法
1.1 材 料
1.1.1 实验样品 用于耐高矿化表面活性剂产生菌筛选的油水混合物与原油取自我国西北某油田;高矿化水为该油田采油回流注入水,总矿化度为107.7 g/L,pH6.4。
1.1.2 培养基 ① 耐高矿化产表面活性菌株富集培养基:(NH4)2SO40.5 g;NaNO30.5 g;KH2PO41.0 g;高矿化水1 000 mL;原油 10 mL;pH7.0。② 种子培养基:牛肉膏 3 g;蛋白胨10 g; NaCl 5 g;酵母膏 0.5 g;蒸馏水1 000 mL;pH7.0。③ 发酵产表面活性剂培养基:NaCl 3 g;KH2PO45 g;MgSO4·7H2O 0.5 g;酵母膏1 g;葡萄糖20 g;蒸馏水1 000 mL;pH7.0。
1.2 方 法
1.2.1 菌株分离筛选 ① 取5 mL高矿化油水混合物于已灭菌的富集培养基中,摇床(30℃,150 r/min)培养7 d。同样条件转接富集培养3次后,将培养物于高矿化富集培养基平板上连续涂布,分离纯化后得到6株细菌。② 将6株细菌分别接入种子培养基,摇床(30℃,150 r/min)培养2 d后,以5%的接种量接入发酵培养基,同样条件下培养3 d。分别测定6株细菌发酵液排油圈大小[14],筛选出发酵液排油圈直径最大的菌株K1。
1.2.2 菌株鉴定 参照《伯杰细菌鉴定手册》(8版)[15],对菌株K1进行生理生化反应鉴定;将已分离的菌种K1进行稀释涂平板,30℃恒温培养48h后挑取单菌落于50 μL的无菌超纯水中,在PCR仪上95℃裂解15 min,取1 μL裂解液作为扩增的模板,以引物27F和 1495R进行16S rRNA基因扩增,纯化后送至上海生工进行测序。将测序结果在NCBI数据库中利用BLAST进行序列比对,选取同源性较高的菌株用MEGA6.06中的Neighbor-joining计算方法, Bootstrap选择500次重复,模型选择核酸p-distance,构建系统发育树[15]。
1.3 菌株所产表面活性剂的鉴定及乳化性、稳定性研究
1.3.1 表面活性剂提取 发酵液离心(8 000 r/min,10℃,20 min)去除菌体;上清液用HCl 调至pH2.0,4℃静置过夜。10 000 r/min离心20 min,将沉淀用酸化水(pH2.0)洗涤两次,离心收集沉淀得到粗产品。将粗产品用CH2Cl2萃取,减压浓缩至干,溶于0.01 mol/L的NaOH,滤纸过滤;滤液用6 mol/L的HCl将pH调至2.0,再次出现沉淀时,于10 000 r/min,10℃的条件下离心30 min,沉淀冷冻干燥,即得到纯化的表面活性剂[16]。
1.3.2 表面活性剂定性分析 ① 冷冻干燥的表面活性剂进行薄层层析定性分析:以氯仿/甲醇/水(体积比为65∶15∶20)为展开剂,用不同的显色剂显色初步确定表面活性剂的类型:苯酚-硫酸试剂:糖脂显棕色;钼酸铵-高氯酸试剂:磷脂及类脂显蓝绿色;茚三酮显色剂:肽脂显红色[17]。② 采用 FTIR-650 傅立叶变换红外光谱仪对冷冻干燥后的样品进行红外光谱扫描。。
1.3.3 表面活性剂的乳化性 向2只加有5 mL柴油的试管中,分别加入由高矿化水和蒸馏水配制成的浓度为0.2 g/L的表面活性剂溶液5 mL,涡旋仪高速涡旋2 min,30℃静置,每12 h计算1次乳化率[18]。
乳化指数=乳化层高度/体系总高度
1.3.4 温度与酸碱度(pH)对表面活性剂的影响分别用高矿化水和蒸馏水中配制成浓度为0.2 g/L的表面活性剂溶液,在不同温度(30℃,40℃,50℃,60℃,70℃,80℃,90℃)下保持30 min,冷却至室温测定溶液表面张力;将两种表面活性剂溶液调节成不同pH值(1,3,5,6,7,9,11),静置30 min后,测定溶液表面张力。
2 结果与讨论
2.1 耐高矿化产表面活性剂菌株的筛选及鉴定

图1 菌株K1发酵排油圈Fig.1 Oil-excluding-ring test of K1
从油水样中分离纯化得到耐高矿化株菌K1,经发酵培养后菌株K1发酵液排油圈明显(图1)说明其具有较好的产表面活性剂能力。同时,K1在高矿化富集培养基与高矿化富集平板中生长较好,说明其对107.7 g/L的高矿化条件具有良好的耐受性。
菌株K1在牛肉膏蛋白胨平板上生长良好,30℃培养 24 h后, 菌落呈乳白色,半球形突起,表面光滑。菌体革兰氏染色为阴性,短杆状,无芽孢,如图2。其主要生理生化特性见表1。
图2 菌株K1显微镜照片(9×100)Fig.2 Microscope photo of K1
Tab.1 Physiological and biochemical characteristics of strain K1

生理生化特征生理生化特征过氧化氢酶实验+明胶实验-葡萄糖发酵实验+吲哚实验-乙酰甲基甲醇实验-苯丙氨酸脱氢酶实验-酪氨酸水解实验-硝酸盐还原实验+甲基红实验-柠檬酸盐实验+淀粉水解实验-革兰氏染色-运动性-
注:表中“+” 表示反应阳性,“-” 表示反应阴性。
经测定,菌株K1的16S rRNA序列共1447 bp。测序结果在NCBI数据库中进行BLAST比对,同源性比对结果显示,与该序列一致性大于99%的菌株为克雷伯氏菌属(Klebsiellasp.),其 GenBank序列号为KY963669。以菌株K1的16S rRNA基因为基础构建系统发育树(图 3),可以看出,菌株K1与肺炎克雷伯氏菌(Klebsiellapneumoniae)亲缘关系最近。根据形态观察、生理生化特征和16S rRNA 基因分析,初步鉴定 K1为肺炎克雷伯氏菌(Klebsiellapneumoniae)。
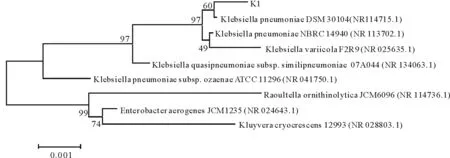
图3 基于菌株K1的16S rRNA基因的系统发育树Fig.3 Phylogenetic tree of strain K1 based on 16S rRNA
2.2 菌株K1所产生物表面活性剂的定性分析及乳化性、稳定性
2.2.1 表面活性剂的提取 菌株K1所产生物表面活性剂呈黄色黏稠状,冷冻干燥后为黄色粉末,产量为 0.5~0.6 g/L。
2.2.2 表面活性剂定性分析 表面活性剂进行薄层层析,样品斑点苯酚-硫酸试剂的显色反应为黄棕色,如图4,其他显色试剂均无反应。

图4 产生物表面活性剂薄层色谱分析Fig.4 Thin layer chromatography analysis
红外光谱分析如图5所示:1 060~800 cm-1对应环烷烃的环骨架,且1 560.6 cm-1处的吸收峰是环烷烃结构吸收峰,表明分子中有环状结构;3 424.61 cm-1波段吸收峰强且宽,可判断分子中含有大量—OH基;1 682.65 cm-1处为CO的伸缩振动峰;在3 100~2 900 cm-1波段范围内为糖类 C—H 的伸缩振动峰,并且在1 310~1 000 cm-1范围内存在C—O—C的羧酸酯基团[19]。结合薄层色谱分析结果,初步判断K1所产生物表面活性剂为含有多元环烃的糖脂类物质。
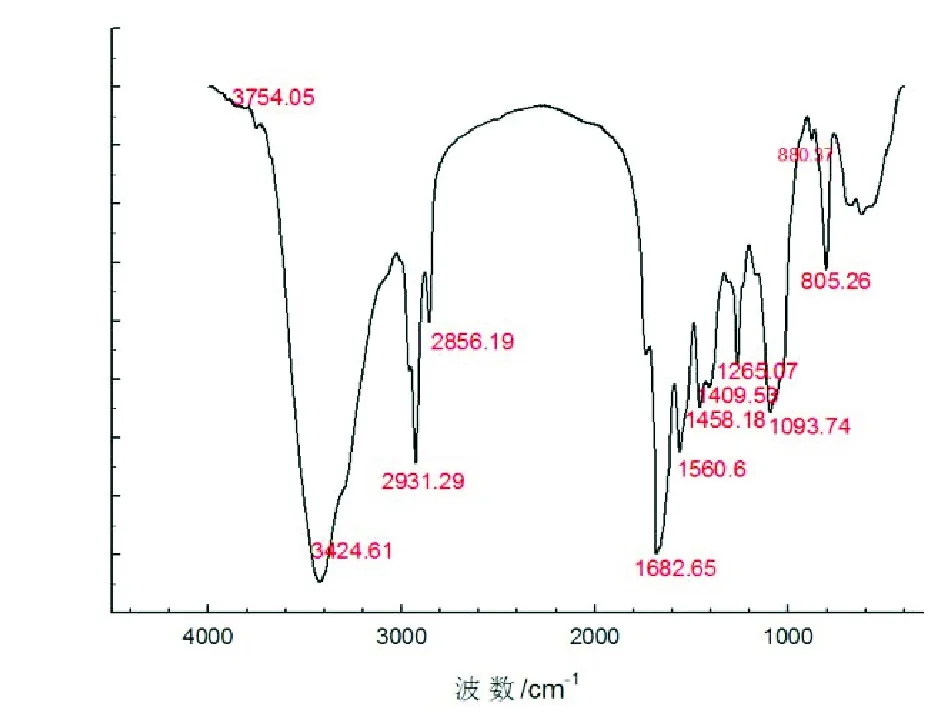
图5 菌株K1所产生物表面活性剂的红外吸收光谱图Fig.5 Infra-red spectrogram of biosurfactantfrom K1
2.2.3 表面活性剂乳化活性 菌株K1所产生物表面活性剂乳化性在100 h内的变化情况如图6。48 h后乳化层高度不再变化,乳化率基本恒定,此时表面活性剂高矿化水溶液乳化率为59.5%,与蒸馏水溶液(65.2%)相比稍有下降。这是由于高矿化水的酸性条件使表面活性剂的活性受到一定影响,而高矿化水中的无机盐同时会引发乳状液转相[20],从而使乳化相减少。结果表明,在矿化度为107.7 g/L的条件下,菌株K1所产生物表面活性剂仍然表现出良好的乳化活性,说明该生物表面活性剂具有一定的耐高矿化性。
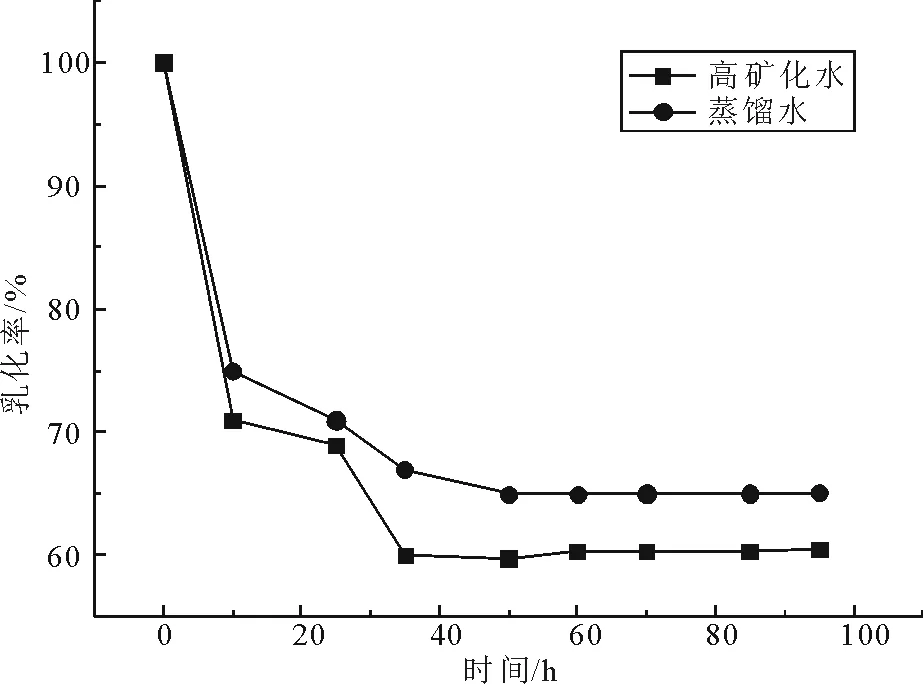
图6 菌株K1所产生物表面活性剂的乳化性Fig.6 Emulsifyng ability of biosurfaetan from K1
2.2.4 温度与酸碱度(pH)对表面活性剂稳定性的影响 常用的评价表面活性剂性能的方法包括测定表面张力、排油活性、油水界面张力等。本研究通过测定表面活性剂溶液的表面张力来对K1菌所产生物表面活性剂的活性进行评价。表面活性剂溶液在不同温度处理后的表面张力变化如图7所示。
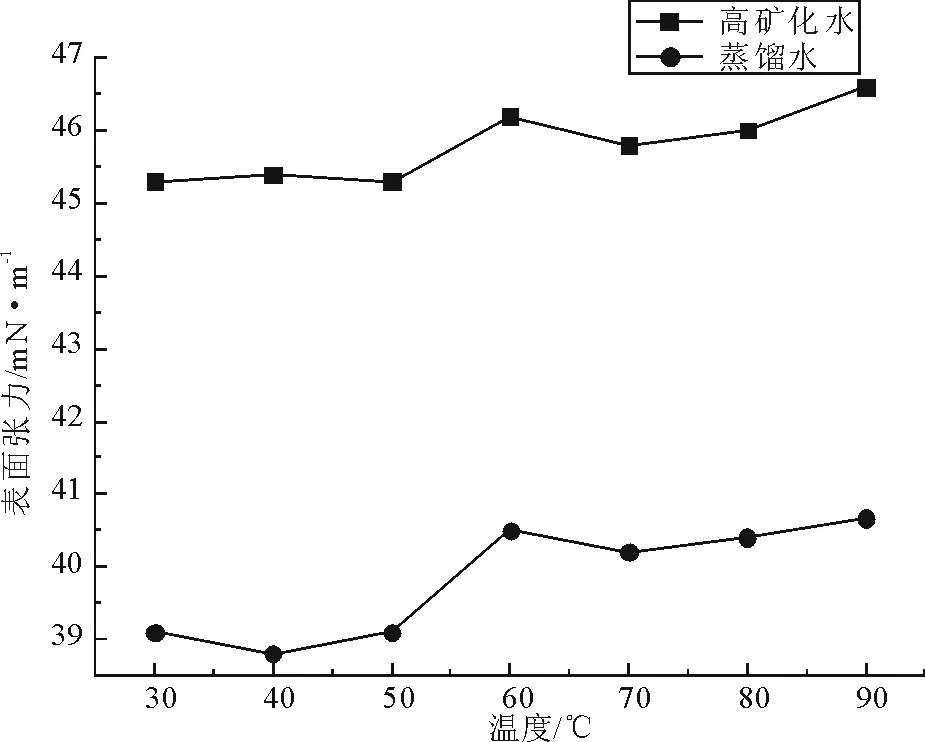
图7 温度对菌株K1所产生物表面活性剂的影响Fig.7 Heat stability of biosurfctan from strain K1
由图7可知,不同温度处理后含表面活性剂的蒸馏水与含表面活性剂的高矿化水溶液表面张力均有所变化。30℃~50℃时2种表面活性剂溶液的表面张力均比较稳定;当温度继续升高时两种溶液的表面张力值同时增大,但增大趋势并不明显,到90℃时表面张力仍然保持在较低值。结果表明:菌株K1所产生物表面活性剂在高矿化度条件下具备良好的降低液体表面张力的活性,并且具有良好的温度适应性,可耐受90℃的温度。由此可见,含表面活性剂的高矿化水溶液的表面张力高于含表面活性剂蒸馏水溶液。其原因是由于一定范围内液相中所加入表面活性剂的量与加入后溶液的表面张力下降率呈正相关,而高矿化水本身表面张力比蒸馏水高,当加入等量的表面活性剂后,在表面张力下降率相同的情况下高矿化水溶液表面张力仍然比蒸馏水高,此现象在酸碱度(pH)对表面活性剂稳定性的影响测定中同样出现。此外由于该高矿化水的偏酸性条件以及部分无机盐离子的影响,使表面活性剂的的活性有所降低。
酸碱度对表面活性剂影响如图8所示,pH由1增大到6时,两种表面活性剂溶液的表面张力均迅速下降到50 mN/m以下,说明在该范围内随着pH值的增大表面活性剂活性不断增强,这与蓝慧、陈帅等[21]的研究结论一致。在pH值增大过程中表面活性剂高矿化水溶液表面张力出现了大幅下降,当pH接近7时其表面张力基本与蒸馏水溶液相同。这可能是由于碱性条件下高矿化水中部分无机盐离子发生沉淀,一方面使水体本身表面张力有所降低,另一方面表面活性剂所受到的部分离子的抑制作用有所减小而表现出较高的活性。在 pH7.0~11. 0 范围内,两种溶液表面张力均比较稳定,基本维持在40~50 mN/m之间。结果表明,高矿化条件下菌株K1所产生物表面活性剂在pH 7.0~11. 0 范围具有良好的稳定性,过酸会对该生物表面活性剂造成明显的破坏。

图8 酸碱度(pH)对菌株K1所产对生物表面活性剂的影响Fig.8 Effect of pH on biosurfactant from strain K1
3 结 语
从高矿化油水混合物中筛选到一株表面活性剂高产菌株K1,避免了只有一种无机盐而忽略油藏地层以及表层土壤的高矿化复杂环境对菌株的影响,同时着重研究了耐高矿化菌株K1产生的表面活性剂的性质。
1)从高矿化油水混合物中分离到一株耐高矿的生物表面活性剂产生菌K1,经形态观察、生理生化特征及其16S rRNA基因分析,鉴定该菌株为肺炎克雷伯氏菌(Klebsiellapneumoniae)。
2)薄层色谱与红外光谱分析初步确定K1细菌所产生物表面活性剂为糖脂类物质。
3)高矿化条件下菌株K1所产生物表面活性剂在矿化度为107.7 g/L,pH 7.0~11.0、温度30~90 ℃范围的条件下具有较好的乳化活性,在作用48 h后,对柴油的乳化率稳定维持在59.5%。
4)本研究获得的耐高矿化的生物表面活性剂产生菌K1对高矿化油藏微生物采油或原油污染土壤的生物修复具有很好的应用潜力。
[1] GARGOURI B, CONTRERAS M D, AMMAR S, et al. Biosurfactant production by the crude oil degrading stenotrophomonas sp. B-2: Chemical characterization, biological activities and environmental applications[J].Environmental Science and Pollution Research International,2017,24(4):3769-3779.
[2] YOUSSEF N H, DUNCAN K E, NAGLE D P,et al.Comparison of methods to detect biosurfactant production by diverse microorganisms[J].Journal of Microbiological Methods,2004,56(3):339-47.
[3] 邓勇,易绍金. 稠油微生物开采技术现状及进展 [J]. 油田化学,2006(3):289-292.
[4] 陈忠喜,郭书海,刘广民,等. 除油生物表面活性剂产生菌的分离及其特性 [J]. 哈尔滨工业大学学报,2007(4):586-588.
[5] 傅海燕,曾光明,袁兴中,等. 生物表面活性剂的分离提纯及其发展前景[J].生物学杂志,2003(6):1-4.
[6] 钱欣平,阳永荣,孟琴. 生物表面活性剂对微生物生长和代谢的影响 [J].微生物学通报,2002(3):75-78.
[7] 沈平平.提高采收率技术进展 [J].北京:石油工业出版社,2006:276-311.
[8] CHANG H L. Enhanced Oil Recovery Field Case studies [M].Waltham:Gulf Professional publishing,2013:543-559.
[9] MAKKAR R S,CAMEOTRA S S.Production of biosurfactant at mesophilic and thermophilic conditions by a strain of Bacillus subtilis [J].Journal of Industrial Microbiology and Biotechnology,1998,20(1):48-52.
[10] MANOJ K, VLADIMIRl L, ANGEL DE S M, et al. Biosurfactant production and hydrocarbon-degradation by halotolerant and thermotolerantPseudomonassp. [J]. World Journal of Microbiology and Biotechnology,2007,24(7):1047-57.
[11] VICTORIA G, ERKO S, EVGENIA VASILEVA T.Biosurfactant production by halotolerant rhodococcus fascians from casey station, Wilkes Land, Antarctica [J]. Current Microbiology,2010, 61(2): 112-17.
[12] 黄杨,吴涓,李玉成. 一株生物表面活性剂产生菌的筛选鉴定及其特性[J]. 环境工报,2015,9(5):2522-2527.
[13] 杨玉楠,韩冬. 嗜盐菌强化石油污染土壤生物修复的可行性研究 [J]. 农业环境科学学报,2007,26(S1):121-126.
[14] AMEZCUA-VEGA C,POGGI-VARALDO H M, ESPARZA-GARCIA F, et al. Effect of culture conditions on fatty acids composition of a biosurfactant produced by candida ingens and changes of surface tension of culture media[J]. Bioresour Technol,2007,98(1): 237-40.
[15] 布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].8版.北京:北京科学出版社,1984.
[16] EDUARDO J G, JORGE F B P, LIGIA R R, et al. Isolation and study of microorganisms from oil samples for application in microbial enhanced oil recovery [J]. International Biodeterioration & Biodegradation,2012,68:56-64.
[17] 王靖,陈云. 生物表面活性剂及其评价方法[J]. 化学研究与应用,2009,21(2):137-140.
[18] HOSSEIN A, MOHAMMAD H S, MANOUCHEHR H,et al.Comparative study of biosurfactant producing bacteria in meor applications[J].Journal of Petroleum Science and Engineering,2010,75(1-2):209-14.
[19] PRETSCH E, BHLMANN P, BADERTSCHER M, 等.波谱分析[M].4版.北京:科学出版社,2013.
[20] 赵修太,白英睿,戚元久,等. 无机盐对乳状液稳定性和转相的影响 [J]. 无机盐工业,2012,44(9):25-28+31.
[21] 蓝慧,陈帅,曹林友,等. 一株嗜碱原油降解细菌的筛选及降解能力研究 [J].化学与生物工程,2015,32(8):35-38.

