基于微通道传感器与神经网络的牛奶体细胞数定量检测方法研究
张学超 崔传金 张晓晨(①铜仁学院大数据学院 贵州 铜仁 554300 华北理工大学 唐山市先进测试与控制技术重点实验室 河北 唐山)
奶牛乳腺炎(Cow Mastitis)是奶牛所有疾病中发病率最高,危害最严重的一种疾病,美国每年因奶牛乳腺炎疾病造成的经济损失高达20.00亿美元[1-2]。2016年全球原料奶产量高达8.17亿t,中国原料奶产量仅3570万t,奶牛单产仅8.3t,同年进口乳制品折合生鲜乳约1200万t[3]。同期,美国牛奶总产量为9471万t,奶牛单产高达10.27t,但生鲜乳价格却仅为3.2元/kg,我国均价高达4.05元/kg[4]。此外,我国人均乳品消费量仅为世界平均水平的1/3[5],说明我国乳品市场还有巨大增长空间。Litwinczuk等[6]研究表明,原奶中的体细胞数(Somatic Cell Count,SCC)与日产奶量呈显著负相关(P<0.05),平均SCC每提高1个水平,日产奶量下降0.13kg。金亚东[7]等研究表明,SCC与日产奶量呈极显著负相关(P<0.01),平均SCC水平每升高1个单位,日产奶量下降约1.3kg。因此,按照CMT检测标准,若能尽早检测出奶牛(隐性)乳腺炎疾病,理论上奶牛日单产约增4.48kg。由此可见,若要改变我国乳品市场的竞争格局,关键要提高奶牛单产和原奶品质,而原奶中体细胞数与奶牛乳腺炎患病等级、牛奶产量和品质密切相关[8,9];2016年中国农垦乳业联盟发布《中国农垦生鲜乳生产和质量标准》,新增体细胞数检测指标,规定40万个/ml以下为合格乳[10]。因此,迫切需要研发能够在线检测奶牛乳腺炎患病等级、牛奶产量和品质的新型传感器。在体细胞数的所有检测方法中,电检测法具有方便快捷、检测成本低和实时在线检测等优点,应用前景广阔[11]。然而,体细胞数与电导率[12]和电容[13]有一定相关关系;温度对测量电容参数也有重要影响[14]。在特定温度条件下,试验通过微通道传感器测取不同细胞含量的新鲜奶样电导率和电容值,并用低频区域的电导率和电容值建立预测体细胞含量的神经网络模型,最终达到准确、快速、在线诊断奶牛乳腺炎和评判原奶产量和品质的目的。
1 材料与方法
1.1 材料
美国GAMRY 600电化学工作站;美国HERA CELL 150i二氧化碳培养箱;日本OLYMPUS CKX301倒置显微镜;日本OLYMPUS CX21生物光学显微镜;北京科伟永兴79-1磁力加热搅拌器;上海舜宇DC-0515低温恒温槽;上海GI208离心机;BCD-219SKDE冷藏柜;真空泵;高精度温度计等,主要数据分析处理采用MATLAB R2012b软件。
1.2 方法
1.2.1 奶样采集 奶样采自100多头同一品种的荷斯坦奶牛。在奶样采集过程中,需要将分娩后1个月内的奶牛和泌乳后期的奶牛除去[13]。采样时先用温开水擦拭乳头,然后用75%的乙醇对乳头进行消毒,并用干净的医用棉签擦干,且弃去前2次挤出的牛奶,再进行奶样采集。每个乳区的牛奶分别挤入50ml干净的带有编号的玻璃瓶内密封,在运输的过程中放入装有冰袋的隔热泡沫塑料盒内进行保鲜。最后将当天采集的奶样带回实验室测试,来不及立刻测试的奶样需在4℃条件下冷藏保存,防止牛奶变质而影响测试效果。
1.2.2 测试奶样配制(1)原奶中细胞含量的检验采用改进的显微镜直接计数法,即碘酊染液染色,细胞计数板计数。将奶样带回实验室后,将装有奶样的奶样瓶放入低温恒温槽中,在40℃的恒温条件下恒温15min后取出[15],再用磁力加热搅拌器搅拌3min,使得奶样中的体细胞、脂肪滴等物质均匀分散,便于体细胞过滤和防止脂肪滴等物质因凝聚而堵塞滤膜。最后用真空泵对预处理的奶样进行负压过滤,得到无细胞含量的奶样;同时配置碘酊染液,进行生物光学显微镜细胞计数,观测结果如图1所示。(2)为解决特定乳腺炎患病等级体细胞含量的奶样采集困难问题,试验中使用具有相似细胞结构功能的K562细胞替代奶样中的体细胞。为此,将K562细胞在二氧化碳培养箱中进行培养,培养结果如图2所示。(3)将培养后的K562细胞与过滤后的奶样进行细胞含量配置,分别配置为0、10、20、40、80、160、320、640万/ml的待测奶样,同时将配置好的不同浓度梯度的奶样进行镜检计数,以便验证奶样配置的准确性。(4)试验中,同一奶样重复镜检计数5次,取其平均值作为牛奶体细胞最终含量。共测取120份奶样,并根据加利福尼亚CMT标准[14],将奶样划分为5个等级,见表1。

图1 过滤后无细胞奶样

图2 培养后的K562细胞

表1 CMT法检测奶牛乳腺炎的标准 (万个/ml)
1.2.3 牛奶电容和电导率测量 因为温度对测量牛奶电容有影响较大[14],同时考虑在线检测和正常情况奶牛体温两因素,确定38.6℃为试验测试温度。因此,将装有测试奶样的微通道传感器(预热30min,以保证热传递达到平衡)置于38.6℃的低温恒温槽中进行测试,同时使用高精度温度计验证低温恒温槽中的水温是否符与测试温度一致。最后使用GAMRY 600电化学工作站测量在10Hz~1MHz频率范围内的电阻和电抗值,并根据微通道传感器的具体结构参数转换成对应的电导率和电容值。同时,为了避免测试奶样之间相互交叉污染,每测试完1个奶样后,注射器和微通道传感器都必须用超纯水清洗干净,并用下一个测试奶样冲洗3次,再进行测试。所有奶样均在采集后的12h内测试完毕。
2 结果
2.1 微通道传感器的设计
(1)微通道传感器电极采用99.99%的高纯度金,并溅射到玻璃基片上;同时微通道管体选用透明、绝缘性好的聚二甲基硅氧烷(PDMS),并用氧等离子技术进行处理,以最大限度减少在通道内部产生气泡,同时也有助于基片与盖片的永久封和[16]。微通道传感器由北京博奥生物技术有限公司代工。(2)为突出传感器的容抗作用和降低感抗干扰,根据公式Xc=1/(ωc)=1/(2πfc)。式中:Xc为容抗,c为电容,ω为电极两端激励源信号角频率,f为激励源信号频率。在激励源信号频率一定的情况下,要想得到较高的容抗,只能减小测试电极的电容,又根据c=ξ0ξrA/L。式中:ξ0为绝对电容率,ξr为相对电容率,A为电极的横截面积,L为电极间距离。正是基于减小电极横截面积和增加传感器长度2种方式来增加容抗;同时考虑到方便进样和进一步减小界面电容等因素。因此,设计了如图3所示的微通道传感器,具体参数见表2。

图3b 微通道传感器微观尺寸图
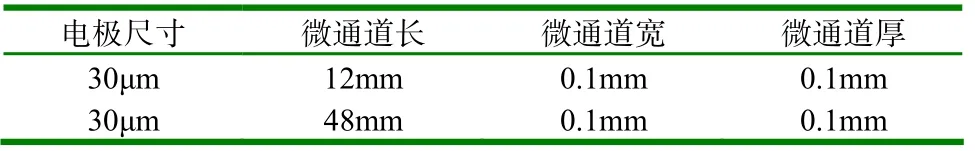
表2 微通道传感器参数
2.2 基于电导率和电容的细胞含量神经网络模型
(1)将奶样电导率和电容值2个向量作为BP神经网络[17]输入,输入层神经元数为2。网络输出向量为体细胞数,输出神经元数为1。该网络采用2个隐层,2个隐层之间传递函数为Tansig,输出层函数为Purelin,训练函数为Trainlm。在网络训练前,将数据用Mapstd标准化函数进行标准化预处理,以避免数据饱和并加速网络的收敛速度。(2)通过调整隐层的节点数和相关的训练参数对网络结构进行优化试验。经过多次的训练仿真发现,当最大迭代次数为1000,误差性能目标值为0.0001。网络模型的2个隐层神经元数为4和2时,结果较为满意,模型结构为2-4-2-1,见图4。
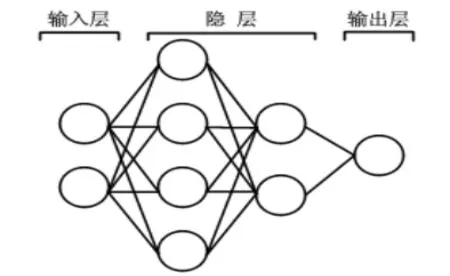
图4 网络模型结构
3 讨论
3.1 传感器模型(1)传感器模型分析(长12mm)。
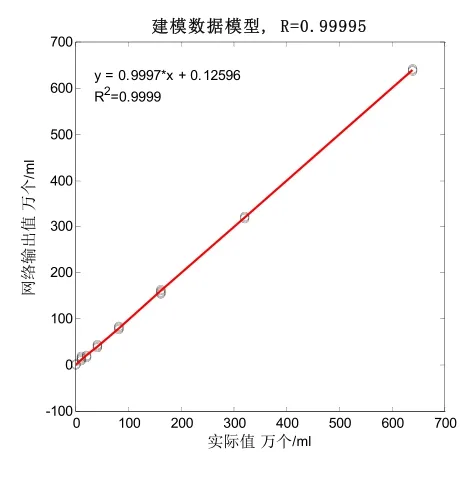
图5 建模数据模型线性回归曲线
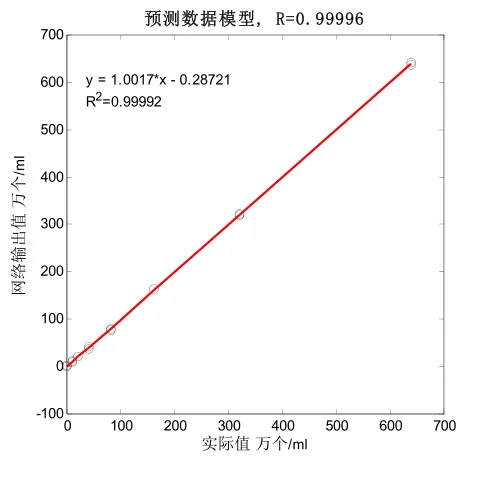
图6 预测数据模型线性回归曲线
(2)传感器模型分析(长48mm)。
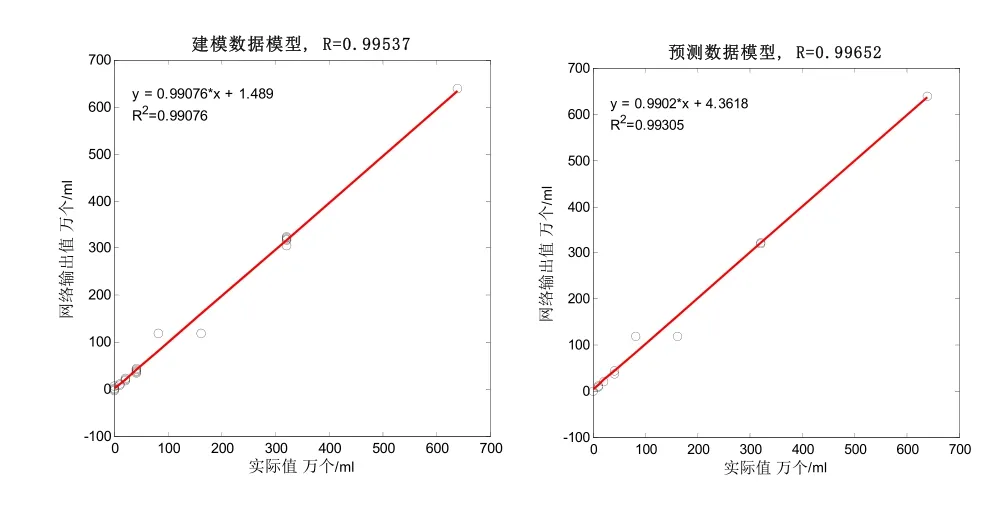
图7 建模数据模型线性回归曲线 图8 预测数据模型线性回归曲线
(3)表3、表4分别为传感器的模型评价参数和各级正确检出率。
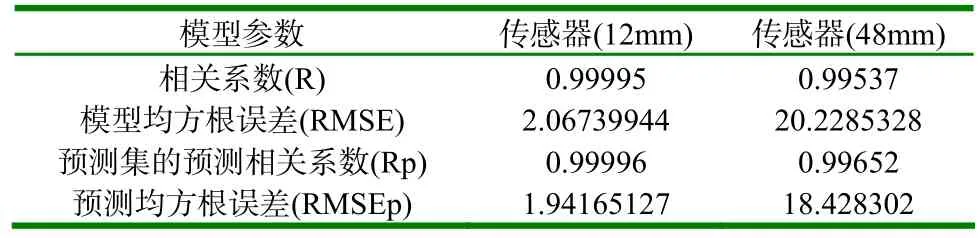
表3 模型评价参数
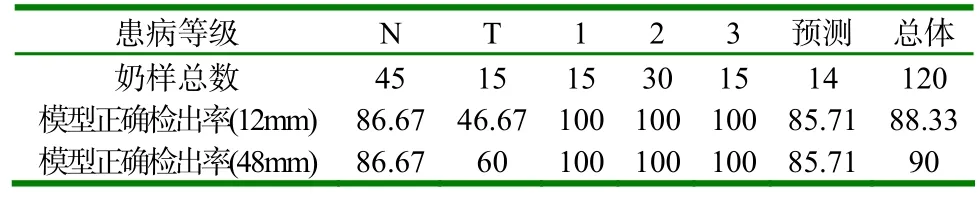
表4 各级正确检出率 (%)
3.2 模型处理结果分析
(1)由表3可知,该模型建模结果准确,呈极显著相关性,相关系数R分别为0.99995和0.99537;模型均方根误差RMSE分别为2.06739944和20.2285328。并由图5、图7可知,建模模型的决定系数R2分别为0.9999和0.99076,说明针对该类型传感器所建立的奶牛乳腺炎检测模型符合检测要求。同时预测数据模型预测结果准确,也呈极显著相关性,相关系数R分别为0.99996和0.99652;模型均方根误差RMSEp分别为1.94165127和18.428302。并由图6、图8可知,预测数据模型的决定系数R2分别为0.99992和0.99305,说明针对该类型传感器所建立的奶牛乳腺炎预测检测模型符合检测要求。(2)预测数据模型对14个建模后剩余的奶样(每级11.67%的和)进行预测,正确检出率均为85.71%。120个奶样的总体检出率分别为88.33%和90.00%,优于S.Ankinakatte等[18]研究的用神经网络检测乳腺炎的75%检出率;略低于崔传金等[19]使用神经网络检测法在常规传感器检测条件下的95%乳腺炎检出率,但是在BP网络结构的复杂度、迭代次数和误差性能目标等方面均显著优于其模型指标。该微型传感器与崔传金等研究的常规传感器相比较,检测优势明显,所需奶样检测量骤减。(3)在各级奶样的检出率方面,N级和T级奶样的检出率偏低,尤其T级检出率更为严重,检出率分别为N-86.67%、T-46.67%(12mm)和N-86.67%、T-60.00%(48mm),但是1、2、3级的正确检出率均为100%。导致这种结果的原因很可能在于体细胞含量上,在N级和T级中,测试奶样的最高细胞含量一般不会超过40万个/ml,很大一部分细胞奶样不高于20万个/ml。因此,奶样所产生的奶体电容和奶体电导率信息较少,与电极极化的界面电容和整体电导率相比较,所占权重小,其有效信息被淹没,最终导致N级和T级的检出率偏低。但48mm的微通道传感器因其管道长度的增加,在低频测试时不但极大增加了奶体的测试容抗,同时还进一步提升了对感抗的抗干扰能力,并且还增大了奶体的充放电时间常数,使得奶体电容更易捕获,所以测得的电容值更接近真实奶体电容值,故在T级检出率上明显优于12mm的微通道传感器模型检测结果。同时,由于1、2、3级奶样的细胞含量显著上升,这时电容值和电导率的大小就能很好地反映奶样细胞含量的变化。因此,模型对1、2、3级的正确检出率均达到100%。
4 结论
通过使用微通道传感器来获取阻抗数据,并建立相关的BP神经网络模型来实现原奶中体细胞数的定量检测。结果表明:在特定检测温度下,用电导率和电容值建立与细胞含量之间的BP神经网络模型整体可行,模型和预测模型的相关系数、均方根误差和决定系数均较高,能达到定量预测原奶中体细胞数的目的。但在N级和T级细胞浓度下,检出率偏低,是因为奶体阻抗很大程度上被电极极化的界面阻抗所淹没。因此,进一步研究更加合理的微通道传感器结构,降低或消除界面阻抗对奶体阻抗的干扰,有望进一步实现微通道传感器对原奶中体细胞数的检测精度。
[1] MUNGUBE E O, TENHAGEN B A, REGASSA R, etal. Reduced milk production in udder quarter with subclinical mastitis and associated economic losses in crossbred dairy cows in Ethiopia[J]. Tropical Anim Health Prod, 2005, 37(6): 503-512.
[2]VIGUIER C,ARORA S, GILMARTIN N, etal.Mastitis detection:durrent trends and future perspectives[J]. Trends Biotechnol, 2009, 27(8):486-493.
[3] 李胜利. 2016年奶牛产业技术发展报告[J]. 中国畜牧杂志, 2017.53(1): 156-164.
[4] 张洁等. 我国牛奶安全生产现状及对策[J]. 草业科学, 2017. 1. 34.138-151.
[5] 中国奶业质量报告[J]. 新疆畜牧业, 2016. 10, 9-13.
[6] Litwinczuk Z, Krol J, Brodziak A. et al. Change of protein content and its fractions in bovine milk from different breeds subject to somatic cell count[J]. J Dairy Sci, 2011, 94: 684-691.
[7] 金亚东等. 奶牛乳中体细胞数对乳产量及乳成分的影响[J]. 中国乳品工业, 2016, 44(6): 28-31.
[8] Pilla R, Malvisi M, Snel G G,etal. Differential cell count as an alternative method to diagnose dairy cow mastitis[J]. J Dairy Sci, 2013,96(3): 1653-1660.
[9] Sadeghi-sefidmazgi A, Moradi-shahrbabak M, Nejati-javaremi A, et al.Estimation of economic values and financial losses associated with clinical mastitis and somatic cell score in Holstein dairy cattle[J]. Animal,2011, 5(1): 33-42.
[10] 2016年终盘点中国乳业大事件回顾[J]. 中国乳业, 2017. 181.2-12.
[11] 崔传金等. 基于体细胞数的奶牛乳腺炎检测方法研究进展[J]. 中国乳品工业, 2013, 41(7): 44-47.
[12] Kasikcl G, Cetin O, Bingol E B, et al. Relations between electrical conductivity, somatic cell count, California mastitis test and some quality parameters in the diagnosis of subclinical mastitis in dairy cows[J]. Turk J Vet Anim Sci, 2012, 36(1): 49-55.
[13] Patel P M, Bhat A, Markx G H. A comparative study of cell death using electrical capacitance measurements and dielectrophoresis[J].Enzyme Microbial Technology, 2008, 43(7): 523-530.
[14] 刘峰, 迟玉杰. 乳房炎乳的检测方法[J]. 现代食品科技, 2005,21(1): 129-131.
[15] Sierra D, Sanchez A, Luengo C, et al. Temperature effects on fossomatic cell counts in goat milk[J].Int Dairy J, 2006,16:385-387.
[16] 江树镇等. 生物芯片微通道的微细加工工艺[J]. 电加工与模具,2014, 3: 66-70.
[17] Cavero D, Tolle K H, Henze C, et al. Mastitis detection in dairy cows by application of networks[J]. Livestock Sci, 2008,114:280-286.
[18] Ankinakatte S, Norberg E, Lovendahl D, et al. Predicting mastitis in dairy cows using neural networks and generalized additive model:a comparison[J].Computers Electronics Agriculture, 2013, 99: 1-6.
[19] 崔传金, 古少鹏, 左月明. 基于电参数与神经网络的奶牛乳腺炎检测方法[J]. 农业机械学报, 2011, 42: 193-197.

