伏隔核区Jak/Stat3抑制剂注射调控布氏田鼠的能量代谢
闫立新, 张知彬, 宋铭晶*
(1.中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,卫生部人类疾病比较医学重点实验室,北京100021; 2.中国科学院动物研究所,北京100101)
瘦素主要由白色脂肪细胞分泌,它有助于减少脂肪积累、降低体质量、增强能量代谢。瘦素缺乏或瘦素抵抗是导致肥胖的重要发病机制之一。迄今为止,已经发现瘦素有8种突变方式,突变的瘦素蛋白不能和瘦素受体结合,无法发挥减少摄食和降低体质量的作用,最终导致极度肥胖(Strobeletal.,1998;Chekhranovaetal.,2008;Mazenetal.,2009;Fischer-Posovszkyetal.,2010;Fatimaetal.,2011;Thakuretal.,2014;Wabitschetal.,2015)。最近发现的瘦素的一种突变是在2015年,研究者发现一个2岁小男孩出现了早发性极端肥胖,原因是其瘦素的第100个氨基酸由天冬氨酸突变为酪氨酸,瘦素失去了生物学活性,在使用人重组瘦素(美曲普汀)治疗后,病人的饮食行为恢复正常,且体质量迅速下降(Wabitschetal.,2015)。瘦素是下丘脑发育过程中的神经营养因子,促进下丘脑瘦素传导到大脑脑区通路的形成,从而达到控制脑区、调控饮食与能量消耗的功能(Bouretetal.,2004)。信号转导与转录激活因子3(signal transducer and activator of transcription,Stat3)作为转录因子可以通过调控基因转录来控制细胞增殖、生长、凋亡等过程,进而参与到免疫、肿瘤生成、肥胖等生命进程中。瘦素通过诱导Stat3的磷酸化调控中枢神经系统,从而达到抑制肥胖的功能(Pattersonetal.,2009)。研究发现,高脂饮食肥胖小鼠的leptin-Stat3(瘦素-Stat3)信号通路几乎被抑制,磷酸化Stat3(P-Stat3)的表达量明显下降,但经过12周自主转轮运动实验后,高脂饮食肥胖小鼠的leptin-Stat3信号通路恢复,P-Stat3表达量提高,进而减少高脂饮食对小鼠体质量的影响(Laingetal.,2016)。
布氏田鼠Lasiopodomysbrandtii是研究“健康性肥胖”的潜在模型动物,虽然长光照在35 d后会导致布氏田鼠体质量在短时间显著增加,但是它会重新建立一种稳态,与短光照的布氏田鼠相比,长光照布氏田鼠白色脂肪的总含量显著增高,血清瘦素含量显著增高,饮食量显著下降,没有出现瘦素抵抗与胰岛素抵抗的现象(Liuetal.,2016)。此外,在怀孕和哺乳期间给予布氏田鼠高蛋白饮食可以降低后代的消化能力,并降低其肥胖抵抗以及糖耐受现象(Louetal.,2015;Zhangetal.,2017)。因此,我们认为布氏田鼠在研究肥胖与代谢方面具有很高的潜在应用价值。迄今为止,没有大脑伏隔核区与代谢类疾病相关的报道,而且瘦素在伏隔核区高表达,因此选择伏隔核作为本实验代谢研究的脑区。通过在布氏田鼠伏隔核区定点注射Jak/Stat3抑制剂(WP1066)阻断leptin-Stat3信号通路,探索伏隔核区瘦素通路与能量代谢的关系。
1 材料和方法
1.1 材料
1.1.1实验动物50 g左右雄性布氏田鼠(中国医学科学院医学实验动物研究所,实验动物使用批准号:ILAS-PG-2014-011)共30只,并在独立送排风净化动物笼中饲养,照明昼夜节律为14∶10。动物饮水、垫料和笼具均经高压灭菌处理,饲料经Co60照射消毒达到SPF级动物饲料标准。
1.1.2实验器材脑立体定位仪(Stoelting,USA),脑区套管(深圳市瑞沃德生命科技有限公司),TSE动物代谢测量分析系统-PhenoMaster/LabMaster(TSE Systems)。
1.1.3试剂Jak/Stat3抑制剂WP1066(Abcam),二甲基亚砜(DMSO),Western Blot用瘦素抗体(Abcam),免疫组化用Phospho-Stat3(Tyr705)抗体(Cell Signaling),山羊抗兔抗体(北京中杉金桥生物技术有限公司),麻醉剂(2.5%水合氯醛)。
1.2 实验方法
1.2.1脑区埋管手术用麻醉剂将布氏田鼠麻醉后固定在脑立体定位仪上,在头部剪开1 cm左右露出头盖骨,并确定左右头骨、前后囟在同一水平线上,根据伏隔核脑区坐标(AP:1.6 mm,ML:±1.3 mm,DV:-4.3 mm)双侧埋管。手术后,给予正常饮食。1周后,待其体质量恢复后进行药物注射。
1.2.2脑区注射对照组注射二甲基亚砜,实验组注射WP1066(10 mmol·L-1),注射速度是每侧1 μL/3 min,注射结束后留针2 min,防止液体倒流并使其充分扩散。每隔一天注射1次药物,共注射4次。
1.2.3动物代谢测量分析实验先将布氏田鼠放入代谢笼适应2 d,再收集其之后12 d的本底代谢水平,然后开始给布氏田鼠注射药物,注射药物结束4 h后收集接下来2 d的实验数据。
1.2.4动物体质量在注射药物之前称量布氏田鼠的体质量,再称量其第10天的体质量。
1.2.5WesternBlot实验实验结束后,获取布氏田鼠新鲜脑组织,冰冻切片抠取伏隔核脑区,将抠取的脑组织放在同一个离心管里,提取蛋白,-80 ℃储存,Western Blot检测瘦素的表达量。
1.2.6免疫组化实验实验结束后,在布氏田鼠的心脏处灌流,先用生理盐水冲洗,再用4%多聚甲醛灌注固定,最后将脑组织储存在4%多聚甲醛中,冰冻切片厚40 μm,浸泡在10%叠氮化钠中储存,免疫组化实验检测P-Stat3表达量。
1.2.7血清瘦素浓度和血糖浓度测定实验结束后麻醉布氏田鼠,用1 mL注射器在其腹主动脉抽取血样放在血液促凝管中,离心得血清(3 500 r·min-1,10 min),并检测血清瘦素浓度(放射免疫,北京北方生物技术研究所有限公司)和血糖浓度(葡萄糖氧化法,北京北方生物技术研究所有限公司)。
1.3 数据分析
数据统计使用SPSS 20.0,代谢笼数据(总饮水量、总能量消耗量、总耗氧量、呼吸交换率)用重复测量方差分析,其他数据用独立样本T检验法分析,P<0.05表示差异有统计学意义,数据以平均值±标准误(Mean±SE)表示,最后用GraphPad Prism 6作图。
2 实验结果
2.1 免疫组化检测伏隔核区P-Stat3表达
免疫组化结果显示,布氏田鼠伏隔核区P-Stat3(Tyr705)表达显著下降(图1)。
2.2 Western Blot实验检测伏隔核区瘦素表达
Western Blot结果显示,布氏田鼠伏隔核区瘦素表达水平显著下降(图2)。
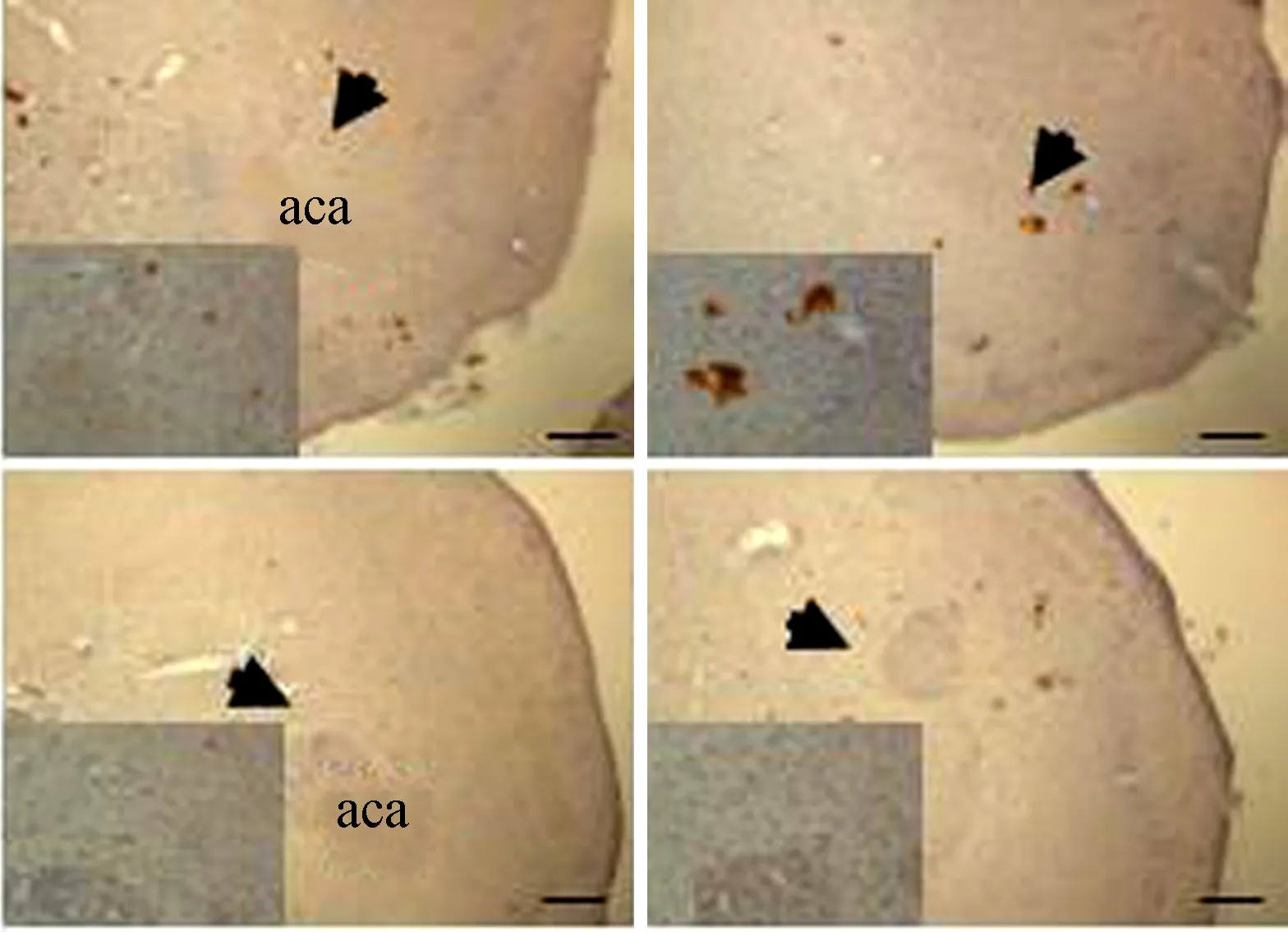
图1 对照组(上)与实验组(下)伏隔核区P-Stat3的表达Fig. 1 Protein expression of P-Stat3 in nucleus accumbens of control group (upper) and experimental group (bottom)
aca. 伏隔核区的一部分,用于伏隔核的定位; 左下角为箭头所指处的放大; 比例尺=200 μm
aca. the core of nudeus accumbens, which is used to locate nudeus accumbens in the brain; the small pictures in the lower-left are amplified area directed by the arrow in the same figure; scale bar=200 μm
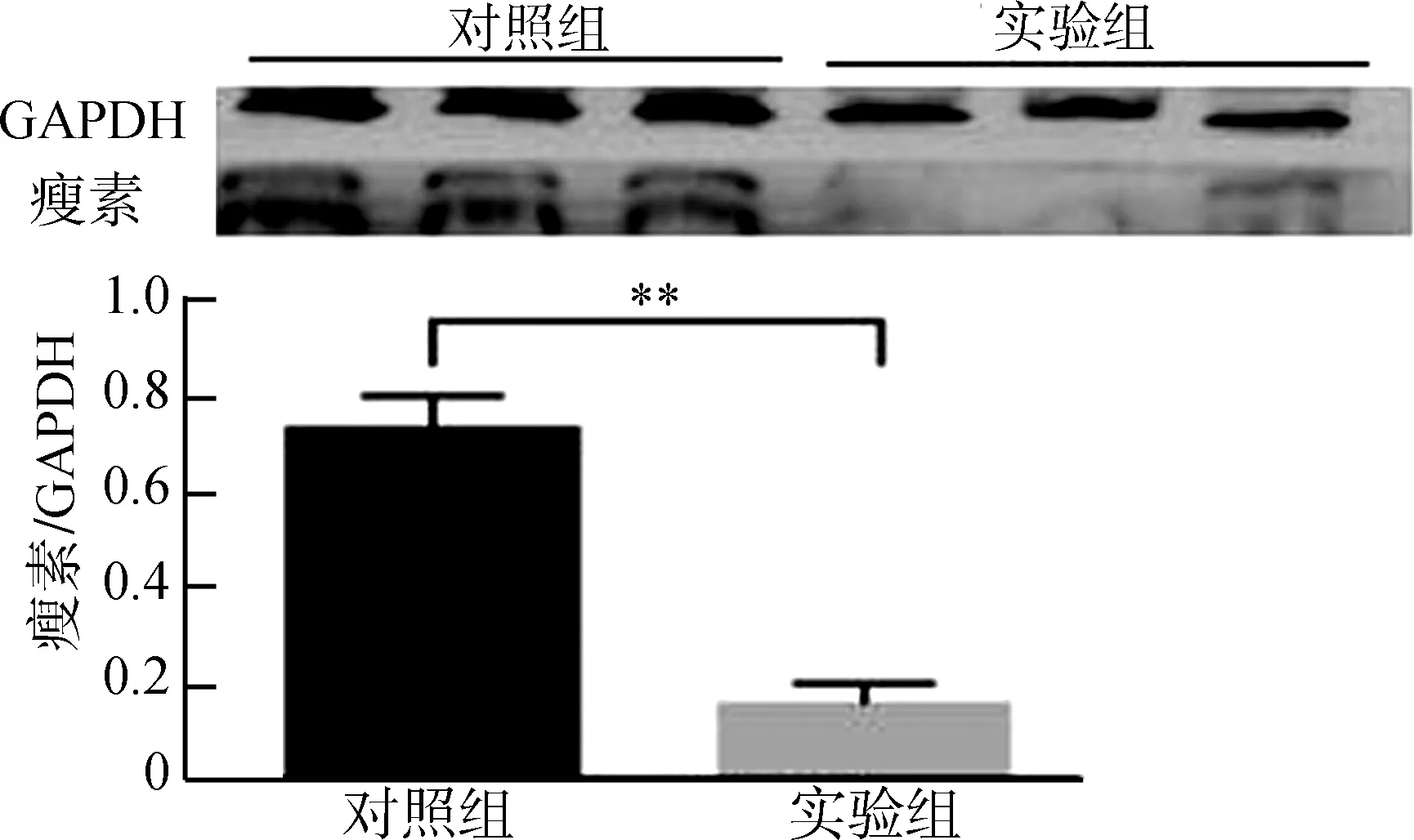
图2 实验组与对照组伏隔核区的瘦素表达量
Fig. 2 Protein expression of leptin in control group and experimental group
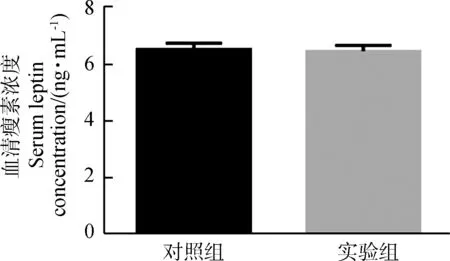
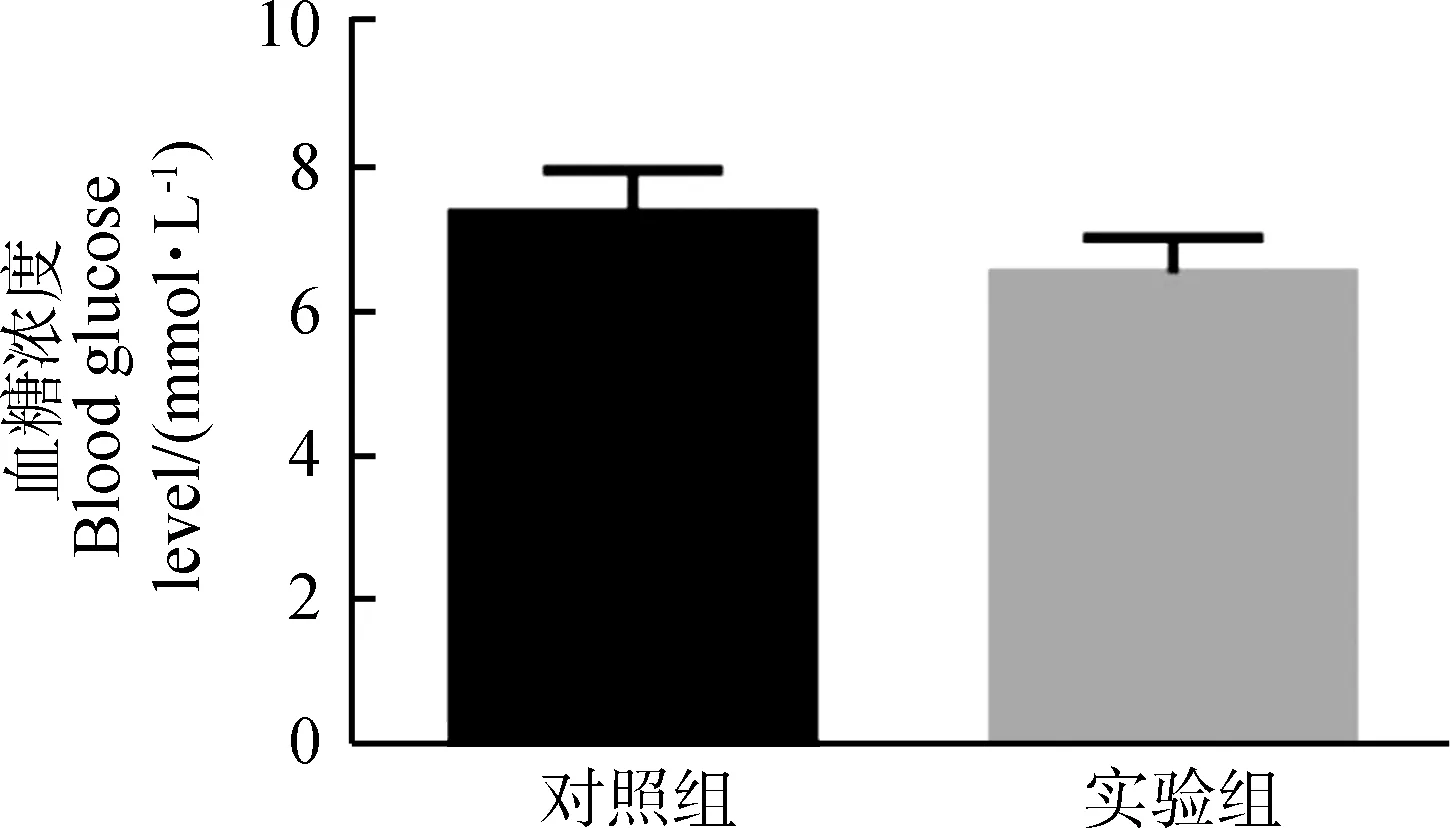
**0.001 实验组与对照组血清瘦素浓度之间的差异无统计学意义(P>0.05,实验组n=9,对照组n=8;图3),血糖浓度差异也无统计学意义(P>0.05,实验组n=7,对照组n=6;图3)。 图3 对照组和实验组血清瘦素浓度与血糖浓度比较Fig. 3 Comparison of serum leptin concentration and blood glucose level between control group and experimental group 与对照组相比,实验组布氏田鼠总饮水量极显著增加(P<0.01,实验组:n=6,对照组:n=6,时间=2 700 min;图4:A)、总能量消耗量显著下降(P<0.05,实验组:n=6,对照组:n=6,时间=2 700 min;图4:B)、总耗氧量显著下降(P<0.05,实验组:n=6,对照组:n=6,时间=2 700 min;图4:C)、呼吸交换率(respiratory exchange rate, RER;RER=CO2产出量/O2消耗量)显著提高(P<0.05,实验组:n=6,对照组:n=6,时间=1 800 min;图4:D)、总自主运动量显著下降(P<0.05,实验组:n=6,对照组:n=6,时间=2 700 min;图4:E)、体质量显著增加(P<0.05,实验组:n=6,对照组:n=6,时间=10 d;图4:F)。 图4 对照组和实验组的基础代谢率比较 *0.01 呼吸交换率是相同时间内释放CO2与吸收O2体积或摩尔数的比值,且有研究表明,O2消耗量也是影响体质量与脂肪储存的机制之一。研究发现,高呼吸交换率表明脂肪的高氧化率以及碳水化合物的低氧化率(Schutz,1995);同时研究发现,呼吸交换率与体质量的增加有关,呼吸交换率提高会导致体质量增加(Haineretal.,2000;Marraetal.,2004)。本实验结果表明,与对照组相比,实验组布氏田鼠的呼吸交换率显著提高,说明实验组倾向于减少脂肪的消耗而增加糖的消耗,且实验组的能量消耗、活动量以及耗氧量显著下降,为脂肪积累创造了条件,最终导致肥胖。 在伏隔核区注射Jak/Stat3抑制剂后布氏田鼠体质量显著增加,而血糖与血清瘦素水平却没有显著变化,从而验证了布氏田鼠可以作为研究“健康性肥胖”的模型动物(Liuetal.,2016)。实验组布氏田鼠的饮水量显著增加,由此可见,布氏田鼠是一种可应用于研究代谢与饮食的潜在实验模型动物。 瘦素在控制能量代谢以及饮食功能上的重要性毋庸置疑,但是不同脑区瘦素水平的差异及其对代谢和神经调控的影响还不确定。目前的研究结果显示,瘦素抵抗主要分为外周性瘦素抵抗和中枢性瘦素抵抗。本实验研究发现,在布氏田鼠伏隔核区注射Jak/Stat3抑制剂后,P-Stat3表达量和瘦素水平显著下降,而血清瘦素浓度却无显著变化,由此可见,使用抑制剂后只是导致中枢性瘦素抵抗,没有造成外周性瘦素抵抗。造成中枢性瘦素抵抗的原因可能有2种:一是伏隔核区Jak/Stat3信号通路被抑制,导致leptin-Stat3信号通路传导障碍,从而直接导致中枢性瘦素抵抗;二是伏隔核区Jak/Stat3信号通路被抑制后,间接降低血清瘦素的血脑屏障转运功能,从而降低脑组织中瘦素水平,最终导致中枢性瘦素抵抗(Banks,2001)。由此可见,leptin-Stat3信号通路被抑制会导致中枢性瘦素抵抗,调控布氏田鼠伏隔核区的leptin-Stat3信号通路能够调控基础代谢,进而在短期内改变其体质量。需要进一步实验证明瘦素和P-Stat3调控下游通路的具体机制。 致谢:感谢孙秀萍老师对实验的指导,以及张楠师兄和田静的帮助。 Banks WA. 2001. Enhanced leptin transport across the blood-brain barrier by alpha 1-adrenergic agents[J]. Brain Research, 899(1-2): 209-217. Bouret SG, Draper SJ, Simerly RB. 2004. Trophic action of leptin on hypothalamic neurons that regulate feeding[J]. Science, 304(5667): 108-110. Chekhranova MK, Karpova SK, Iatsyshina SB,etal. 2008. A new mutation c.422C>G (p.S141C) in homo- and heterozygous forms of the human leptin gene[J]. Bioorganicheskaia Khimiia, 34(6): 854-856. Fatima W, Shahid A, Imran M,etal. 2011. Leptin deficiency and leptin gene mutations in obese children from Pakistan[J]. International Journal of Pediatric Obesity, 6(5-6): 419-427. Fischer-Posovszky P, von Schnurbein J, Moepps B,etal. 2010. A new missense mutation in the leptin gene causes mild obesity and hypogonadism without affecting T cell responsiveness[J]. The Journal of Clinical Endocrinology & Metabolism, 95(6): 2836-2840. Hainer V, Kunesova M, Parizkova J,etal. 2000. Respiratory quotient in obesity: its association with an ability to retain weight loss and with parental obesity[J]. Sborník Lékarsky, 101(1): 99-104. Laing BT, Do K, Matsubara T,etal. 2016. Voluntary exercise improves hypothalamic and metabolic function in obese mice[J]. Journal of Endocrinology, 229(2): 109-122. Liu XY, Yang DB, Xu YC,etal. 2016. Photoperiod induced obesity in the Brandt’s vole (Lasiopodomysbrandtii): a model of 'healthy obesity?[J]. Disease Models & Mechanisms, 9(11): 1357-1366. Lou MF, Shen W, Fu RS,etal. 2015. Maternal dietary protein supplement confers long-term sex-specific beneficial consequences of obesity resistance and glucose tolerance to the offspring in Brandt’s voles[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 182: 38-44. Marra M, Scalfi L, Contaldo F,etal. 2004. Fasting respiratory quotient as a predictor of long-term weight changes in non-obese women[J]. Annals Nutrition Metabolism, 48(3): 189-192. Mazen I, El-Gammal M, Abdel-Hamid M,etal. 2009. A novel homozygous missense mutation of the leptin gene (N103K) in an obese Egyptian patient[J]. Molecular Genetics Metabolism, 97(4): 305-308. Patterson CM, Bouret SG, Dunn-Meynell A,etal. 2009. Three weeks of postweaning exercise in DIO rats produces prolonged increases in central leptin sensitivity and signaling[J]. American Journal of Physiology Regulatory Integrative Comparative Physiology, 296(3): R537-R548. Schutz Y. 1995. Abnormalities of fuel utilization as predisposing to the development of obesity in humans[J]. Obesity, 3(S2): 173S-178S. Strobel A, Issad T, Camoin L,etal. 1998. A leptin missense mutation associated with hypogonadism and morbid obesity[J]. Nature Genetics, 18(3): 213-215. Thakur S, Kumar A, Dubey S,etal. 2014. A novel mutation of the leptin gene in an Indian patient[J]. Clinal Genetics, 86(4): 391-393. Wabitsch M, Funcke JB, Lennerz B,etal. 2015. Biologically inactive leptin and early-onset extreme obesity[J]. The New England Journal of Medicine, 372(1): 48-54. Zhang XY, Lou MF, Shen W,etal. 2017. A maternal low-fiber diet predisposes offspring to improved metabolic phenotypes in adulthood in an herbivorous rodent[J]. Physiological Biochemical Zoology, 90(1): 75-84.2.3 血清瘦素浓度与血糖浓度变化
2.4 代谢实验
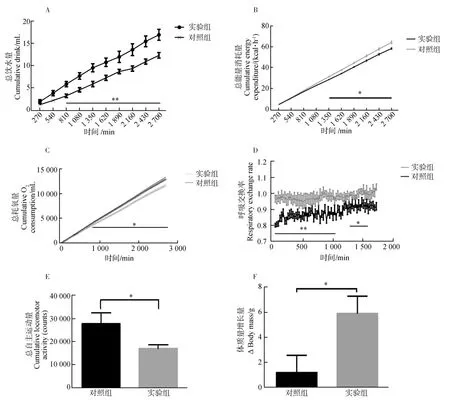
Fig.4 Comparison of basal metabolic rate between control group and experimental group3 讨论

