高油酸含量甘蓝型油菜BnaLCR78基因的克隆、表达及过表达载体的构建
余世聪,梁 浩,李 壮
(四川农业大学 农学院,四川 成都 611130)
【研究意义】油菜是一种重要的油料作物,在我国的食用油市场占有无法取代的地位。一直以来,油菜种子中不同脂肪酸含量的调控都是油菜品质育种的核心。油菜按照其形态和特性可以分为白菜型油菜、芥菜型油菜和甘蓝型油菜,其中甘蓝型油菜的种植面积最大。所以,甘蓝型油菜种子发育过程中脂肪酸合成相关基因的筛选与功能鉴定,具有重要意义。【前人研究进展】在对甘蓝型油菜种子发育前、后两个时期种子EST文库SSH消减中,前人发现的一个与油脂合成相关的候选基因,命名为BnaLCR78。通过序列比对,该基因的cDNA电子克隆序列与拟南芥LCR23基因的同源性最高,预测属于LCR基因家族[1]。已知的拟南芥LCR基因家族包含86个成员,目前已经注释的LCR家族基因主要有两个功能,一部分被认为参与植物的防御反应,另一些基因则被认为具有辅助开花植物柱头快速识别花粉的能力。这类LCR基因很大部分可以编码一个小片段PCP(pollen coat protein)蛋白家族。PCP蛋白家族往往含有一个可以与SLG结合的特殊结构域。1998年人们首次得到油菜PCP-A1基因序列,通过原位杂交,确定该基因作用区域定位在油菜花粉壁并推测这个基因编码是一个花粉壁防御蛋白(defensin-like protein )[2]。在对自交不亲和基因SLG(S locus glycoprotein)的研究中发现,编码PCP-A1的基因与SLG有连锁效应,具备结合SLG的能力[3]。随后研究发现,油菜PCP-A1蛋白还可与转录抑制蛋白SLR1 (S locus-related glycoprotein 1)结合,增强柱头的粘性[4]。同年,能与SLR1结合的SLG-BP蛋白被分离出来,对SLR1基因的沉默表达验证PCP-A1通过与SLR1结合影响花粉与柱头的结合[5]。对拟南芥LCR23突变体的形态研究发现,这一突变体和野生型在花粉管生长和受精过程中并无明显差异。但是LCR23突变体的种子花生烯含量降低16 %,芥酸含量升高了7 %。故而推测其具备在拟南芥种子发育中调控脂肪酸的合成的功能。此后对AtLCR23基因研究中发现这一基因在拟南芥盛放的花中较高表达,在刚形成的果荚中少量表达。使用AtLCR23基因对这一拟南芥突变体互补表达证明这个基因在已授粉花的柱头及花丝花药中和发育前期果荚的柱头上有所表达,印证AtLCR23基因与授粉和果荚发育相关[6]。使用用BnaLCR78基因对拟南芥野生型和LCR23突变体过表达所得到的转基因拟南芥植株相比野生型呈现明显的长势弱小、开花提前、结实率低、种子解构松散、种皮表面刺突数目减少。转基因植株对环境敏感,叶片易感病死亡,抗病性降低[1]。利用BnaLCR78基因互补拟南芥LC23突变体以得到性状恢复的预估尚未实现。长久以来,前人将研究的重点集中于脂肪酸合成相关基因的克隆和功能验证[7-8],脂肪酸合成通路中的众多相关基因被研究得相当深入[9]。油菜油脂合成是多基因调控的一个性状,新基因的发现与研究对未来油菜品质育种很有指导意义。BnaLCR78候选基因的功能研究仍然处于初级阶段,目前尚无法明确这个基因在油菜发育阶段中的具体功能。【本研究切入点】本实验在高油酸材料(保持系100B的高油酸航空诱变材料)中克隆得到BnaLCR78基因的基因组和cDNA序列,分析其在油菜种子发育期中不同阶段的表达量,预测该基因的蛋白功能并构建该基因的过表达载体。【拟解决的关键问题】为后续深入研究该基因在甘蓝型油菜中的功能奠定一定的基础。
1 材料与方法
1.1 供试材料
1.1.1 植物材料 高油酸材料(保持系100B的高油酸航空诱变材料,本实验室留存)。
1.1.2 质粒、工具酶及试剂 P-EASY-simple-T载体、大肠杆菌(Escherichiacoli)菌株DH5α购自全式金公司。表达载体pCAMBIA1301购自南京钟鼎生物技术公司。植物DNA提取试剂盒、DEPC、Tris、RT-PCR试剂盒、DNA纯化回收试剂盒、氨苄青霉素、卡那霉素、LATaqDNA聚合酶、dNTP购自TaKaRa公司;KOD FX DNA聚合酶购自TOYOBO公司;DNA Marker DL2000 DL5000、质粒DNA提取试剂盒购买于天根生化,trizol购自Invitrogen公司。
1.1.3 主要实验仪器 台式高速冷冻离心机(Thermo公司),琼脂糖凝胶电泳系统(BIO-RAD公司),PCR热循环仪(BIO-RAD),ABI Prism7300荧光定量仪,凝胶成像系统(BIO-RAD),恒温振荡器,超净台,恒温摇床,超低温冰箱。
1.2 油菜DNA提取
取0.1 g叶片在液氮中充分研磨后,转入预冷的离心管中,加预热的2×CTAB提取液800 μl,摇匀后65 ℃ 轻摇温浴45 min;加等体积氯仿︰异戊醇(24︰1),至下层液体变为深绿,10 000 r/min离心10 min,取上清,重复上一步骤;取上清,加等体积异丙醇(预先置于4 ℃冰箱中),匀混1~2 h,-20 ℃冰箱冷藏30 min。平转EP管直至DNA析出后挑至离心管,用400 μl 75 %乙醇洗涤2次,无水乙醇洗涤1次;风干DNA,加入适量无菌水溶液充分溶解后, -20 ℃保存[10]。
1.3 第一链cDNA的合成
采用Trizol (Invitrogen, Carlsbad, CA, USA)法提取油菜总RNA。取0.1 g叶片在液氮中充分研磨后,转入预冷的离心管中,再加1 mL的Trizol充分混匀。将匀浆样品室温下放置5 min,加入氯仿至管口,剧烈震荡15 s,室温放置3 min。4 ℃、1200 r/min离心10 min。取水相,转移到新的离心管中。加入500 μl异丙醇,混匀,室温放置20 min。4 ℃、1200 r/min离心10 min,去上清。加入1 mL的75 %乙醇洗涤沉淀,去上清,重复上一步骤。放置晾干后,加入40 μl的RNase-free ddH2O(RF-H2O)充分溶解RNA,电泳检测紫外定量后-70 ℃保存。使用DNAaseI去除基因组DNA并进行反转录反应制备cDNA第一链。
1.4 BnaLCR78 基因组DNA和cDNA序列克隆
根据彭琦公布的BnaLCR78的基因组序列设计引物,引物序列为:5’-ATGGGTGCAGGTGGAAGAATGCAAG-3’/5’-TCATAACTTATTGTTGTA CCAGAACACACC -3’。反应模板分别选取提取所得DNA和反转录所得cDNA第一链。反应程序为:94 ℃ 4 min,94 ℃ 40 s,58 ℃ 40 s、72 ℃ 30 s,72 ℃ 7 min,35个循环;PCR产物用琼脂糖纯化回收试剂盒进行纯化回收(Tiangen,北京)。产物与P-EASY-simple-T载体连接转化大肠杆菌感受态(Escherichiacoli)DH5α(TransGen Biotech, 北京)。经蓝白斑筛选, 经PCR鉴定确定为阳性克隆的转化子由上海Invitrogen公司进行序列测定。在GenBank中检索分析测序结果。利用DNAMAN6.0软件进行多序列比对及系统进化树分析。
1.5 生物信息学分析
利用CBS(http://www.cbs.dtu.dk/)网站在线工具ProtParam预测理化性质。从NCBI网站CDD库获得BnaLCR78结构域。利用IBCP(http://npsa-pbil.ibcp.fr)的在线工具SOPMA,对BnaLCR78蛋白的二级结构进行预测,PSORT (http://psort.hgc.jp/form.html)在线预测BnaLCR78的亚细胞定位, Phyre2数据库(http://www.sbg.bio.ic.ac.uk/phyre2/html/)对BnaLCR78三级结构进行预测。
1.6 不同组织中基因的表达检测
按照前文叙述的方法制备油菜油菜开花后27 和35 d的根、茎、叶、果荚cDNA第一链。采用TaqMAN 探针法研究基因的表达(Life Technology, USA)。引物序列如下: 5’-TTGATTGTCGTCAAAA CTGCTATG-3’/5’-TCTCCACCAGCTTTAACATCTTTAAC-3’ Probe: 5’-ACAATGGAGTTGGAAAAT-3’;β-actin内参引物序列如下:5’-CCTGGAATTGCTGACCGTATG-3’/5’-TGCGACCACCTTGATCTTCA -3’, Probe: 5’-CAAAGAGATCACGGCGCTCGCAC-3’为对照。反应程序为:95 ℃ 2 min,95 ℃ 10 s,60 ℃ 30 s,80 ℃ 2 s,40个循环。反应在MJ Research PTC-200荧光定量PCR仪上运行, 3次重复。采用2-ΔΔCt法进行定量分析。
1.7 表达载体构建
根据测序结果设计加入NcoI酶切位点的引物F(5’-GACCATGGCGAAGCTATCATGTTCT-3’),R(5’-TACCATGGAACAATTCCAATTATAAGTAC-3’)。PCR反应程序为:94 ℃ 4 min,94 ℃ 40 s,62 ℃ 40 s、72 ℃ 30 s,72 ℃ 7 min,35个循环。产物经1 %的琼脂糖凝胶电泳回收得到所需的目的片段。以NcoI内切酶酶切pCAMBIA1301载体,酶切产物经1 %的琼脂糖凝胶电泳回收。使用T4连接酶连接载体和目的片段的回收产物。经PCR、单酶切后鉴定检测是否构建成功。
2 结果与分析
2.1 BnaLCR78基因克隆
以高油酸甘蓝型油菜的基因组DNA为模板,可以扩增得到全长376 bp的BnaLCR78核酸片段, BLAST结果与NCBI数据库GeneBank登录的全基因组测序序列(LOC106418077)相似度达到97.07 %,由此认为克隆得到了BnaLCR78基因的基因组全长序列。BnaLCR78的基因组PCR扩增序列与NCBI数据库的拼接序列有所差异,克隆片段在第78~85位碱基处多出7个碱基,该片段属于内含子区域;基因外显子区域的扩增序列与基因组数据库中电子序列相比有3个点突变,但均为无义突变,不影响蛋白序列预测结果(图1)。
使用cDNA为模版克隆可以得到两段长度不同的cDNA片段。其中一条长237 bp的片段与网上公布的该基因的cDNA电子克隆序列相似度很高。另一段长376 bp的片段与这个基因的基因组全长序列一致(图1)。在BnaLCR78中,这一变化会造成片段翻译提前终止,无法通读(图2)。说明在高油酸材料的BnaLCR78基因的转录中存在内含子保留型可变剪切。
2.2 BnaLCR78基因同源性分析
将BnaLCR78基因使用NCBI数据库在线Blast的结果表明,BnaLCR78与拟南芥LCR23基因同源性最高,该基因属于LCR基因家族。经此绘制出BnaLCR78与拟南芥LCR基因家族的同源树(图3)表明,拟南芥(Arabidopsisthaliana)LCR21、LCR22、LCR23、LCR24、LCR27、LCR36和琴叶拟南芥(Arabidopsislyrata)LCR26、LCR27 基因序列与BnaLCR78相似度较高,在线Blast结果同时发现,与BnaLCR78预测蛋白序列接近的蛋白序列多数出现在双子叶植物中。根据这一特征选择了选择了16种常见植物与BnaLCR78相近的蛋白序列进行比对,在不同被子植物种中的相似的蛋白序列均含由高度保守的半胱氨酸位点。从绘制的系统发育树可以发现,BnaLCR78基因与十字花科植物中相似序列最为接近(图4)。

BnaLCR78 genome DNA:BnaLCR78 电子克隆的基因组序列;G-BnaLCR78 genome DNA:高油酸材料中克隆出的DNA基因组序列; G-BnaLCR78-2:内含子保留型的BnaLCR78的cDNA克隆序列。BnaLCR78 cDNA :BnaLCR78的cDNA电子克隆的序列;G-BnaLCR78-1:不保留内含子型的BnaLCR78的cDNA克隆序列;粗下划线标示内含子,细下划线标示与基因组数据库相比添加的片段序列图1 高油酸油菜BnaLCR78基因序列与电子克隆序列的比较Fig.1 Alignment between BnaLCR78 gene sequence in induced, high oleic acid content types of rape and BnaLCR78 gene in electronic cloning
2.3 BnaLCR78蛋白生物信息学预测
ProtParam工具预测表明:BnaLCR78基因编码一个含有78个氨基酸残基的多肽链,分子量8709.07,等电点(pI)4.42。该多肽链带负电残基(Asp + Glu) 10个,带正电残基(Arg + Lys) 6个。其脂肪指数77.31,亲水系数0.162,高于蛋白质平均值,说明这个酶既有亲水性,又有一定的亲脂性。该多肽链的测算稳定系数18.76,较为稳定。SOPMA工具预测显示,BnaLCR78蛋白分别由25、27、19个氨基酸残基组成的α-螺旋(alpha helix)、无规则卷曲(random coil)、延伸链(extended strand)结构组成(图8)。亚细胞定位显示,该蛋白定位于液泡和细胞器以外。CDD在线分析显示,BnaLCR78基因可以编码SLR1-BP结构域,属于PCP家族,具备特异性识别SLR1分泌蛋白的能力(图5)。利用Phyre2数据库对BnaLCR78进行预测蛋白序列的三级结构预测(图6)发现该预测蛋白由分子两端的α螺旋结构包裹形成一个稳定的蛋白质小分子。
2.4 BnaLCR78在不同组织中的表达

G-BnaLCR78-2:保留内含子的BnaLCR78核苷酸序列;G-BnaLCR78-1:不保留内含子的BnaLCR78序列推导的氨基酸序列以大写单字母符号表示,终止密码子以星号(*)表示图2 BnaLCR78 的2种核苷酸序列CDS区及其推测编码的氨基酸序列Fig.2 Two different CDS of BnaLCR78 and their deduced amino acids

LCR基因家族核苷酸和蛋白序列来自NCBI数据库,进化距离分析均采用最大似然法图3 拟南芥LCR基因家族与高油酸油菜BnaLCR78基因的进化树Fig.3 Cladogram of LCR gene family from Arabidopsis and BnaLCR78 gene from high oleic acid content types of rape
为了初步研究该基因的表达模式,对BnaLCR78在不同组织中的表达进行了研究。结果表明,这个基因在根和叶中的表达水平很低,而在茎组织中较高。油菜果荚里,BnaLCR78在开花后27 d的脂肪酸积累初期的表达量依然很低,然而在开花后35 d的脂肪酸积累期的果荚中表达水平迅速提高,接近茎组织内的2倍(图7)。
2.5 过表达载体构建
筛选可以通读的cDNA片段构建pCambia1301-BnaLCR78重组质粒,备于后续研究。为了验证表达载体pCambia1301-BnaLCR78是否被成功构建,采用NcoI单酶切的方式进行酶切鉴定。从图8中可以看出,用NcoI单酶切后发现,在250 bp左右,切出一条清晰的目的条带,说明该表达载体已经构建成功。
3 讨 论
BnaLCR78克隆序列片段与油菜全基因组数据库中158号预测防御蛋白(defensin-like protein)基因(LOC106418128)相同,为同一基因。到目前为止,油菜数据库中预测了47个防御蛋白基因,均未找到明确的功能注释[11]。在基因克隆过程中,我们发现了一个数据库中未曾预测到的可变剪切。可变剪切普遍存在于真核生物的基因表达过程中,在高等植物中具有重要的作用。基因的前体mRNA,通过不同的剪切方式,产生不同的mRNA剪切异构体。可变剪切是调节基因表达的主要原因,导致蛋白组的多样性[12-13]。在植物中,可变剪切的研究集中在剪切复合体的发现和可变剪切在植物抗逆作用中发挥的功能上[14]。普遍认为,植物干旱、寒冷、病害等胁迫的抗逆作用中可以发现植物可变剪切发挥作用[15-16],而进来研究更发现,可变剪切在拟南芥生物钟调节中发挥功能[17],也会对芸薹属植物花期产生影响[18]。除了环境因素诱发之外,对染色体加倍的甘蓝型油菜可变剪切的研究表明,染色体加倍的子代与母本相比,可变剪切发生改变的油菜等位基因比例很高[19-20]。高油酸100B保持系的BnaLCR78基因的cDNA克隆得到两条长度为237、376 bp的序列。经过比对确认,BnaLCR78基因在转录过程中会出现内含子保留型可变剪切。这一内含子保留型mRNA导致转录中提前终止,使得油菜在种子发育过程中可以通过这一方式调整这个基因的功能发挥。BLAST比对后,验证了前人BnaLCR78基因序列与拟南芥LCR家族中AtLCR23基因相近的结论。前人对AtLCR23基因的半定量RT-PCR和GUS染色的结果发现LCR23基因在授粉和果荚发育前期的表达,并由此推断出LCR23在花粉识别和果荚发育中承担了相关功能[6]。虽然在氨基酸序列比对中,BnaLCR78蛋白序列与LCR23存在一些差异,但是在功能上可能仍然比较相似。油菜种子发育时期果荚内的油份的积累具有明显的源库关系和时间性。以在开花后20 d内,油份积累仅占成熟种子的8.35 %~12.32 %,果荚内油份多积累于果皮。开花40 d后,油份积累量达成熟种子油份含量的 72.89 %~94.73 %,果皮内的油酸向种子转移。说明开花后20~40 d的种子发育中至后期是油菜种子脂肪酸积累期[21]。通过对BnaLCR78基因在不同时期和不同器官中的表达量分析证明,在种子发育过程前期(27 d),该基因在果荚中几乎不表达;进入种子发育后期(35 d),基因表达量迅速上升,大量表达,印证了彭琦等前期研究的结论[1]。可以推测BnaLCR78基因可能与油菜种子的脂肪酸代谢及存储有关。BnaLCR78蛋白包含一个可以识别并结合SLR1分子的SLR1-BP结构域,普遍认为, PCP蛋白家族的结构蛋白通常具备这个结构。利用反义载体将SLR1基因反义表达导致花的柱头对花粉的粘着力下降,降低授粉效率[5]。针对水稻SLR1蛋白研究发现,SLR1作为一种转录抑制蛋白,通过与GA信号转导途径中的DELLA蛋白结合来影响该信号转导过程[22]。所以BnaLCR78可能是一种可以结合SLR1蛋白的受体蛋白,通过油菜种子发育后期的转录抑制调控来影响脂肪酸的合成和积累。

a:蛋白序列比对,BnaLCR78与其他物种的氨基酸保守残基用阴影显示;b:蛋白质进化距离,利用最大似然法进化树分析17个生物中相似蛋白基于保守结构域的系统发生关系图4 BnaLCR78蛋白序列与不同物种中与相近序列多重比对和系统进化树Fig.4 Multiple sequence alignment and phylogenetic tree of BnaLCR78 protein between Brassica napus and some similar species

图5 BnaLCR78结构域预测Fig.5 Conserved domains of BnaLCR78 in Brassica napus
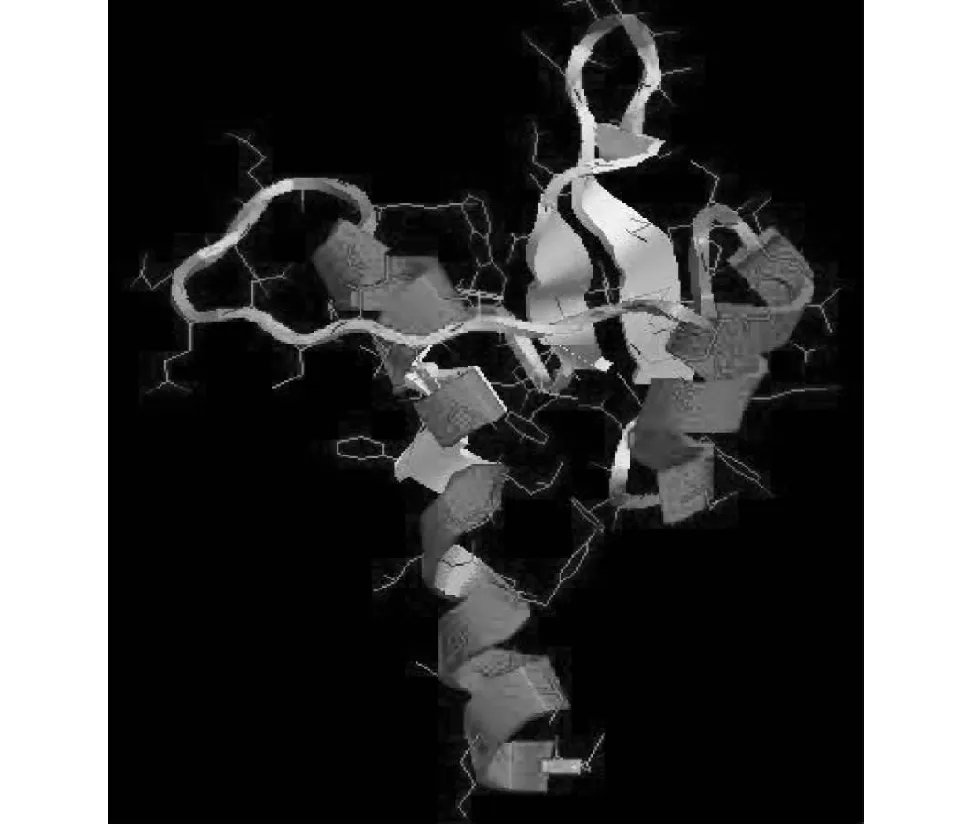
图6 BnaLCR78蛋白三维构象预测Fig.6 Modeling of BnaLCR78

图7 开花后27和35 d不同部位的荧光实时定量PCRFig.7 Result of RTqPCR in various organs 27 and 35 days after flowering
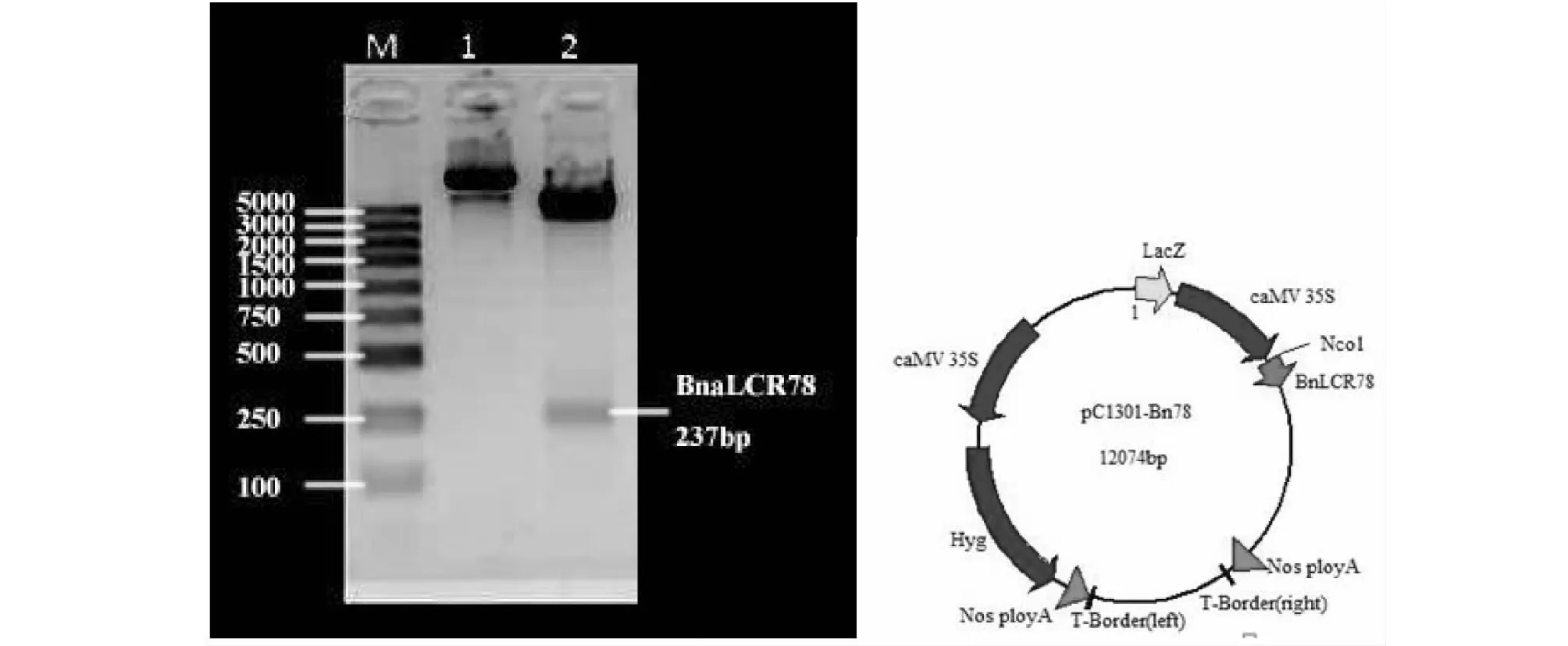
图8 pC1301-Bn78单酶切检测(BnaLCR78基因237 bp)Fig.8 Single digestion analysis of pC1301-Bn78 vector (BnaLCR78 gene 237 bp)
前人使用用拟南芥AtLCR23突变体过量表达BnaLCR78基因无法得到互补表达,转化得到的拟南芥幼苗出现形态变异。在拟南芥转化过程中,BnaLCR78基因是一个异源基因,不同种属间基因的不亲和性往往导致转化苗t0代和t1代变异。这个异源基因的导入可能导致了拟南芥植株的遗传变异或沉默[23]。所以本试验选择全长237 bp的可通读cDNA序列,成功构建PC1301-BnaLCR78过表达载体,以便于继续研究这个问题。
[1]]彭 琦. 与甘蓝型油菜脂肪酸组分形成相关新基因的克隆[D]. 湖南农业大学, 2011.
[2]Doughty J, Dickinson H G. PCP-A1, a defensin-like Brassica pollen coat protein that binds the S locus glycoprotein, is the product of gametophytic gene expression[J]. Plant Cell, 1998, 10(8): 1333-1347.
[3]Suzuki G, Kai N, Hirose T, et al. Genomic organization of the S locus: Identification and characterization of genes in SLG/SRK region of S(9) haplotype ofBrassicacampestris(syn. rapa)[J]. Genetics, 1999, 153(1): 391-400.
[4]Doughty J, Yan W, Dickinson H G. Cysteine-rich pollen coat proteins (PCPs) and their interactions with stigmatic S (compatibility) and S-related proteins inBrassica: putative roles in SI and pollination[J]. Annals of Botany, 2000, 85(3): 161-169.
[5]Takayama S, Shiba H, Iwano M, et al. Isolation and characterization of pollen coat proteins ofBrassicacampestristhat interact with S locus-related glycoprotein 1 involved in pollen-stigma adhesion[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(7): 3765-70.
[6]易力雄,郭 磊,周雅智,等. 拟南芥AtLCR23基因组织表达分析[J]. 作物研究,2014(3):246-250.
[7]李晓丹. 油料作物种子脂肪酸累积模式及相关基因的克隆与序列比较研究[D]. 中国农业科学院, 2007.
[8]戴晓峰. 油菜脂肪酸合成关键基因的克隆与脂肪酸积累模式研究[D]. 中国农业科学院, 2006.
[9]夏 晗,王兴军,李孟军,等. 利用基因工程改良植物脂肪酸和提高植物含油量的研究进展[J]. 生物工程学报,2010,26(6):735-743.
[10]Murray M G, Thampson W F. Rapid isolation of high molecular weight plant DNA[J]. Nucl. Acids Res., 1980(8): 4321-4325.
[11]Wang X, Wang H, Wang J, et al. The genome of the mesopolyploid crop speciesBrassicarapa[J]. Nature Genetics, 2011, 43(10): 1035-1039.
[12]Matlin A J, Clark F, Smith C W. Understanding alternative splicing: towards a cellular code[J]. Nature Reviews Molecular Cell Biology, 2005, 6(6): 386-398.
[13]Reddy A S N. Alternative splicing of pre-messenger RNAs in plants in the genomic era[J]. Annual Review of Plant Biology, 2007, 58(58): 267-294.
[14]Palusa S G, Ali G S, Reddy A S N. Alternative splicing of pre-mRNAs of Arabidopsis serine/arginine-rich proteins: regulation by hormones and stresses[J]. The Plant Journal, 2007, 49(6): 1091-107.
[15]Mach J. Alternative splicing produces a JAZ protein that is not broken down in response to jasmonic acid[J]. Plant Cell, 2009, 21(1): 14.
[16]Zhang X C, Gassmann W. Alternative splicing and mRNA levels of the disease resistance gene RPS4 are induced during defense responses[J]. Plant Physiology, 2007, 145(4): 1577-1587.
[17]Wang X, Wu F, Xie Q, et al. SKIP is a component of the spliceosome linking alternative splicing and the circadian clock in Arabidopsis[J]. Plant Cell, 2012, 24(8): 3278-95.
[18]Fadina O A, Pankin A A, Khavkin E E. Molecular characterization of the flowering time gene FRIGIDA in Brassica genomes A and C[J]. Russian Journal of Plant Physiology, 2013, 60(2): 279-289.
[19]Adams K. Extensive Changes to Alternative Splicing Patterns Following Allopolyploidy in Natural and ResynthesizedBrassicanapus[J]. Plant & Animal Genome, 2012(2).
[20]Moshgabadi N. Divergence in alternative splicing patterns between duplicated gene pairs in polyploidBrassicanapus[D]. University of British Columbia, 2010.
[21]高建芹,浦惠明,戚存扣,等. 高含油量油菜种子和果皮油份积累及主要脂肪酸的动态变化[J]. 中国油料作物学报,2009,31(2):173-179.
[22]Eckardt N A. Foolish seedlings and DELLA regulators: the functions of rice SLR1 and Arabidopsis RGL1 in GA signal transduction [M].// Topologie und Analysis. Springer-Verlag, 1985: 1-5.
[23]曾凡锁,詹亚光. 转基因植物中外源基因的整合特性及其研究策略[J]. 植物学报,2004,21(5):565-577.

