4个俄罗斯黑加仑品种对盐胁迫的生理响应比较分析
古丽江·许库尔汗,张东亚,孙雅丽,阿依古丽·铁木儿,卢明艳,哈尔肯·叶尔江
(新疆林业科学院,新疆 乌鲁木齐 830000)
【研究意义】土壤盐渍化是全世界公认的农业和生态问题,是目前影响植物生长发育的主要非生物因素之一[1]。盐渍化土壤在植物生长的最初影响是降低叶片的扩展速率,随着胁迫程度的增强叶片停止扩展[2]。它又能打破植物的营养平衡,抑制植物对其它离子进行吸收和转运,改变植物细胞内渗透压,从而导致膜完整性的破坏和某些酶功能的降低[3]。目前,国内许多果树生产区土壤盐渍化现象严重,较高的含盐量使土壤盐碱性过大,影响了植株光合作用及能量代谢,导致果树产量和品质下降[4]。主要表在两方面,一是盐胁迫引起植物生理干旱,另一个是盐胁迫引起植物体离子毒害,同时还会抑制植物生长,严重时会造成植物死亡。新疆是闻名世界的瓜果之乡,气候资源非常适宜各类果树的生长发育,但是新疆413.35×104hm2耕地中,土壤次生盐渍化面积达126.39×104hm2,占耕地面积的30.58 %[5],严重影响了新疆林果业的持续健康发展。因此选育耐盐果树品种,了解盐胁迫下植物的耐盐反应和耐盐机理是摆在林业科技工作者面前的大课题,而且栽培推广耐盐植物是改良和利用盐碱地的有效措施[6]。因此,研究果树的耐盐性及其机理具有重要的现实意义。近年来,林果业科技工作者对不同果树耐盐性作了大量研究工作,但对黑加仑(RibesnigrumL.)耐盐性的研究鲜见报道。【前人研究进展】目前,对黑加仑的研究主要集中在引种栽培[7]、生物学特性[8]、扦插育苗[9]、果实营养成分分析[10]、光合特性研究[11]等方面。黑加仑是抗寒性较强的小浆果类果树,经济、社会及生态价值较高,但新疆北疆地区平原区的盐渍化土壤严重制约了当地黑加仑等小浆果产业的健康发展。【本研究切入点】因此,本研究对黑加仑在盐胁迫条件下的不同生理指标响应比较分析,旨在探讨黑加仑在盐胁迫时主要生理的变化状况,为下一步黑加仑的耐盐性研究提供参考依据。本试验以黑加仑1年生扦插苗为试材,比较分析了4个黑加仑品种在不同盐浓度胁迫下的生理响应。黑加仑4个品种均引自俄罗斯西伯利亚M.A.理萨文克园艺研究所,具备较强的耐寒特性,在新疆大田越冬试验,3月低4月初全部发芽成活,虽然黑加仑具备一定的耐盐性,但是对其耐盐能力及适生范围还不了解,要使这些优良品种能够在我区北方盐碱地区得到推广,就必须具备系统而有力的相关数据[12]。【拟解决的关键问题】因此,本研究通过不同浓度盐胁迫处理4个黑加仑品种苗木,测定和探讨黑加仑在不同浓度盐分胁迫下各生理指标的变化规律,探索其耐盐能力及其机理,为今后黑加仑栽培管理和耐盐碱品种筛选提供科学指导。
1 材料与方法
1.1 试验材料
供试的试验材料为从俄罗斯西伯利亚M.A.理萨文克园艺研究所引进的2年生4个黑加仑品种拉玛、克休沙、杂交新星和斯塔别恩克。2014年12月将已进入休眠期的4个黑加仑品种当年生枝条剪下带回实验室,剪成带有2~3个芽的12~14 cm长插条,蒸馏水冲洗后放入三角瓶里水培生根。
1.2 试验用土
试验用土为黑色森林土, 清除杂草、杂质充分拌匀。
1.3 试验用花盆
试验用花盆统一购置的 22 cm × 25 cm 专用塑料花盆,并购置与花盆相配套的托盘。
1.4 施盐种类
试验用盐为分析纯 NaCl。
1.5 试验设计
试验在新疆林科院经济林研究所院子里进行。参试材料防止被雨淋,下雨前用塑料布覆盖。设计4个处理,即0(CK)、0.2 %、0.4 %、0.6 %,每个品种选取长势较好的12棵生根苗,每个处理4棵,重复3次。将备好的土壤按每盆5 kg放入塑料花盆中,盆下安放托盘。将水培生根的黑加仑品种拉玛、克修沙、杂交新星和斯塔别恩克分别移栽到花盆里,并长出2~3片功能叶开始用备好的3个浓度梯度的盐溶液和清水(对照)每5 d浇灌1次进行胁迫处理,每次500 mL,处理30 d后,采集相同部位的功能叶,用于生理指标的测定。
1.6 测定项目与方法
可溶性糖和可溶性蛋白含量参照邹琦的蒽酮法比色法、考马斯亮蓝G-250染色法[13]测定;脯氨酸和丙二醛含量参照酸性茚三酮染色法、硫代巴比妥酸法(TBA)[14]测定;电解质外渗率(REC)参照电导率法[15]测定。
1.7 数据处理
试验数据用Excel2003进行整理,差异显著性分析采用SPSS 16.0软件中的Duncan氏方法完成。采用主成分分析对4个黑加仑品种的抗盐能力进行综合评定。主成分分析计算方法如下:①运用SPSS16.0软件,计算各因子的特征值,方差贡献率与累积贡献率;②采用主成分法提取特征值λ>1的主因子,并采用最大方差法进行正交旋转;③对5个抗盐性指标进行主成分分析,将主成分载荷矩阵中的数据用Ai=Bi/SQR(λ)公式计算特征向量(Ai),通过得到的特征向量与标准化后的数据相乘,得出主成分表达式;④以每个主成分的特征值占所提取主成分总特征值比例作为权重,构建主成分综合模型,利用该模型计算综合得分,并排序。
2 结果与分析
2.1 盐胁迫对黑加仑不同品种叶片可溶性糖含量的影响
可溶性糖是植物生长发育和基因表达的重要调节因子,植物体内可溶性糖的变化在生理水平上表征外界环境的干扰程度[16]。由图1可以看出,对照中拉玛叶片的可溶性糖含量最高,为0.738 %,克修沙的最低,为0.192 %;当盐溶液浓度增加到0.2 %时,拉玛、杂交新星和斯塔别恩克叶片的可溶性糖含量逐渐上升,并且与对照相比具有极显著差异(P≤0.01),而克修沙的可溶性糖含量与对照无显著差异(P≥0.05)。由于品种的不同,随着胁迫的加剧,其变化也不同。当盐胁迫程度达到0.4 %时4个品种叶片的可溶性糖含量均呈迅速上升趋势,并且与对照的可溶性糖含量具有极显著差异(P≤0.01)。在盐胁迫程度达到0.6 %时4个品种叶片的可溶性糖含量与对照差异极显著(P≤0.01),其中拉玛和克修沙叶片的可溶性糖含量继续上升,并且拉玛的可溶性糖含量比对照上升了336.99 %,克修沙的可溶性糖含量上升较缓慢,比对照上升了146.35 %;而交新星和斯塔别恩克叶片的可溶性糖含量开始逐渐下降,虽然比0.4 %时的盐胁迫下降了10.89 %、11.36 %,但比对照上升了255.56 %、274.67 %。表明较高的盐胁迫会增加叶片可溶性糖含量来抵御逆境胁迫对植物的危害。

图1 盐胁迫下4个黑加仑品种可溶性糖含量的变化Fig.1 Changes of soluble sugar content in four Ribes nigrum L. varieties under the stress
2.2 盐胁迫对黑加仑不同品种叶片可溶性蛋白含量的影响
可溶性蛋白是植物的渗透调节剂之一,高盐胁迫使植物细胞中蛋白质的合成代谢增强,增加蛋白质含量[17]。由图2可以看出,在对照中4个黑加仑品种的可溶性蛋白含量在1.089~1.574 mg/g,最高为拉玛的可溶性蛋白含量1.574 mg/g,最低为克修沙的可溶性蛋白含量1.089 mg/g。随着盐胁迫的加剧,各品种可溶性蛋白含量的变化也不相同。当盐溶液浓度0.2 %时4个品种可溶性蛋白含量逐渐上升,分别比对照上提高0.73 mg/g、0.25、0.69和1.13 mg/g,并且均与对照有极显著差异(P≤0.01);盐溶液浓度达到0.4 %时各品种可溶性蛋白含量随着上升,其中斯塔别恩克叶片可溶性蛋白含量最高,比对照上提高了3.29 mg/g,其次为拉玛、杂交新星和克修沙比对照提高了2.03、1.312、0.485 mg/g,并且这4个品种均与对照差异极显著(P≤0.01);当盐溶液浓度达到0.6 %时,除克修沙叶片的可溶性蛋白含量比胁迫程度0.4 %时提高0.2 mg/g外,其余品种的可溶性蛋白含量均逐渐下降,分别比0.4 %时下降了1.96、0.72、1.67 mg/g,并且除拉玛与对照无显著差异(P≥0.05)外其余品种均与对照差异极显著(P≤0.01)。

图2 盐胁迫下4个黑加仑品种可溶性蛋白含量的变化Fig.2 Changes of soluble protein content in four Ribes nigrum L. varieties under the stress
2.3 盐胁迫对黑加仑不同品种叶片脯氨酸含量的影响
植物在逆境胁迫下会积累脯氨酸,以稳定原生质胶体及组织内代谢过程[18]。由图3可知,在对照中拉玛叶片的脯氨酸含量最高,为0.0073 mg/g,克修沙叶片的脯氨酸含量最低,为0.0017 mg/g。当盐溶液浓度0.2 %时克修沙、杂交新星和斯塔别恩克等3个品种叶片的脯氨酸含量随着盐胁迫程度的增加逐渐上升,其中只有斯塔别恩克叶片的脯氨酸含量与对照相比有极显著差异(P≤0.01),而拉玛的脯氨酸含量与对照相比未发生变化;当盐胁迫浓度达到0.4 %时,4个品种叶片的脯氨酸含量均上升,并且,克修沙的脯氨酸含量与对照无显著差异外(P≥0.05),其余3个品种叶片的脯氨酸含量与对照相比差异极显著(P≤0.01);当盐胁迫浓度达到0.6 %时,除克修沙叶片的脯氨酸含量继续提高外,其余品种叶片的脯氨酸含量均开始下降,其中拉玛和斯塔别恩克的脯氨酸含量与对照相比差异极显著(P≤0.01),而杂交新星与对照无显著差异(P≥0.05)。
2.4 盐胁迫对黑加仑不同品种叶片MDA含量的影响

图3 盐胁迫下4个黑加仑品种脯氨酸含量的变化Fig.3 Changes of proline content in four Ribes nigrum L. varieties under the stress

图4 盐胁迫下4个黑加仑品种MDA含量的变化Fig.4 Changes of MDA content in four Ribes nigrum.L varieties under the stress
MDA是质膜过氧化的主要产物之一,其含量可反映植物细胞膜系统的受损程度[18]。由图4可看出,总体上4个品种叶片的MDA含量呈现出S型变化趋势。0.2 %盐胁迫时拉玛和克修沙叶片的MDA含量比对照提高了0.0033和0.0044 μmol/g,并且与对照差异极显著(P≤0.01);而杂交新星和斯塔别恩克叶片的MDA含量比对照小幅下降并且与对照无显著差异(P≥0.05)。当盐胁迫浓度达到0.4 %时,随着胁迫浓度的加剧拉玛和克修沙叶片的MDA含量大幅度下降,其中拉玛的MDA含量比对照下降了0.0036 μmol/g,并且差异达到极显著水平(P≤0.01),但克修沙的MDA含量与对照差异不显著(P≥0.05);同样杂交新星和斯塔别恩克叶片的MDA含量与对照差异不显著(P≥0.05)。盐胁迫浓度达到0.6 %时,随着胁迫的进一步加剧,拉玛、和斯塔别恩克叶片的MDA含量逐渐小幅上升,但变化不明显,比对照无显著差异(P≥0.05),克修沙叶片的MDA含量比对照增加,并且达到显著水平(P≤0.05);杂交新星叶片的MDA含量下降,但与对照相比无显著差异(P≥0.05)。
2.5 盐胁迫对黑加仑不同品种叶片电解质外渗率(REC)的影响
电解质外渗率反映叶片电解质的外渗情况,在一定程度上可以反映植物细胞膜透性的变化[19]。

图5 盐胁迫下4个黑加仑品种电导率的变化Fig.5 Changes of relative conductivity in four Ribes nigrum.L varieties under the stress
由图5可以看出,各品种电解质的外渗率总体上呈先上升后逐渐下降趋势。随着盐胁迫浓度的增加各品种电解质外渗率开始上升,胁迫浓度0.2 %时,比对照提高了8.191 %、11.843 %、4.773 %和7.325 %,并且与对照相比差异极显著(P≤0.01);当胁迫浓度达到0.4 %时,随着胁迫的加剧各品种叶片的电解质外渗率继续上升,与对照相比差异极显著(P≤0.01)。胁迫浓度达到0.6 %时,各品种叶片的电解质外渗率逐渐下降,并且拉玛、克修沙和斯塔别恩克的电解质外渗率比对照差异极显著(P≤0.01),杂交新星差异显著(P≤0.05)。
2.6 抗盐指标筛选
主成分分析法可将多个原始指标转换为新的较少的综合指标进行分析,这样就能较好地综合反映黑加仑各品种间的抗盐性差异。表1显示,特征值λ>1的前2个主成分的累计方差贡献率达到83.372 %,说明前2个主成分能够代表原5个品质指标的大部分(83.372 %)信息。因此,可将黑加仑品种的5个抗盐指标综合成2个主成分。
由各抗盐指标在2个主成分中的载荷(表2)可知,第一主成分的贡献率为51.560 %,主要由可溶性糖、脯氨酸、电导率决定;第二主成分的贡献率为31.812 %,主要由可溶性蛋白、丙二醛决定。

表1 相关系数矩阵的特征值、方差贡献率和累计方差贡献率
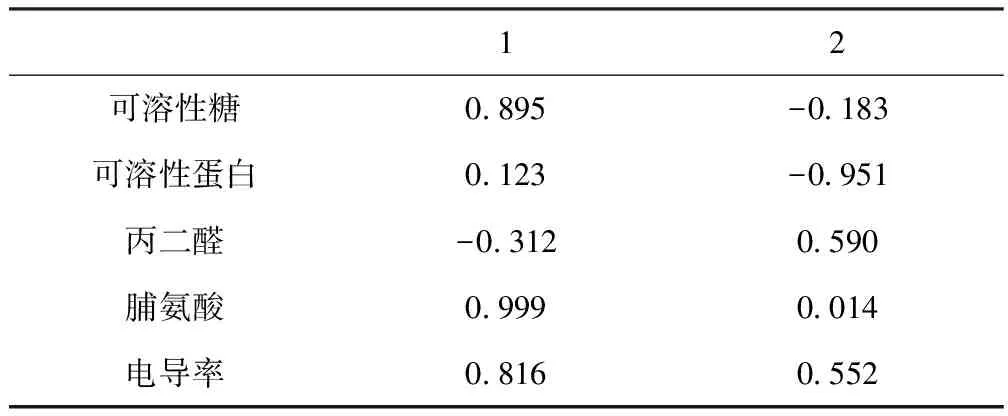
表2 主成分在各品质指标上的载荷矩阵
2.7 黑加仑各品种抗盐性综合评定
通过主成分分析,提取出2个主成分(λ>1),将主成分载荷矩阵中的数据用Ai=Bi/SQR(λ)公式计算特征向量(Ai),其中Bi为主成分载荷矩阵,λ为特征值;计算得出的特征向量矩阵如表3所示。得到的特征向量和标准化后的数据相乘,然后就可以得出各主成分表达式。根据计算结果,得到各主成分的表达式如下所示。其中,F1、F2为2个主成分,ZX1~ZX5为原始数据5个品质指标标准化的数值。
F1=0.557ZX1+0.077ZX2-0.194ZX3+0.622ZX4+0.508ZX5
F2=-0.145ZX1-0.754ZX2+0.468ZX3+0.011X4+0.438ZX5
以每个主成分的特征值占所提取主成分总特征值比例作为权重,计算主成分综合模型:F=0.618F1+0.382F2。运用此数学模型对4个黑加仑品种抗盐性进行综合评价和排序。综合得分越高,该品种的综合品质越好。表4可以看出,各黑加仑品种综合得分不同。各品种综合得分排序为拉玛>克休沙>斯塔别恩克>杂交新星。
3 讨 论
盐分胁迫通过对植物地下根系和地上部分组织产生作用,影响植物的生长发育和生理活动。盐分胁迫下植物生成一些渗透调节物质,并积累一些大分子物质,淀粉蛋白质分解成小分子物质如糖、氨基酸。这些小分子物质有较强亲水性,可以稳定胶体性质,在组织代谢中使植物细胞免受伤害或使伤害减轻[20]。

表3 2个主成分的特征向量
可溶性糖是很多植物主要的渗透调节剂,也是合成其他有机溶质的碳架和能量来源,对细胞膜和原生质胶体起稳定作用[21-22]。有研究表明[23-24],在逆境胁迫下,植物积累的可溶性糖越多,其抗逆性就越强。本研究中,盐胁迫浓度对黑加仑品种的可溶性糖含量有明显的影响,而且与盐浓度梯度呈正比,这与盐胁迫使婉豆、大米草和番茄等植物体内可溶性糖含量增加[25-27],是植物对盐胁迫环境适应性的表现等研究结果相吻合。可溶性糖的含量可作为黑加仑耐盐性评价的主要指标。
可溶性蛋白也是主要的植物渗透调节剂,对缓解由逆境造成植物的伤害具有十分重要的作用。高盐胁迫使植物细胞中蛋白质的合成代谢增强,增加蛋白质含量,降低细胞的渗透势,提高植物的保水能力[28]。本研究中,盐溶液浓度达到0.4 %时斯塔别恩克叶片可溶性蛋白含量最高,比对照提高了3.29 mg/g,其次为拉玛2.03 mg/g。盐胁迫达到0.6 %时各品种可溶性蛋白含量开始下降,这表明这些品种具有能耐0.4 %≧的盐胁迫的适应能力。这与盐胁迫下,甘草、甘薯、黄瓜等植物体内的可溶性蛋白含量均上升[29-31],这是植物适应盐胁迫的一个正常生理反应的结果相一致。

表4 4种黑加仑品种耐盐性综合得分和排序
脯氨酸是多种植物体内最有效的一种亲和性渗透调节物质,具有降低细胞质中的水势、维持细胞内的水分平衡、稳定细胞结构和保护生物大分子的作用[32-33],从而影响植物的抗逆性。研究表明,盐胁迫激活植物体内脯氨酸等含氮化合物的生物合成,并通过维持渗透调节,稳定蛋白质,增强植物对逆境的适应能力[34]。本研究中,盐胁迫浓度达到0.4 %时,4个品种叶片中的脯氨酸含量比较接近,盐胁迫浓度达到0.6 %时,只有克修沙叶片的脯氨酸含量上升到最高,其余品种的脯氨酸含量均开始下降,脯氨酸含量的高低取决于盐浓度的高低,超出脯氨酸能渗透调节范围之外的盐胁迫会对黑加仑品种叶片细胞产生严重的伤害。孙金月等研究表明,脯氨酸可以作为一种渗透调节物质评价小麦品种耐盐性的参考指标,它的含量可以反应植物的耐盐性[35]。因此,0.4 %的盐胁迫浓度对各黑加仑品种叶片比较能耐受的浓度。
盐胁迫下植物细胞内无机离子大量累积,导致活性氧的产生与清除之间的动态平衡被破坏,细胞通过各种途径产生H2O2,H2O2与O2相互作用可直接引发膜脂过氧化作用,膜内拟脂双分子层中含有的不饱和脂肪酸链被氧化分解,导致细胞膜结构遭到破坏,膜系统的完整性丧失,进而引起电解质外渗[36],电导率增加。叶片相对电解质渗透率和植物细胞膜关系密切[37]。本研究中,随着胁迫的加剧,电导率和脂肪酸的过氧化产物MDA含量升高,拉玛、克修沙、斯塔别恩克和杂交新星斯4个品种叶片细胞内积累大量活性氧自由基,其中克修沙叶片细胞内活性氧自由基的积累程度大于其余3个品种;且盐胁迫0.4 %时各品种膜透性达到了最高值,达到0.6 %时膜透性逐渐下降,并与盐胁迫浓度0.2 %时的相同,表明了不同黑加仑品种在高盐分土壤中膜相对透性均随盐分浓度的增大而较快上升后缓慢下降,但达到一定盐分梯度后保持稳定。这与吕延良白蜡等4个树种盐胁迫下生理生化反应的研究结果一致[38]。
4 结 论
植物耐盐性是一个多基因控制的数量形状[39],这也决定了植物抗盐机理的复杂性。黑加仑不同品种对盐胁迫的生理响应是由各种因素共同作用的结果,品种基因型、个体特征、温湿度和立地环境条件等相互协调,共同参与植物对逆境的适应性。从本研究结果来看,4个黑加仑品种通过不同盐胁迫梯度的生理特性变化所表现的耐盐能力间具有一定的差异。拉玛和克修沙在试验中表现出较其它2个品种强的耐盐性。主要表现在较高的可溶性糖含量和脯氨酸含量,这些品种通过这些渗透调节物质,可增强自身的耐盐性能。表明这2个品种除了作为果树生产中发展应用外,还可用于丰富城市绿化景观树种的优良材料。对黑加仑耐盐性的研究,为将来在我国北方地区,尤其是西北地区的小浆果产业中推广应用以及选育优良品种提供了理论基础,同时为其它植物的耐盐性研究提供了可借鉴的资料。
评价植物耐盐性的指标很多,不能简单的几个指标来反映其耐盐性,必须从所研究树种的耐盐形态特征、盐胁迫下存活和生长状况等方面综合考虑。生产实践表明,具有广泛适应性的品种,即使种植在有不确定的胁迫因子存在的低产环境条件下,也有可能达到优良的表现水平[40]。黑加仑的的耐盐性与诸多因素有关,如地上地下部分的生物量、根茎的组织结构及生理效应等,本文只对黑加仑叶片的5项生理指标与耐盐性的关系作了测定与分析,对综合因素的影响今后还需要进行更深入的研究。
[1]Allakhverdiev S I,Sakamoto A,Nishiyama Y,et al.Ionic and osmotic effects of NaC1-induced inactivation of photosystems I and II inSynechococcussp[J].Plant Physiology,2000,123:1047-1056.
[2]Wang Y,Nil N.Changes in chlorophyll,ribulose biphosphate carboxylase-oxygenase,glycine betaine content,photosynthesis and transpiration in Amaranthus tricolor leaves during salt stress[J].J Hortie Sci Biotech,2000,75:623-627.
[3]张腾国,寇明刚,王圆圆,等. 盐胁迫对两种油菜叶片生理指标的影响[J]. 西北师范大学学报,2014,50(5):85-90.
[4]陈明贤.福建省火龙果种质资源ISSR 分析及耐盐生理研究[D].福州:福建农林大学,2012.
[5]木合塔尔·吐尔洪,木尼热·阿布都克力木,西崎·泰,吐尔迪·阿不利孜,等. 新疆南部地区盐渍化土壤的分布及性质特征[J].环境科学与技术,2008,31(4):22-26.
[6]赵庆柱,杨志莹,邱玉宾,等.NaCI胁迫对银槭幼苗生长及部分生理特性的影响[J].中国农学通报, 2015,31(19):19-24.
[7]李学君,朱力国,谢孝坤.5个俄罗斯黑穗醋栗品种在黑龙江黑河的表现[J].中国果树,2011(4):34-36.
[8]陈建伟,杨荣慧,王延平. 黑穗醋栗生物学特性与适生生态环境条件研究[J].西北农业学报,2006,15(5):236-239.
[9]朱映安,和加卫,和秀云,等.黑穗醋栗的扦插繁殖技术研究[J].现代农业科技,2007(15):6-7.
[10]霍俊伟,李著花,秦 栋.黑穗醋栗营养成分和保健功能及产业发展前景[J].2011,42(2):139-144.
[11]霍俊伟,张壮飞,秦 栋. 高温胁迫对黑穗醋栗幼苗光合特性的影响[J].东北农业大学学报,2012,43(10):79-84.
[12]崔晓涛.新西伯利亚银白杨耐干旱和耐盐碱能力研究[D].东北林业大学硕士学位,2009.
[13]邹 琦.植物生理学实验指导[M].北京:中国农业出版社,2004(4):111-112.
[14]刘家尧.植物生理学实验教程[M].北京:高等教育出版社,2010:72-75.
[15]郑炳松.现代植物生理生化技术研究[M].北京:气象出版社,2006:38-41.
[16]孙艳斐.长春花不同生活史型可溶性糖动态变化规律的研究[D].东北林业大学,2007:8-13.
[17]方志红,董宽虎.NaCI胁迫对碱蒿可溶性糖和可溶性蛋白含量的影响[J].中国农学通报,2010,26(16):147-149.
[18]张 军,王新军,于浩世.盐胁迫对小麦幼苗生理生化特性的影响[J].商洛学院学报,29(4):59-62.
[19]代容春,林荣华,何文锦,等.NaCl胁迫对萝 幼苗叶片生理特征及根尖细胞核形态的影响[J].植物资源与环境学报,2012,21(3):63-68.
[20]童 辉,孙 锦,郭世荣,等.等渗Ca(NO3)2和NaCl胁迫对黄瓜幼苗根系形态及活力的影响[J].南京农业大学学报,2012,35(3):37-41.
[21]徐柱文. NaCl 胁迫下五种一年生苜蓿的耐盐性比较研究[D].兰州:甘肃农业大学,2006:7-11.
[22]刘 华,舒孝喜,赵 银,等.盐胁迫对碱茅生长及碳水化合物含量的影响[J].草业科学,1997, 14(1):18-20.
[23]Singh N K. Protein associated with adaptation of culture tobaccocells to NaCl[J]. Plant Physiol,1987,84(2):324-331.
[24]Munns R A. Whole plant responses to salinity[J]. Plant Physiol,1986,13:143-160.
[25]刘新星,罗俊杰.豌豆幼苗在盐胁迫下的生理生态响应[J].草业科学,2010,27(7):88-93.
[26]秦丽凤,石贵玉,李佳枚,等.盐胁迫对大米草幼苗某些生理指标的影响[J].广西植物,2010,30(2):265-268.
[27]杨凤军,李天来,臧忠婧,等.外源钱施用时期对缓解盐胁迫番筋幼苗伤害的作用[J].中国农业科学,2010,43(6):1181-1188.
[28]肖 强,郑海雷,陈 瑶,等.盐度对互花米草生长及脯氨酸、可溶性糖和蛋白质含量的影响[J].生态学杂志,2005,24 (4):373-376.
[29]杨秀红,李建民,董学会,等.盐胁迫对甘草种子发芽与子叶抗氧化指标的影响[J].种子,2006,29(4):30-32.
[30]王兰兰,张立军,陈 贵,等.甘薯愈伤组织对干旱胁迫和盐胁迫的生理反应对比.生态学杂志,2006,25(12):1508-1514.
[31]杜长霞,李 娟,郭世荣,等.外源亚精胺对盐胁迫下黄瓜幼苗生长和可溶性蛋白表达的影响[J].西北植物学报,2007,27(6):1179-1184.
[32]汤章城.逆境条件下植物哺氨酸的累积及其可能的意义[J].植物生理学通讯,1984(1):15-21.
[33]HANDA s,BRESSAN R A,HANDA A K,et a1.Solutes contributing to osmotic adjustment in cultured plant cells adapted to water stress[J].Plant Physiol,1983,73:834-843.
[34]Ghoulam C,Fares K,Ahmed F.Effects of salt stress on growth,inorganic ions and proline accumulation in relation to osmotic adjustmentin five sugar beet cuhivars[J].Environmentals & Sexperimental Botany,2002,47(1):39-50.
[35]孙金月,赵玉田,常汝镇,等.小麦细胞壁糖蛋白的耐盐性保护作用与机制研究[J].中国农业科学,1997,30(4):9-15.
[36]张士功,高吉寅,宋景芝,等.硝酸钙对小麦幼苗生长过程中盐害的缓解作用[J].麦类作物学报,1998,18(5):60-64.
[37]陈长平,王文卿,林 鹏.盐度对无瓣海桑幼苗的生长和某些生理生态特性的影响[J].植物学通报,2000,17(5):457-461.
[38]吕延良.白蜡等4个树种盐胁迫下生理生化反应的研究[D].山东农业大学硕士论文, 2010:6-10.
[39]Foolad M R, Jones R A.Mapping salt-tolerance genes in tomato using trait-based marker analysis[J]. Theor Appl Genet,1993,87:184-192.
[40]王燕平,王晓梅,侯国强,等. 室内模拟干旱对大豆萌发性状的影响及抗旱性评价[J].核农学报,2014,28(6):1133-1141.

