多刺绿绒蒿种子休眠及破除方法*
达清璟 陈学林 管熊娟 张庆雯 张亥贤
(西北师范大学生命科学学院 甘肃兰州 730070)
多刺绿绒蒿(Meconopsis horridulaHook.)为罂粟科绿绒蒿属一年生草本,生长于海拔3 000~5 000 m 的山坡石缝中,植株全体被黄褐色或淡黄色、坚硬而平展的刺(见封面),主要分布于中国青海、西藏、云南和甘肃,以及缅甸、印度、尼泊尔等地[1],多刺绿绒蒿全草为西藏常用中草药,在藏药中属于“刺儿恩类”。《晶珠本草》记载:“刺儿恩”味苦,功效清热,为治头创伤最有效之药,藏医认为其具有接骨、活血化瘀、止痛的作用,多用于治疗头伤、骨折、跌打损伤等症[2]。多刺绿绒蒿以野生为主,生长环境脆弱且储量有限,且近年来的过度开发利用和社会用药需求增长,再加上生境特殊,引种驯化困难,根本无法满足人工栽培的需求。
种子休眠是植物适应环境的繁殖策略之一,但往往给实际生产带来不便[3]。根据Baskin 对种子休眠的分类,多刺绿绒蒿种子休眠的原因为PY+PD(物理休眠和生理休眠)型复合休眠[4]。近年来,在多刺绿绒蒿化学成分[5-6]、药理作用[7-8]、提取分离[9-11]、分类鉴定[12]等方面进行了一系列的研究,有关种子萌发[13]工作多集中在促进其萌发,但是对该种子有关内源抑制萌发物质则鲜有研究。种子萌发抑制物质的研究已有很多报道,如百蕊草种子[14]、北五味子种子[15-16]、黄精种子[17]、龙胆种子[18]等。本实验对多刺绿绒蒿种子内源抑制物质进行了研究,以期为多刺绿绒蒿人工驯化提供技术支撑。
1 材料和方法
1.1 材料 本实验所用种子均于2016年10月采自甘南藏族自治州玛曲县海拔3 700 m 以上的尼玛镇尕玛梁村多刺绿绒蒿野生群体(E102°9′39.396″;N34°4′4.194″),供试种子均成熟饱满。生物测定所用小麦种子为小麦139 号,白菜种子为四季小白菜(购自甘肃景泰种子有限公司)。
1.2 方法
1.2.1 种子吸水率测定 取自然风干的多刺绿绒蒿种子1 000 粒,在25℃的水浴锅中浸种,每隔2 h 取出种子,快速用滤纸将其表面的水分吸干后称取重量,直至种子重量不再变化,重复3 次,然后计算种子吸水率。
1.2.2 不同溶剂浸提液制备及活性测定 参照常晖[19]等的方法,称取5 g 多刺绿绒蒿种子3 份粉粹,分别放入3 只100 mL 的锥形瓶中,依次加入10 倍量的蒸馏水、80%乙醇,在4℃条件下密封储存浸提24 h,4 000 r/min 离心10 min 后过滤,将残渣继续浸提2 次,合并3 次浸提液,56℃条件下浓缩至50 mL(醇提液再定容),得到浓度为0.1 g/mL 的浸提液。在直径为20 cm 的培养皿内放2 层滤纸,分别加入不同浸提溶剂制备的溶液15 mL(蒸馏水作对照),小麦和白菜种子每皿100粒,每处理重复3 次,25℃条件下黑暗培养,每24 h统计萌发率,每48 h 测(主)根长、根数(小麦)和胚芽鞘长(小麦)并记录,同时对数据进行差异显著性分析。
1.2.3 不同浓度浸提液制备及活性测定 按照1.2.1 的方法分别称取一定量研磨碎种子粉末,并制 成 浓 度 为0.04 g/mL、0.08 g/mL、0.12 g/mL、0.16 g/mL 和0.20 g/mL 的浸提液,然后按1.2.1的方法进行生物活力测定。
1.2.4 不同浸提天数浸提液制备及活性 称取粉碎的多刺绿绒蒿种子粉末5 g 后,放入3 只100 mL 的锥形瓶中,分别加入10 倍量的蒸馏水,在4℃条件下密封储存浸提24 h,4 000 r/min 离心10 min,过滤,此上清液记为1D,在残渣中加入等体积蒸馏水,同样操作,再浸提4 d,分别记为2D、3D、4D、5D。浸提液按照1.2.1 中的方法用小麦种子进行生物测定。
1.2.5 水提物对自身种子萌发的影响 根据李兵兵等[3]的方法,将多刺绿绒蒿种子用2%次氯酸钠溶液消毒5 min 后置于双层滤纸的培养皿中,每培养皿50 粒(随机选取),每处理3 个重复,15℃恒温黑暗培养,设置水提物浓度为0.04 g/mL、0.08 g/mL、0.12 g/mL、0.16 g/mL 和0.20 g/mL,向培养皿中加入,不同浓度5 mL 的水提物溶液,称重法保持培养皿湿润,直至种子萌发试验结束,统计种子萌发率并测量根长。
1.2.6 破除多刺绿绒蒿种子体眠的方法 将多刺绿绒蒿种子分别用蒸馏水、0.5 mmol/L SA、800 mg/L KH2PO4、150 mg/L PEG、600 mg/L GA、100 mg/L IAA 在室温条件下浸泡24 h。处理完成后迅速将处理好的种子倒入尼龙网漏斗上,用蒸馏水漂洗3 次后浸入2%的次氯酸钠溶液中灭菌15 min,将灭菌后种子用蒸馏水再漂洗3 次,然后放在铺有2 层滤纸的直径9 cm 的培养皿中,加蒸馏水,每培养皿随机选取100 粒种子,每处理3 次重复,15℃黑暗培养,观察种子萌发情况,并统计发芽率和根长。
2 结果
2.1 种子透性 多刺绿绒蒿种子吸水过程呈现3 个阶段(图1),即急剧吸水期、缓慢吸水期和饱和吸水期。浸种后4 h 内为急剧吸水期,吸水率由0.00%上升到60.75%,浸种4~14 h 后为缓慢吸水期,吸水率从52.30%上升到97.60%,18 h 后达到最大吸水率97.80%,之后吸水率有所下降并逐渐趋于稳定,浸种20 h 后吸水达到饱和,并趋于动态平衡。证明该种子吸水符合一般吸水规律,说明种皮对种子的萌发不造成透性障碍。

2.2 不同溶剂浸提液对小麦种子萌发及幼苗生长的影响 从表1可以看出: 用蒸馏水、80%乙醇制备的多刺绿绒蒿种子的浸提液对小麦种子萌发、根及胚芽鞘生长均有极显著抑制作用(P<0.01),但二者之间也存在明显差异。其中醇提液对小麦萌发率、 胚芽鞘长及根长抑制作用分别为30.91%、34.50%、33.72%,水提液对小麦种子萌发、胚芽鞘长及根长抑制作用分别是65.95% 、68.37% 、66.64%。说明多刺绿绒蒿种子中含有抑制小麦种子萌发的内源性抑制物质;并且水提液对小麦胚芽鞘的生长抑制作用较显著(P<0.01),醇提液对小麦根的生长抑制作用显著(P<0.05),水提液抑制程度较醇提液抑制作用极显著(P<0.01);醇提液和水提液都对小麦种子萌发率抑制作用最小。
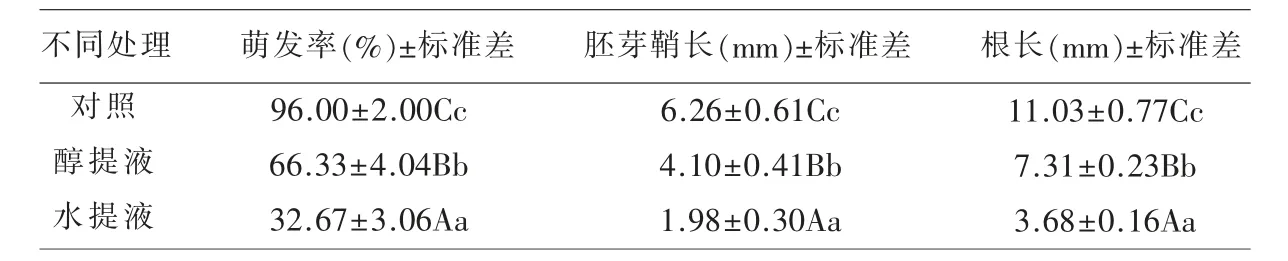
表1 多刺绿绒蒿种子不同溶剂浸提液对小麦种子萌发和幼苗生长的影响
2.3 不同溶剂浸提液对小麦根条数的影响 多刺绿绒蒿种子水提液对小麦根条数有显著影响(表2),较醇溶液和CK 组存在极显著差异(P<0.01),且醇提液较CK 组也存在极显著差异(P<0.01)。水提液处理后0 条根的比例最高为63.67%,小麦3 条根以上的比例最低为7.00%,较CK 组都达到极显著水平(P<0.01);相比醇提液,水提影响液对小麦一条根以下和3 条以上的根条数的比例影响极显著(P<0.01),说明水提液对小麦幼苗的建成影响作用比较明显。
2.4 不同溶剂浸提液对白菜种子萌发及幼苗生长的影响 用蒸馏水和80%乙醇制备的多刺绿绒蒿种子浸提液对白菜种子的萌发和幼苗生长呈显著抑制作用(P<0.05)(表3),水提液对白菜种子萌发率、根生长抑制作用分别是67.34%、88.73%。醇提液对白菜萌发率、 根长抑制作用分别为41.30%、70.35%。醇提液和水提液较对照组对白菜萌发率和幼苗根长的抑制作用达极显著水平(P<0.01),在白菜种子萌发和幼苗生长方面,水提液比醇提液影响显著(P<0.05),说明多刺绿绒蒿种子浸提液对白菜种子萌发和幼苗的生长具有明显抑制作用。

表3 多刺绿绒蒿种子不同溶剂浸提液对白菜种子萌发和幼苗生长的影响
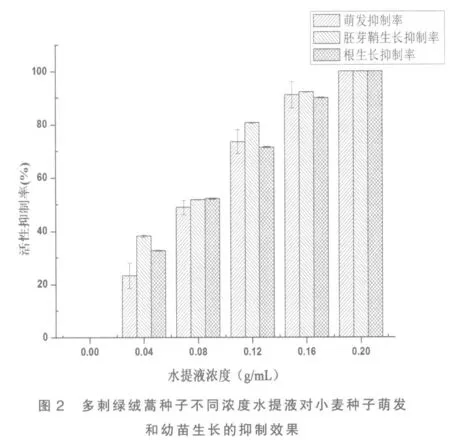
2.5 不同浓度浸提液对小麦种子萌发及生长的影响 多刺绿绒蒿种子水提液对小麦种子的萌发率及胚芽鞘和根的生长均有明显的抑制作用(P<0.05),且随着其浓度增大,抑制作用显著增强(图2)。各浓度水提物处理后,小麦种子萌发率、胚芽鞘和根生长均呈极显著差异(P<0.01);当浸提液浓度达到0.16 g/mL 时,对小麦种子萌发率、胚芽鞘和根的长度抑制率分别达到91.15%、92.17%和90.03%,说明水提物对小麦种子胚芽鞘活性抑制最高,对根的生长活性抑制程度最低。当水提物浓度为0.20 g/mL 时,小麦种子萌发率、胚芽鞘和根的生长被完全抑制, 进一步说明多刺绿绒蒿种子中存在内源抑制物,对小麦种子萌发及幼苗生长有明显抑制作用。
2.6 多刺绿绒蒿种子不同浓度水提液对小麦根数的影响 表4结果显示: 不同浓度水提液对小麦根条数较对照组均有显著影响(P<0.05),随着水提液浓度的增加,小麦根条数呈现有规律地变化。低于0.08 g/mL 时,对小麦根条数影响较小,多数种子能发出正常的3 条及3 条以上的根;随着水提液浓度的增加,小麦种子根条数明显减少,当水提液浓度达到0.16 g/mL 时,小麦种子鲜有发3 条及以上根条数,且大多数小麦种子不发根,给小麦幼苗的生长形成极大障碍;当水提液浓度达0.20 g/mL 时,小麦种子不发根,活性被完全抑制。说明多刺绿绒蒿种子中含有一定浓度的内源性抑制物质,影响小麦幼苗的建成。
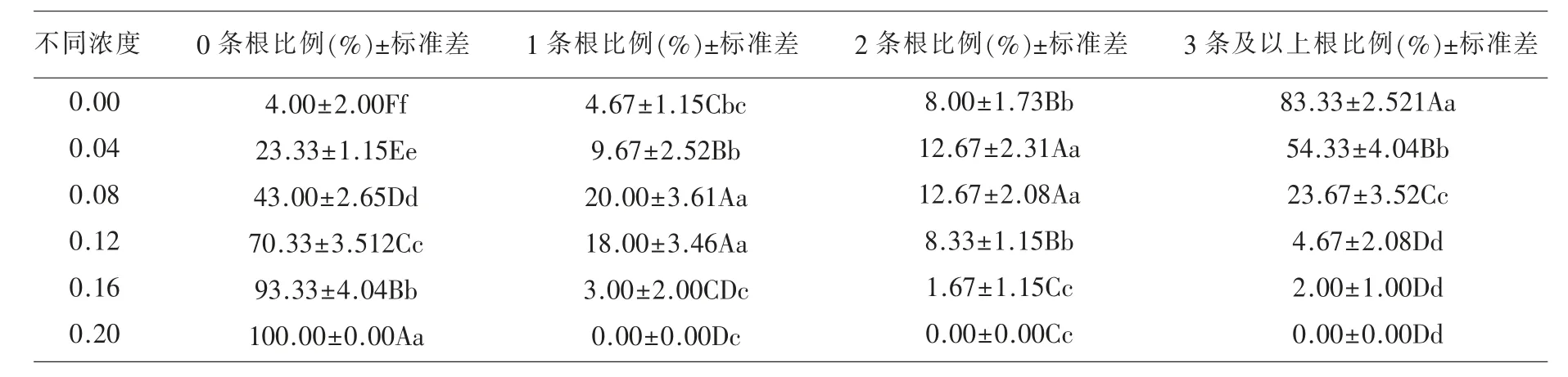
表4 多刺绿绒蒿种子不同浓度水提液对小麦根数的影响
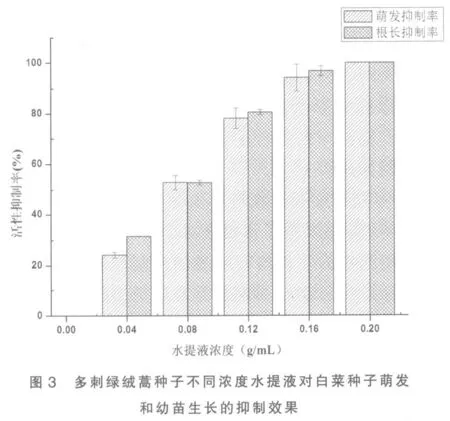
2.7 不同浓度水提液对白菜种子萌发及生长的影响 多刺绿绒蒿种子不同浓度水提液对白菜种子萌发和根的生长呈极显著抑制作用(P<0.01),且抑制作用随水提液浓度的增大而增强(图3)。当水提液浓度从0.00 mg/L(CK 组)增加到0.16 g/mL时,对白菜种子萌发率和根长活性抑制分别达到94.95%和96.82%,与对照组形成极显著差别(P<0.01);当水提液浓度达到0.20 g/mL 时,白菜种子的萌发率和根长均为零,即白菜种子的活力被完全抑制,说明多刺绿绒蒿种子内含有对白菜种子萌发抑制的物质存在。
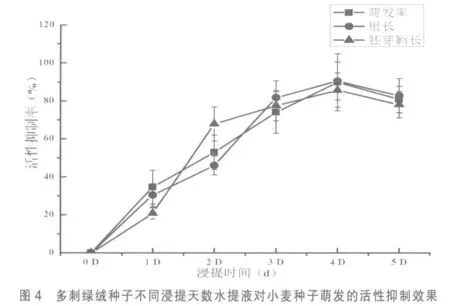
2.8 不同浸提天数水提液对小麦种子萌发及幼苗生长的影响 从图4可以看出,随着对多刺绿绒蒿种子浸提天数的增加,小麦种子萌发、根和胚芽鞘生长的抑制作用呈先升后降的趋势,第1~4天水提液抑制作用逐渐上升,第4 天浸提液的抑制作用达到最高,对小麦萌发率、根和胚芽鞘的活性抑制率分别达到89.31%、90.94%和84.01%。至第5 天浸提液对小麦萌发率、根长、胚芽鞘长的抑制作用分别降为81.57%、85.31%和75.59%,即第5 天浸提之后,对小麦种子活性抑制作用反而出现降低趋势,但降低趋势不明显。在浸提第3 天之后,水提液对根的活性抑制率比小麦的萌发率和胚芽鞘生长都要高,抑制水平极显著(P<0.01)。
2.9 多刺绿绒蒿种子水提物对自身种子萌发的影响 多刺绿绒蒿种子水提液对自身种子的萌发和幼苗有着明显的抑制作用(表5),随着水提物浓度的增大,对种子萌发各项指标较对照组的抑制作用均呈现显著增大趋势(P<0.05)。当浓度达到0.08 g/mL 时,发芽率和活力较对照的百分率极显著降低(P<0.01),萌发时滞也明显延长。当浓度为0.20 g/mL 时其发芽率与根长为较对照组明显降低,种子活力指数只有0.02,即种子活力几乎丧失。更进一步说明多刺绿绒蒿种子存在内源抑制物,影响自身种子有效萌发。

表5 多刺绿绒蒿种子水提物对多刺绿绒蒿种子萌发的影响
2.10 打破多刺绿绒蒿种子休眠 由表4可知,600 mg/L GA 处理多刺绿绒蒿种子萌发势较流水浸种和对照极显著提高27.37%和105.26%,较800 mg/L IAA、500 mg/L PEG、0.5 mmol/L SA 和800 mg/L KH2PO4显 著 提 高12.49% ,16.59% ,6.4%和9.3%;平均发芽时间较流水浸种、500 mg/L PEG、800 mg/L KH2PO4和对照极显著缩短40.56%、35.91%、20.95%和47.27 %,较800 mg/L IAA 和0.5 mmol/L SA 显著缩短8.99%、10.42%;萌发率较流水浸种、500 mg/L PEG、0.5 mmol/L SA、800 mg/L KH2PO4和对照组极显著提高37.17%、20.00%、12.90%、15.38%和128.24%,较800 mg/L IAA 显著提高6.1%。因此,600 mg/L GA 处理多刺绿绒蒿种子,其发芽质量最佳。说明GA 可以有效的抑制其种子中内源性抑制物质的释放或者促进细胞分裂,从而迅速发芽。
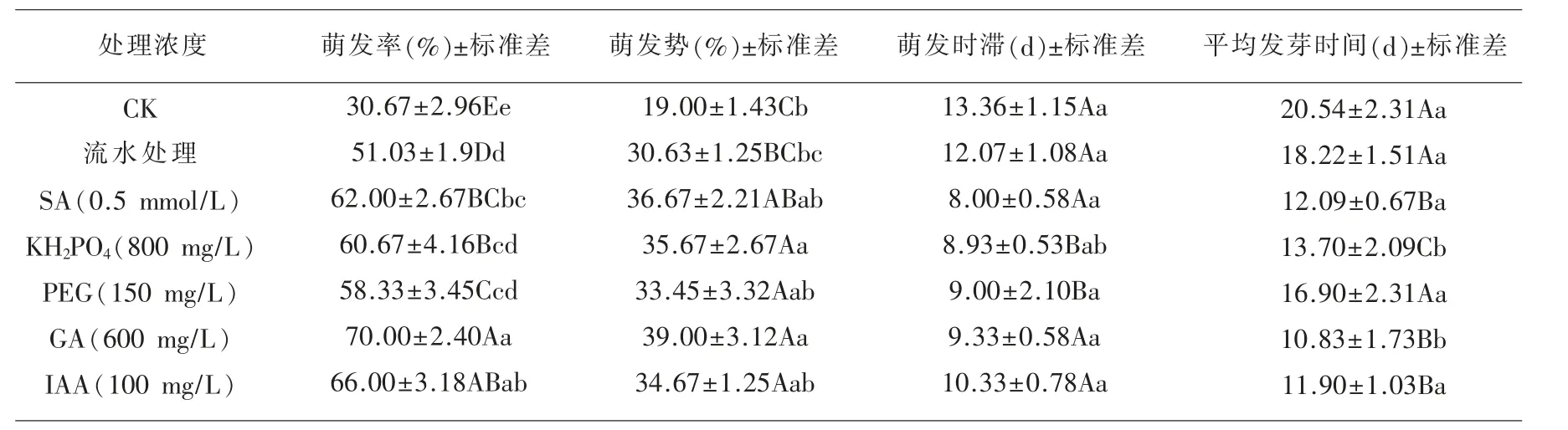
表6 不同处理对多刺绿绒蒿种子的发芽特性
3 结论与讨论
种子休眠的诸多因素中,内源抑制物质的存在已经被公认为是最重要的原因之一[20-21],植物种子的内源萌发抑制物是植物生态适应性的一种表现[22-23]。种子所含抑制物质可推迟种子在不适宜条件下发芽的时间,促使幼苗在温度、湿度等适宜条件下生长,但给人工驯化带来了一定的困难[24]。实验结果表明,多刺绿绒蒿种子浸种4 h 后吸水速率最大,为60.75%,20 h 后吸水饱和,达到97.8%,其吸水过程所表现的3 个阶段,符合种子的吸水规律,说明多刺绿绒蒿种皮对种子吸水无阻碍作用。多刺绿绒蒿种子的醇提液和水提液对小麦和白菜,以及自身种子的萌发都造成阻碍作用,且水提液对白菜和小麦种子的抑制作用明显强于醇提液,较对照组呈极显著差异(P<0.01),说明多刺绿绒蒿种子内含萌发抑制物质,且种子抑制萌发物质主要是水溶性成分,使得种子萌发具有一定生理障碍,这与赵敏等[23]报道膜荚黄芪温水浸种的结果相似;但经流水、600 mg/L GA、100 mg/L IAA、150 mg/L PEG、800 g/mL GA 和0.5 mmol/L SA 处理的多刺绿绒蒿种子萌发率和萌发势均极显著高于对照组,提高了多刺绿绒蒿种子的发芽率,更加证明多刺绿绒蒿种子具有生理休眠的特性,其中800 g/mL GA 浸种后的多刺绿绒蒿种子较其他处理组更加显著,说明这可能与GA 解除休眠有关。随着多刺绿绒蒿种子水提液浓度升高,小麦和白菜种子的萌发、幼根和胚芽鞘(小麦)的生长都起到不同程度的抑制作用,使小麦和白菜种子萌发小麦和白菜种子个数呈现不同程度的减少,当水提液浓度达到0.20 g/mL 时,完全丧失活力,这与Debeaujou 等[24]指出的胚的生理体眠主要是因为是抑制剂浓度过高所致相吻合。如果选择人工种植多刺绿绒蒿,可以在种植之前,对其用水浸泡,可减少水溶性抑制萌发物质的含量,从而可以提高其萌发率。
此外,通过不同浸提天数对小麦和白菜萌发的影响试验,发现对多刺绿绒蒿种子浸提第5 d时,对小麦和白菜的活性抑制作用降低,这可能是因为浸提时间的延长使一些水溶性萌发物质在浸提过程中出现水解、氧化、降解等[25],但是降低程度不显著,可能种子内部在继续释放抑制物质[24]。由此说明,多刺绿绒蒿种子所含水溶性的抑制萌发物质可能是导致其具有一定的生理休眠,从而使野外生长量低下的原因之一。但此研究还不够深入,抑制物质的化学成分和存在部位、抑制作用的机理及种皮的显微结构尚不清楚,还有待进一步研究。另外,如何快速解除多刺绿绒蒿种子休眠,提高萌发率及解除种子休眠和各内源激素的变化间的联系将是今后研究的主要方向,为其人工驯化提供理论支撑。

