我国鸡源沙门氏菌的血清型分布和对黏菌素耐药性的研究
张纯萍,宋立,崔明全,赵琪,徐士新
(中国兽医药品监察所,北京 100081)
沙门氏菌是一重要的人畜共患病原菌,不仅能够引起畜禽的各种疾病,也是最重要的食源性病原菌之一,每年因畜禽产品污染沙门氏菌引起的感染都位居食源性病原菌感染的前列[1]。沙门氏菌血清型众多,目前已经鉴定出2500多种血清型,不同国家、不同地区鸡群中的优势血清型不同,不同血清型的沙门氏菌对鸡和人的致病性也不相同。全球食源性监测网的检测结果表明,引起公共卫生安全的沙门氏菌以肠炎和鼠伤寒两种血清型为主[2]。
黏菌素是一种环状多肽类抗生素,对革兰氏阴性菌具有强大的抗菌作用,并且具有口服吸收少、残留低等特点,在兽医临床上主要作为饲料添加剂用于食品动物疾病的预防。而在人医临床上,随着多重耐药革兰氏阴性菌(又称“超级细菌”)的不断出现和蔓延散布,多肽类抗生素已成为治疗多重耐药革兰氏阴性菌感染的“最后一线希望”,而且很可能成为未来几年治疗多重耐药菌感染的最佳选择[3]。
由于黏菌素在临床治疗中的重要地位,尤其是在我国研究人员[4]发现mcr-1 (Mobile Colistin Resistance) 基因可通过水平传播介导细菌对黏菌素产生耐药性后,对其耐药性和耐药机制的研究就已经成为人们关注的焦点。作为一种重要的食源性病原菌,鸡源沙门氏菌的血清型分布、对黏菌素的耐药性以及mcr-1基因的携带状况可为兽医临床黏菌素的使用风险评估和公共卫生安全提供一定的参考。鉴于此,我们对从全国不同地区分离的鸡源沙门氏菌进行了血清分型和对黏菌素的耐药性分析,并进行了mcr-1基因的携带情况调查。
1 材料与方法
1.1 材料
1.1.1 沙门氏菌 2014-2016年分离自全国12个省份的成鸡盲肠或泄殖腔拭子[5],总共450株,其中湖南135株,辽宁109株,陕西56株,云南40株,四川33株,山东23株,广西20株,河北20株,山西6株,广东5株,湖北2株,江西1株。所有分离菌株均用PCR方法[6]进行了鉴定。
1.1.2 质控菌株和分型血清 大肠杆菌ATCC 25922和ATCC 35218购自中国食品药品检定研究院;大肠杆菌SD-9(携带mcr-1基因)由中国兽医药品监察所安全评价研究室分离并保存;沙门氏菌分型血清购自丹麦血清研究所。
1.2 方法
1.2.1 沙门氏菌的血清学分型 根据国标中沙门氏菌的血清学检验方法[7],用丹麦血清分别进行菌体(O)抗原和鞭毛(H)抗原的检测,然后参照沙门氏菌属抗原表[8]判定血清型。
1.2.2 沙门氏菌对黏菌素的耐药性测定 根据美国临床实验室标准化委员会的标准[9],用微量肉汤稀释法测定450株沙门氏菌对黏菌素的MIC值。沙门氏菌对黏菌素的耐药和敏感折点分别为MIC≥4 μg/mL和MIC≤2 μg/mL[10],测定浓度范围为0.12~16 μg/mL,质控菌株为大肠杆菌ATCC 25922和ATCC 35218。
1.2.3 mcr-1基因的克隆测序 为了了解沙门氏菌中mcr-1基因的携带情况,本研究对所有菌株进行了mcr-1基因的克隆。扩增片段大小为309 bp,引物序列[6]为: CGGTCAGTCCGTTTGTTC(F)和 CTTGGTCGGTCTGTAGGG(R)。用煮沸法提取细菌DNA后以25 μL反应体系进行PCR反应,反应条件为:95 ℃预变性3 min;95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,30个循环;最后72 ℃延伸10 min。取7 μL PCR产物在1.2%的琼脂糖凝胶中电泳,电泳条件为:电压110 V,电泳时间30 min。电泳结束后用凝胶成像仪成像分析。阳性条带进行测序(北京三博远志生物技术有限公司)验证。
阴性和阳性质控菌株分别为大肠杆菌ATCC 25922和SD-9。
2 结 果
2.1 沙门氏菌的血清型 本研究共从全国不同地区成鸡的盲肠或泄殖腔拭子中分离出450株沙门氏菌,其中73株为II型或不能定型菌株,其余377株为可分型沙门氏菌,分别属于11种不同的血清型(表1)。由表1可知,肠炎沙门氏菌是最常见的血清型,35.3%的菌株为肠炎沙门氏菌,其次是鸡白痢,占比23.8%,鼠伤寒和杜伊斯堡分列第3、4位,上述四种血清型的菌株数量占沙门氏菌分离株的76.2%。

表1 鸡源沙门氏菌的血清型分布Tab 1 Serotype distribution of Salmonella from chicken
2.2 沙门氏菌对黏菌素耐药性 鸡源沙门氏菌(包括前4种血清型)对黏菌素的MIC分布和耐药性结果详见表2。在450株沙门氏菌中,44.9%的菌株(202株)对黏菌素耐药(MIC≥4 μg/mL)。由于部分血清型的菌株数量过少(不足20株),因此未对其进行MIC分布的统计分析,仅分别统计了前4种血清型的MIC分布和耐药率。
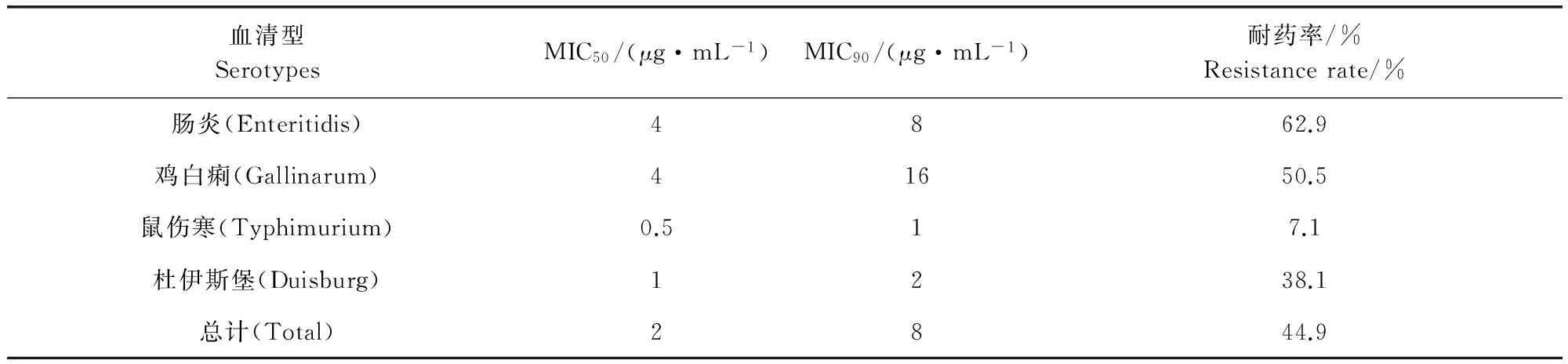
表2 沙门氏菌对黏菌素的MIC分布和耐药率Tab 2 MIC distribution and resistance rate of Salmonella to colistin
由表2可知,不同血清型的沙门氏菌对黏菌素的耐药性存在明显差异。肠炎沙门氏菌对黏菌素的耐药率最高(62.9%),其次是鸡白痢(50.5%),这两种血清型沙门氏菌对黏菌素的MIC50均为4 μg/mL。鼠伤寒沙门氏菌对黏菌素最敏感(仅有7.1%的菌株对黏菌素耐药),其MIC50仅为0.5 μg/mL。四种血清型沙门氏菌的MIC90差异明显,其中鸡白痢沙门氏菌的最高,为16 μg/mL,而鼠伤寒沙门氏菌的MIC90仅为1 μg/mL。
2.3 mcr-1基因的携带情况 所有沙门氏菌的PCR检测结果均未出现阳性目的条带,即所检测的450株沙门氏菌中均未检测出mcr-1基因,说明鸡源沙门氏菌中mcr-1基因的携带并不普遍。
3 讨论与小结
3.1 鸡源沙门氏菌的血清型分布 研究中鸡源沙门氏菌的优势血清型为肠炎、鸡白痢和鼠伤寒,70%以上的菌株属于这三种血清型。研究资料表明,不同地区、不同样品来源的沙门氏菌血清型分布存在差异。其中,北京地区健康肉鸡沙门氏菌的主要血清型为肠炎和爪哇安那[11];河北省养殖鸡的主要血清型为鸡白痢、鼠伤寒和肠炎[12];而上海活禽和零售禽肉制品中以肠炎、印第安那和鼠伤寒为主[13];从广西、江苏临床病鸡中分离的沙门氏菌则主要是鸡白痢[14-15];在陕西杨凌地区鸡肉中分离的沙门氏菌则以鼠伤寒和汤普森为主[16]。综上所述,由于研究的沙门氏菌来自我国12个省份,因此其血清分型结果基本代表了我国鸡源沙门氏菌的血清型分布情况。
与其他国家的研究结果相比,沙门氏菌的血清型分布也具有明显的地域性特点。在北美地区,美国禽源沙门氏菌的优势血清型以肯塔基、肠炎和鼠伤寒为主[17];而加拿大以肠炎、肯塔基和海德堡为主[18]。在欧洲,丹麦分离的禽源沙门氏菌主要为肠炎和鼠伤寒[19];荷兰以肠炎、婴儿、鼠伤寒为主[20];冰岛则以婴儿和鼠伤寒为主[21]。在非洲,鸡源沙门氏菌主要的血清型则为德比和彻斯特[22]。
总体来看,大多数国家和地区沙门氏菌的优势血清型以肠炎和鼠伤寒为主,与世卫组织公布的两种最主要的食源性致病血清型[2]一致。但是,在其他血清型的分布上具有明显差异,因此必须持续监测本地区沙门氏菌的血清型分布情况,以及时了解沙门氏菌的血清型变化,并据此制定合理的防控策略。
3.2 鸡源沙门氏菌对黏菌素耐药性 随着多粘菌素类药物在临床治疗中的重要性日益增加,其耐药性业已成为人们关注的焦点问题。
研究结果表明,沙门氏菌对黏菌素的耐药性与其血清型密切相关。本研究中一半以上的肠炎和鸡白痢沙门氏菌对黏菌素耐药,而仅有7.1%的鼠伤寒沙门氏菌对黏菌素耐药,其他研究也得出了同样的结果[23]。此外,不同地区沙门氏菌的耐药性不同,在欧洲,42.9% 的鸡源沙门氏菌对黏菌素耐药,其中西班牙分离株的耐药性高达76.9%[24];而在本研究中,44.9% 的沙门氏菌分离株对黏菌素耐药,这种地域性的耐药性差异与沙门氏菌的血清型分布不同有关。
3.3 鸡源沙门氏菌mcr-1基因的携带情况 mcr-1是2015年新发现的黏菌素耐药基因,该基因可经由质粒介导而发生水平传播,不同于以往普遍认为的染色体突变的耐药机制,因此引起了全球的广泛关注。研究对鸡源沙门氏菌的mcr-1基因携带情况进行了调查,结果表明,所有沙门氏菌分离株,包括耐药菌株和敏感菌株,均未携带mcr-1基因,表明该基因尚未在鸡源沙门氏菌中散布,也不是导致沙门氏菌对黏菌素耐药性的主要机制。
大量研究结果[25]表明,大肠杆菌是mcr-1基因的主要携带菌,其他细菌中mcr-1的携带率非常低。但是,由于mcr-1可通过接合性质粒转移到其他细菌,作为重要的食源性病原菌,如果沙门氏菌携带了可以水平转移的耐药基因元件mcr-1,就会对公共卫生安全带来极大的威胁;此外,近期研究又发现了mcr-2和mcr-3等新的mcr基因[26-27],这样看来,虽然研究中的鸡源沙门氏菌未携带mcr-1基因,但是并不能排除mcr基因在沙门氏菌发生水平传播的可能性,因此必须持续监测mcr基因在沙门氏菌中的流行性,以防控mcr基因在沙门氏菌中的散布和传播。
总之,研究对从我国12个省份分离的450株沙门氏菌进行了血清分型、对黏菌素的耐药性和mcr-1基因的携带情况调查。结果表明,鸡源沙门氏菌的优势血清型以肠炎、鸡白痢和鼠伤寒为主;其对黏菌素的耐药性与血清型分布有关,肠炎沙门氏菌对黏菌素的耐药性最强,其次为鸡白痢,鼠伤寒沙门氏菌对黏菌素最敏感;未检测出mcr-1基因阳性的沙门氏菌。研究的结果可为我国鸡源沙门氏菌感染的防控以及兽医临床黏菌素的使用风险评估提供参考。
虽然我国农业部门已经禁止在饲料中添加黏菌素[28],但是,鉴于人医临床多粘菌素用药的增加以及兽医饲料中曾经的广泛长期添加用药,务必持续监测动物源细菌对黏菌素的耐药性变化趋势,以及mcr基因在农业和公共卫生领域的散布情况,以防控黏菌素耐药菌株的快速散播。
[1] Silva C, Calva E, Maloy S. One Health and food-borne disease:Salmonellatransmission between humans, animals, and plants[J]. Microbiol Spectrum, 2014, 2(1):1-9.
[2] WHO Global Salm-Surv: Progress Report 2000-2005. WHO Press, World Health Organization , 20 avenue appia, 1211 geneva 27[J]. switzerland, 2006 ,24-25.
[3] Biswas S, Brunel J M, Dubus J C,etal. Colistin: an update on the antibiotic of the 21st century [J]. Expert Rev Anti Infect Ther. 2012, 10(8):917-34.
[4] Liu Y Y, Wang Y, Walsh T R,etal. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study [J]. Lancet Infect Dis, 2016, 16(2): 161-168.
[5] 陈惠娟,张纯萍,李金贵,等. 不同增菌液和培养基对沙门氏菌分离效果的比较研究[J]. 中国家禽,2011, 33(24): 20-23.
Chen H J, Zhang C P, LI J G,etal. Effect of Different Enrichment Broth and Culture Medium on Isolation Effects ofSalmonella[J]. China Poultry, 2011, 33(24): 20-23.
[6] Rahn K, De Grandis S A, Clarke R C,etal. Amplication of an invA gene sequence osSalmonellatyphimurium by polymerase chain reaction as a specific method of detection os Salmonella [J]. Molecular and Cellular Probes, 1992, 6(4):271-279.
[7] 中华人民共和国卫生部, GB4789.4-2010,食品安全国家标准,食品微生物学检验沙门氏菌检验[S].
The Ministry of Health of the People's Republic of China, GB4789.4-2010,National Food Safety Standard, Food Microbiological Examination:Salmonella[S].
[8] WHO Collaborating center for reference and research onSalmonella. Antigenic formulae of theSalmonellaserovars [M]. 9th edition, 2007.
[9] Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Disk and Dilution Susceptibility Tests for Bacteria Isolated from Animals; Approved Standard[S].
[10]Breakpoint tables for interpretation of MICs and zone diameters (version 7.0). European Committee on Antimicrobial Susceptibility Testing[Z]. valid from 2017-07-01. http: //www.eucast.org/clinical_breakpoints/.
[11]张纯萍,宁宜宝,宋立,等. 北京地区健康肉鸡携带沙门氏菌状况调查[J].中国兽药杂志, 2012, 46(10): 9-12.
Zhang C P, Ning Y B, Song L,etal. Investigation on prevalence of carriedSalmonellain healthy broiler in Beijing[J]. Chinese J of Veterinary Drug, 2012, 46(10): 9-12.
[12]刘新静. 河北省鸡沙门氏菌的分离鉴定及耐药性分析[D]. 山东农业大学,2015.
Liu X J. Isolation, identification and drug resistance of Salmonella spp. isolated from chicken in Hebei province. Shandong Agricultural University, 2015.
[13]沈海燕,郭慧霞,许学斌,等. 上海市零售禽肉制品和活禽中沙门氏菌血清型与耐药性研究[J]. 中国畜牧兽医, 2014, 41(11):263-266.
Shen H Y, Guo H X, Xu X B,etal. Serotype and drug resistance ofSalmonellafrom Retail poultry meat and poultry in Shanghai[J]. China Animal Husbandry & Veterinary Medicine, 2014, 41(11):263-266.
[14]侯雪娇,吴科敏,焦鹏涛,等. 广西地区鸡源沙门氏菌的分离鉴定及耐药状况研究[J]. 广西畜牧兽医, 2015, 31(05):227-230.
Hou X J, Wu K M, Jiao P T,etal. Isolation, identification and drug resistance ofSalmonellaenterica isolated from chicken in Guangxi[J]. Guangxi Journal of Animal Husbandry & Veterinary Medicine, 2015, 31(05):227-230.
[15]付玉勤. 禽沙门氏菌的分离鉴定、生物被膜测定及耐药性分析[D]. 扬州大学, 2016.
Fu Y Q. Isolation and identification, biofilm detection and drug resistance analysis ofSalmonellaisolates from poultry[D]. Yangzhou University, 2016.
[16]王嘉炜,肖英平,杨华,等. 鸡肉源沙门氏菌血清型、药敏性及部分耐药基因研究[J]. 食品科学, 2017, 38(15):140-146.
Wang J W, Xiao Y P, Yang H,etal. Study on serotype, antibiotic susceptibility and some genes associated with quinolones and fluoroquinolines resistance of chicken-borne Salmonella[J]. Food Science, 2017, 38(15):140-146.
[17]The National Antimicrobial Resistance Monitoring System: Enteric Bacteria [R]. NARMS Integrated Report, 2014.
https://www.fda.gov/AnimalVeterinary/SafetyHealth/AntimicrobialResistance/NationalAntimicrobialResistanceMonitoringSystem/ucm059103.htm.
[18]Public Health Agency of Canada. Canadian Antimicrobial Resistance Surveillance System -Report 2008-2009 [R].
http://www.phac-aspc.gc.ca/cipars-picra/pubs-eng.php.
[19]DANMAP 2006 - Use of antimicrobial agents and occurrence of antimicrobial resistance in bacteria from food animals, foods and humans in Denmark[R].
http://www.danmap.org/Downloads/Reports.aspx.
[20]van Duijkeren E , Wannet W J , Houwers D J,etal. Serotype and Phage Type Distribution ofSalmonellaStrains Isolated from Humans, Cattle, Pigs, and Chickens in The Netherlands from 1984 to 2001[J]. Journal of Clinical Microbiology, 2002, 40(11): 3980-3985.
[21]Thorsteinsdottir T R, Kristinsson K G, and Gunnarsson E. Antimicrobial resistance and serotype distribution amongSalmonellaspp. in pigs and poultry in Iceland, 2001-2005 [J]. Microb Drug Resis, 2007, 13(4):295-300.
[22]Kagambèga A, Lienemann T, Aulu L,etal. Prevalence and characterization ofSalmonellaenterica from the feces of cattle, poultry, swine and hedgehogs in Burkina Faso and their comparison to humanSalmonellaisolates[J]. BMC Microbiology, 2013, 13(253):1-9.
[23]Jarquin C, Alvarez D, Morales O,etal.Salmonellaon Raw Poultry in Retail Markets in Guatemala: Levels, Antibiotic Susceptibility, and Serovar Distribution[J]. J Food Prot, 2015, 78(9):1642-50.
[24]de Jong A, Bywater R, Butty P,etal. Pan-European monitoring of susceptibility to human-use antimicrobial agents in enteric bacteria isolated from healthy food-producing animals[J]. J. Antimicrob Chemother, 2012; 67(3): 638-651.
[25]易灵娴,刘艺云,吴仁杰,等. 质粒介导的黏菌素耐药基因mcr-1研究进展[J]. 遗传, 2017, 39(2): 110―126.
Yi L X, Liu Y Y, WU R J,etal. Research progress on the plasmid-mediated colistin resistance gene mcr-1[J]. Hereditas, 2017, 39(2): 110-126.
[26]Xavier B B, Lammens C, Ruhal R,etal. Identification of a novel plasmid-mediated colistin-resistance gene, mcr-2, inEscherichiacoli, Belgium, June 2016[J]. Euro Surveill. 2016, 21(27):pii=30280.
http://dx.doi.org/10.2807/1560-7917.ES.2016.21.27.30280
[27]Yin W, Li H, Shen Y,etal. Novel plasmid-mediated colistin resistance gene mcr-3 inEscherichiacoli[J]. mBio, 2017, 8(3):e00543-17.
https://doi.org/10.1128/mBio.00543-17.
[28]中华人民共和国农业部公告,第2428号[EB/OL].
Announcement No.2428 of the Ministry of Agriculture, the People's Republic of China.http://www.moa.gov.cn/sjzz/syj/yzyj/201608/t20160801_5224428.htm.[EB/OL]

