甲状腺素对猪小肠上皮细胞miR-let-7a基因表达及细胞增殖的影响
高慧珍,陈理星,黄敏婕,徐宁迎
(浙江大学动物科学学院,浙江杭州310058)
甲状腺激素(Thyroid Hormone,TH)是哺乳动物生长发育最重要的激素之一,几乎作用于机体的每个细胞[1]。TH通过与机体全身各处的靶细胞核内受体(Thyroid Hormone Receptor,TR)结合,诱导靶基因的转录从而发挥广泛的生物学功能[2]。TR作为一种转录因子会调控非编码RNA。miR-let-7最早在线虫(Nematoda)中发现,是线虫发育的时间调控器[3],被认为是miRNA的代表,miR-let-7a是let-7家族非常重要的成员。随着研究的不断深入,let-7a在动物的生长发育、细胞的分化[4]、增殖[5]与凋亡等方面发挥越来越重要的作用。很多研究数据显示,miR-let-7a基因在一些癌变组织中下调并且这种下调会诱导细胞发生癌变[6-7],miR-let-7a基因的表达在前列腺癌组织和细胞系中显著下调,其能够通过诱导细胞周期停滞在G0~G1期从而抑制前列腺癌细胞的增长[8]。目前,关于甲状腺素(T4)等外源激素处理对miR-let-7a基因在细胞中表达影响的研究尚未见报道。本实验以猪的肠道上皮细胞为模型添加不同浓度的T4后,以 real-time PCR为研究手段,检测miR-let-7a基因的表达变化,利用CCK-8法测定处理过的细胞增殖率变化,为进一步研究生理过程中miR-let-7a基因的表达变化奠定基础,并初步探讨了let-7a在T4影响下对肠道上皮细胞增殖的调控。
1 材料与方法
1.1 实验细胞 IPEC-J2(猪小肠上皮细胞)由浙江大学动物科学学院动物饲料所实验室赠予。
1.2 主要试剂与仪器 T4(英国abcam),D-MEM/F-12细胞培养液(美国GIBCO),恒温离心机,显微镜(Nikon,日本),NanoDrop2000c核酸分析仪,荧光定量 PCR 仪 Step oneplus PCR System(ABI),引物序列由上海Invitrogen公司合成,Trizol提取总RNA试剂,miRcute miRNA cDNA第1链合成试剂盒,miRcute Plus miRNA qPCR 检测试剂盒(TIANGEN,北京)。
1.3 细胞形态和增殖的检测 当细胞生长到70%左右,倒置显微镜下观察处理组和空白对照组的细胞形态变化。细胞接种至96孔板,每孔约100 mL细胞悬液,细胞贴壁后换成含有不同终浓度的T4培养液(0、0.02、0.03、0.05、0.075、0.1、0.2 μmol/L),每个浓度设置5个重复。作用48 h后,采用CCK-8法检测细胞增殖结果,以换液的形式每孔加入10 mL的CCK-8,37℃培养箱中培养4 h,用酶标仪测定细胞450 nm处的OD值。
1.4 细胞处理后提取RNA反转录 富集细胞后接种于12孔细胞培养板,待每孔细胞贴壁 80%~90%后,添加上述不同浓度的T4激素,于37℃培养24 h,每个实验处理设3个重复。按照Trizol试剂提细胞总RNA,用NanoDrop2000c核酸分析仪检测RNA浓度和纯度,OD260/280均在1.8~2.0,浓度和纯度都符合要求的RNA用miRcute miRNA cDNA第1链合成试剂盒反转录成cDNA。
1.5miR-let-7a基因荧光定量 本研究采用相对荧光定量qRT-PCR 法,内参引物为Met-tRNA。用反转录的cDNA按照miRcute Plus miRNA qPCR 试剂盒说明书利用通用引物和特定的miRNA引物在Step one plus PCR System(ABI)仪器上进行反应。反应体系:2×miRcute Plus miRNA Premix( 含 SYBR, 含 ROX)10 μL,上、下游引物(10 μmol/L)各 0.4 μL,miRNA第 1 链 cDNA 2 μL,50× ROX Reference Dye 2 μL,加ddH2O至20 μL。反应条件:95℃起始模板变性15 min;94℃ 20 s,60℃ 34 s,40个循环。引物序列见表1。

表1 引物序列及扩增参数
1.6 统计分析 采用2-ΔΔCt方法来计算基因相对表达量,实验数据用SPSS 20.0软件进行统计分析,采用单因素方差分析不同浓度T4作用下miR-let-7a的表达差异性,采用LSD进行多重比较。采用单因素方差分析细胞增殖率的差异性。P<0.05表示差异显著,P<0.01表示差异极显著。结果数据用平均值±标准误表示。
2 结果与分析
2.1 T4对猪肠道上皮细胞形态及增殖率的影响 由图1、2可知,处理组和空白对照组细胞的形态无差异。如图3所示,当T4浓度为0.03 μmol/L时细胞增殖率显著低于其他浓度组(P<0.05)。T4浓度从0增至0.03 μmol/L时,细胞增殖率逐渐减小,从0.03 μmol/L增至0.075 μmol/L时细胞增殖率逐渐增加,浓度大于0.075 μmol/L时,细胞增殖率基本保持不变。
图1 空白组细胞形态
图2 T4处理组细胞形态

图3 不同T4浓度下细胞增殖率
2.2 荧光定量结果 荧光定量扩增曲线和熔解曲线如图4~5所示,本实验中荧光定量PCR反应特异性和重复性良好,表达定量检测结果可靠。采用2-ΔΔCt方法来计算基因相对表达量,结果如图6所示。在添加0.03 μmol/L T4时,小肠上皮细胞miRlet-7a的表达丰度最高,极显著高于其他浓度(P<0.01)。T4浓度为0~0.03 μmol/L时,随着添加剂量的增加let-7a的表达升高;T4浓度从0.05~0.2 μmol/L变化时,let-7a的表达呈现降低的趋势。

图4 荧光定量PCR熔解曲线

图5 荧光定量PCR扩增曲线
3 讨 论
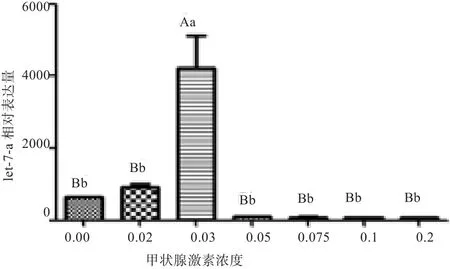
图6 miR-let-7a的相对表达量
苗治国[9]发现,在生长发育期间(35~125日龄)长白猪的平均日增重比金华猪高出39.44%,而其平均耗料增重比则比金华猪显著低24.11%,但平均日采食量在2个品种间无显著差异,同时也发现金华猪小肠黏膜绒毛高度在80日龄和120日龄时均极显著低于长白猪。小肠吸收主要通过肠道微绒毛实现,小肠绒毛的增高可以促进营养物质的消化吸收,绒毛的高度和肠细胞数量呈显著相关。由此可以推测,金华猪和长白猪对营养物质吸收的差异受肠道上皮细胞的增殖数目影响。之前的实验中已检测到miR-let-7a在小肠中的表达量显著高于其他组织[10],说明let-7a在肠道细胞中发挥着重要作用。大白猪出生后血液中TH水平随着日龄的增加而变化,TH表达水平的下降可能会直接或间接上调miR-let-7a的表达量[11]。本实验结果表明,T4浓度从0~0.03 μmol/L变化时,let-7a的表达量逐渐升高,浓度从0.03~0.2 μmol/L变化时,let-7a的表达呈现降低趋势,浓度为0.03 μmol/L时表达量极显著高于其他浓度组。同时检测不同浓度作用对细胞的形态、增殖产生的影响。利用CCK-8法检测细胞增殖,结果显示当T4添加浓度从0~0.03 μmol/L变化时,细胞增殖率随浓度增加而降低,从0.03 μmol/L增至0.075 μmol/L时,增殖率升高,浓度大于0.075 μmol/L增殖率虽有降低但基本保持不变。当T4浓度为0.03 μmol/L时细胞的增殖率显著低与其他浓度组。由此可见,let-7a的表达量与细胞增殖率呈负相关。miR-let-7a基因在细胞增殖与凋亡等方面发挥越来越重要的作用[5]。let-7a的上调对甲状腺细胞凋亡存在一定的影响[12],let-7a有抑制胃癌细胞增殖迁移等作用[13-14]。虽然现在已有较多关于let-7a影响癌细胞增殖的研究,但let-7a对正常细胞的增殖是否有影响很少有研究报道。本实验结果显示,let-7a在一定浓度的T4下高表达,对细胞增殖有抑制作用,和之前在癌细胞上的研究结果一致[13-14]。
4 结 论
一定浓度的T4抑制细胞增殖而不影响肠道上皮细胞的形态。当T4浓度为0.03 μmol/L时,细胞的增殖率显著低与其他浓度组。T4浓度影响let-7a在肠道上皮细胞中的表达量,且let-7a表达量与细胞增殖呈负相关。T4浓度为0.03 μmol/L时let-7a的表达量极显著高于其他浓度组。let-7a在肠道上皮细胞的表达受T4的调节,推测T4对细胞增殖的影响可能是通过调控let-7a的表达来实现的。
[1] OppenheimerJ H, SchwartzH L, MariashC N,et al. Freake;Advances in our understanding of thyroid hormone action at the cellular level[J]. Endocr Rev, 1987, 8 (3): 288-308.
[2] Cheng SY. Multiple mechanisms for regulation of the transcriptional activity of thyroid hormone receptors[J]. Rev Endocr Metab Disord, 2000, 1(1-2): 9-18.
[3] Reinhart B J, Slack F A, Basson M,et al. The 21 nucleotide let-7 RNA regulates C. elegans developmental tim-ing in Caenorhabditiselegans[J]. Nature, 2000, 403(6772): 901-906.
[4] Boyerinas B, Park S M, Hau A,et al. The role of let-7in cell differentiation and cancer[J]. Endocr Relat Cancer, 2010,17(1): 19-36.
[5] Johnson C D, Esquela-Kerscher A, Stefani G,et al. Thelet-7 microRNA represses cell proliferation pathways inhuman cells[J]. Cancer Res, 2007, 67(16): 7713-7722.
[6] Kumar M S, Lu J, Mercer K L,et al. Impaired microRNA processing enhances cellular transformation and tumorigenesis[J]. Nature Genet, 2007, 39(5): 673-677.
[7] Liu P, Qi M, Ma C,et al. Let7a inhibits the growth ofendometrial carcinoma cells by targeting Aurora-B[J].FEBS Letters, 2013, 587(16): 2523-2529.
[8] Dong Q C, Meng P, Wang T,et al. 2010. MicroRNAlet-7a inhibits proliferation of human prostate cancer cells in vitroand in vivo by targeting E2F2 and CCND2[J]. PLoS One,2010, 5(4): e10147.
[9] 苗志国. 金华猪与长白猪脂肪代谢和消化功能发育差异的研究[D]. 杭州: 浙江大学, 2009.
[10] 高慧珍, 陈理星, 董定娟, 等. miR-let-7基因家族在金华猪和长白猪中的组织表达分析[J]. 中国畜牧杂志, 2017,53(6):44-48.
[11] 王燕丽, 李艳玲, 郝柱, 等. 猪不同生长阶段甲状腺结构的形态计量学研究[J]. 畜牧兽医学报, 2012, 43(4): 521-526.
[12] 王云霞, 王琪, 周辉云, 等. miR-let-7a在大白猪甲状腺中的表达及其对甲状腺细胞凋亡的影响[J]. 农业生物技术学报, 2015, (2): 220-226.
[13] Tang R, Yang C, Ma X,et al. MiR-let-7a inhibits cell proliferation, migration, and invasion by down-regulating PKM2 in gastric cancer [J]. Oncotarget, 2016, 7(5): 5972.
[14] Akao Y, Nakagawa Y, Naoe T. let-7 microRNA functions as a potential growth suppressor in human colon cancer cells[J].Biol Pharm Bull, 2006, 29(5): 903-906.

