彩色棉抗氧化酶活性与棉纤维发育相关性研究
康娜娜,杜海烨,成 莎,渠云芳,黄晋玲
(山西农业大学农学院,山西太谷 030801)
彩色棉是一种棉纤维本身具有天然色素的生态棉,它的制品无需进行染色,经济环保,且质地柔软舒适,既可满足人们的需求又有利于人体健康,有“植物羊绒”之称。但相比于白色棉,彩色棉存在纤维品质较差、产量低、色泽不稳定等缺点,严重阻碍了彩色棉纤维的开发和利用[1]。前人研究表明,彩色棉与白色棉发育过程大体一致,同样经历细胞的分化和突起、纤维伸长、次生壁加厚、脱水成熟4个阶段。但彩色棉除合成纤维素外,还增加了色素的合成与沉积过程,导致竞争性地消耗纤维中的碳水化合物,进而影响纤维素的合成[2]。
植物正常的生长发育,都需要利用氧气进行呼吸作用和光合作用,为自身的生命活动提供能量。已有研究表明,植物正常代谢中会产生有毒的中间副产物活性氧自由基(ROS),包括超氧阴离子(O2-)、过氧化氢(H2O2)、氢氧根离子(OH-)等,活性氧性质活泼,很容易与细胞大分子反应或者直接损伤细胞成分,引起细胞膜损伤[3]。植物体内由超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等组成的抗氧化酶系统,不仅是细胞内活性氧清除剂和抵御逆境的重要防御系统[4],还可以通过影响激素类信号物质浓度、细胞膜结构等调控棉纤维的发育[5]。
宋世佳等[5]研究发现,彩色棉纤维品质受纤维素积累和抗氧化酶双重影响。苏翔等[6-7]研究表明,彩色棉中的色素是一种酚类物质,而抗氧化酶在酚类物质被氧化的过程中起到一定的保护抑制作用,通过抑制色素类物质的氧化而影响激素类物质的合成,进而调控纤维的发育。ROESLER[8]研究表明,抗氧化酶能激活乙酰辅酶A羧化酶,使中间产物流向色素合成途径的可能减少,导致色素合成受到抑制;还可以通过改变质膜结构,影响非纤维素糖类物质在纤维初生壁的积累。
目前,对于棉纤维发育机理的研究多以棉纤维为研究对象,其实棉纤维作为一种特化的种皮,棉籽是其发育的前提和着生点,铃壳是其发育的环境,棉铃为其发育提供营养,所以,棉纤维的发育必然受到铃壳、棉籽生理状态的影响[9]。
本研究以纤维颜色不同的棉花种质为研究材料,以棉纤维发育过程中棉铃各器官为研究对象,探究其在棉纤维发育过程中的生理活性变化,旨在揭示棉纤维发育与抗氧化酶的关系,为彩色棉纤维的品质改良提供理论依据。
1 材料和方法
1.1 试验材料
本研究选用1对纤维颜色不同的棉花近等基因系为材料,即绿叶、多毛、白絮、棕籽(简称白色棉);绿叶、多毛、绿絮、绿籽(简称绿色棉),均由山西农业大学棉花育种实验室提供。
1.2 试验方法
参试材料于2016年4月在山西农业大学农作站棉花试验田种植,采用正常的栽培管理措施进行管理。在棉花生长发育过程中,分别于花铃期和吐絮期取2种材料相同节位上大小相近的棉铃,分成铃壳、棉籽、棉纤维3个部分,液氮速冻后存-80℃,用于生理生化指标的测定。
1.2.1 生理生化指标测定 SOD酶活性采用NBT光还原法测定[10];POD酶活性采用愈创木酚法测定[11];MDA含量测定采用硫代巴比妥法[10];CAT酶活性采用高锰酸钾滴定法进行测定[10];可溶性蛋白含量参照READ等[12]的考马斯亮蓝法测定,以牛血清蛋白为标准品绘制标准曲线。每个指标重复测定3次。
1.2.2 棉纤维品质与产量各项指标测定 采用分梳法,随机取每种材料10粒籽棉,将纤维梳直测定棉纤维长度;取100粒籽棉,分别称其纤维与种子质量,计算衣指、籽指和衣分,设置3次重复。
1.3 数据统计与分析
试验数据采用Excel等软件进行统计和作图,并进行方差分析;使用SPASS进行各项测定指标与纤维发育的相关性分析。
2 结果与分析
2.1 超氧化物歧化酶(SOD)活性动态变化
SOD是植物体内清除活性氧的第1道防线,可以将有毒的O2-及时转换为H2O2,从而降低对植物的损伤,增加膜的稳定性[13-14]。由图1可知,2种材料不同发育时期SOD酶活性变化显著,与花铃期相比,吐絮期2种参试材料棉铃各器官中的SOD酶活性基本呈上升趋势,且在白色棉的棉籽和纤维、绿色棉的铃壳和棉籽中显著上升。
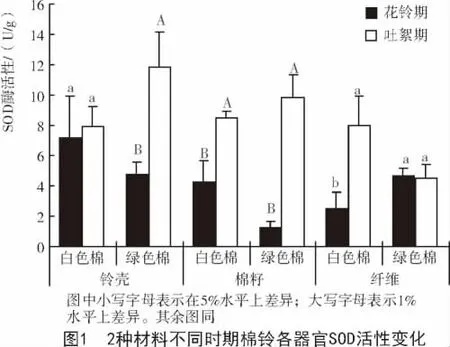
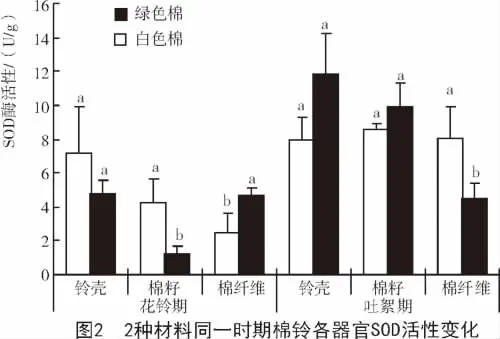
棉纤维发育的同一时期2种材料棉铃不同器官具有不同的SOD酶活性。花铃期,绿色棉铃壳和棉籽中的SOD酶活性均低于白色棉,且棉籽中的SOD酶活性差异显著;而棉纤维中的SOD酶活性显著高于白色棉。吐絮期,绿色棉铃壳和棉籽中的SOD酶活性高于白色棉,而棉纤维中的SOD酶活性显著低于白色棉(图2)。花铃期,绿色棉纤维中较高的SOD酶活性会抑制色素的氧化,而色素类物质能够抑制吲哚乙酸氧化酶(IAAO)的活性,使得吲哚乙酸(IAA)浓度增加,从而促进纤维细胞的生长分化。
2.2 过氧化物酶(POD)活性动态变化
过氧化物酶(POD)是植物体内清除H2O2、降低活性氧伤害的主要酶类之一。棉纤维发育过程中,从花铃期到吐絮期,2种参试材料铃壳中的POD酶活性显著下降,而棉籽中显著上升;白色棉纤维中的POD酶活性显著上升,而绿色棉中则显著下降(图3)。吐絮期,白色棉纤维中POD活性升高,可能与棉纤维发育进入次生壁加厚期有关。次生壁加厚期发生氧化跃迁,产生较多的H2O2,需要更多的POD酶进行清除,使H2O2维持在相对较低的水平,利于次生壁纤维素的积累,促进高强纤维的形成。
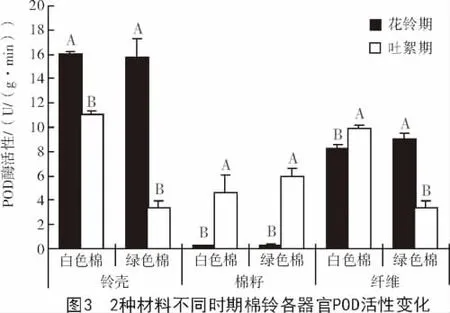

花铃期,2种参试材料棉铃各器官POD酶活性基本相同;吐絮期,白色棉铃壳和棉纤维中的POD酶活性显著高于绿色棉,而棉籽中酶活性基本相同(图4)。吐絮期绿色棉纤维较低的POD酶活性,可能是造成彩色棉纤维品质较差的原因之一。
2.3 过氧化氢酶(CAT)活性动态变化
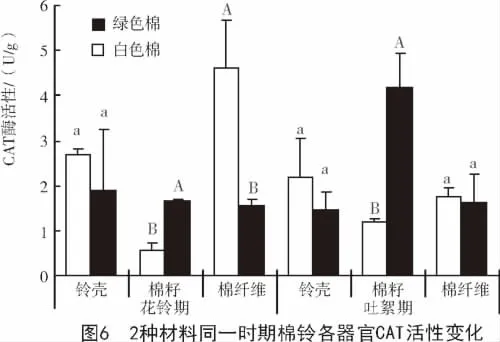
CAT在细胞内主要存在于过氧化物酶体中,其主要功能是清除过氧物酶体中的H2O2。棉纤维发育的不同阶段,与花铃期相比,吐絮期2种参试材料棉籽中的CAT酶活性均呈显著上升趋势;铃壳和棉纤维中的CAT酶活性基本呈下降趋势,且在白色棉纤维中显著下降,而绿色棉纤维中略有上升(图5)。
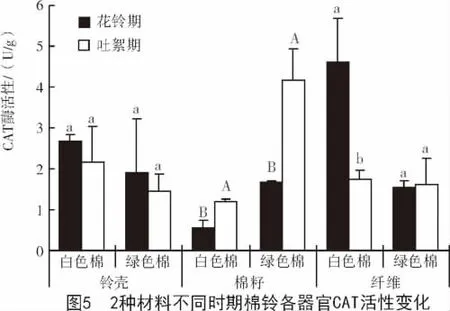
棉纤维发育的同一时期2种材料棉铃不同器官CAT酶活性差异较大。花铃期,白色棉棉籽中CAT酶活性显著低于绿色棉;铃壳和棉纤维中CAT酶活性均高于绿色棉,且在棉籽和棉纤维中差异达到显著水平;吐絮期,白色棉除棉籽中的CAT酶活性显著低于绿色棉外,铃壳和棉纤维中CAT酶活性基本相同(图6)。CAT可能影响纤维的伸长以及色素的形成[14]。花铃期,绿色棉纤维中的CAT酶活性低于白色棉,对纤维伸长的抑制作用减弱,这可能是造成2种参试材料棉纤维长度差异的原因之一。
2.4 丙二醛(MDA)含量动态变化
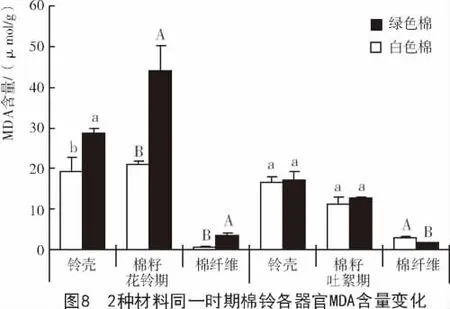
2种参试材料在棉纤维发育的不同时期,MDA含量变化较大。与花铃期相比,吐絮期白色棉棉铃各器官MDA含量在铃壳和棉籽中均呈下降趋势,且在棉籽中显著下降,棉纤维中的MDA含量则显著上升;绿色棉棉铃各器官MDA含量均表现为极显著下降(图7)。

棉纤维发育的同一时期2种材料棉铃不同器官MDA含量不同。花铃期,白色棉棉铃各器官中的MDA含量均显著低于绿色棉;吐絮期,白色棉棉纤维中MDA含量显著高于绿色棉,而铃壳和棉籽中的MDA含量基本相同(图8)。MDA含量可以直接反映膜脂过氧化程度,由此推测,在棉纤维发育过程中,绿色棉中的抗氧化酶不足以清除过量的活性氧,使得绿色棉膜系统损伤严重,这可能是造成绿色棉与白色棉纤维品质有差异的原因之一。
2.5 可溶性蛋白含量动态变化
可溶性蛋白含量是衡量植物体代谢过程中蛋白质变化的重要指标,其可以反映细胞内蛋白质合成、变性及降解等多方面的代谢信息[15]。2种参试材料在棉纤维发育的不同时期可溶性蛋白含量变化不大。与花铃期相比,吐絮期2种参试材料棉铃各器官中的可溶性蛋白含量除在棉纤维中表现不同以外,在铃壳和棉籽中变化趋势基本相同,在铃壳中呈上升趋势,在棉籽中表现为下降,但差异均未达到显著水平(图9)。
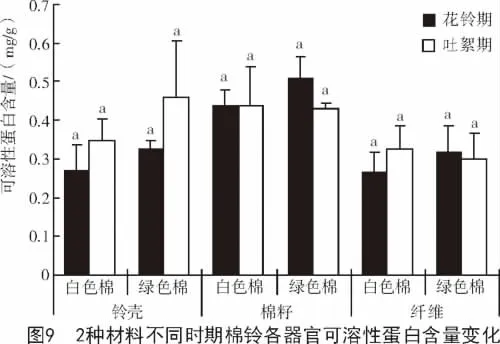
2种参试材料相比,同一发育时期可溶性蛋白含量也无显著差异。花铃期,白色棉棉铃各器官中可溶性蛋白含量均低于绿色棉;而吐絮期,白色棉棉铃各器官中的可溶性蛋白含量除铃壳中低于绿色棉外,棉籽和棉纤维中均高于绿色棉,但差异均不显著(图10)。吐絮期白色棉纤维中较高的可溶性蛋白含量,有利于次生壁的发育。

2.6 2种参试材料考种数据分析
从表1可以看出,参试的2种材料,除纤维长度外,白色棉品种的百粒棉质量、百粒籽质量、衣指、衣分均高于绿色棉,表明白色棉纤维产量及纤维品质优于绿色棉。

表1 参试材料考种数据分析
2.7 棉铃各器官各项测定指标与纤维发育的相关性分析
由表2可知,棉纤维发育过程中,棉铃不同器官酶活性与纤维各项指标之间的相关性不同。吐絮期纤维POD酶活性、花铃期纤维CAT酶活性与衣分呈显著正相关,其相关系数分别达到0.834和0.861;花铃期纤维MDA含量与衣分呈极显著负相关,其相关系数达到0.925。花铃期棉籽SOD酶活性、纤维CAT酶活性、吐絮期铃壳POD酶活性与衣指呈显著正相关,其相关系数分别达到0.843,0.940和0.988;而花铃期棉铃各器官MDA含量与衣指呈显著负相关,相关系数分别达到0.924,0.934和0.981。花铃期和吐絮期棉籽CAT酶活性、吐絮期棉籽POD酶活性以及花铃期棉籽MDA含量均与纤维长度呈显著正相关;花铃期和吐絮期纤维CAT酶活性与纤维长度呈负相关关系。

表2 各项测定指标与纤维发育相关性分析
3 讨论
3.1 抗氧化酶活性对棉纤维发育的影响
相关研究表明,彩色棉纤维中的色素是一种酚类物质,而抗氧化酶在酚类物质氧化过程中起到一定的保护作用。杜雄明等[17]研究认为,酚类物质有抑制吲哚乙酸氧化酶(IAAO)活性的作用,相应地提高了吲哚乙酸(IAA)的水平,因此,较高活性的抗氧化酶有利于激素类物质的形成,从而促进棉纤维的伸长发育。随着棉纤维发育的进程,棉纤维进入次生壁加厚阶段,发生氧化跃迁,产生大量的H2O2[18],白色棉纤维中SOD活性和POD活性显著上升,一方面有利于活性氧的清除;另一方面在纤维发育后期高活性的POD可以加速棉纤维细胞木质化,利于纤维次生壁加厚,且纤维细胞高活性的POD酶活性有利于高强纤维的形成[19-21]。
本研究发现,在花铃期,绿色棉纤维中的SOD酶活性和POD酶活性均高于白色棉,推测由于绿色棉纤维中较高的抗氧化酶活性,抑制了色素类物质的氧化,加剧了酚类物质对吲哚乙酸氧化酶(I-AAO)的抑制作用,使得绿色棉纤维中的吲哚乙酸浓度增加,促进棉纤维伸长。从花铃期到吐絮期,绿色棉纤维中POD酶活性极显著低于白色棉,不利于纤维素在次生壁平稳沉积,造成彩色棉纤维产量及强度低于白色棉,考种数据也证实了这一点。
3.2 CAT酶对纤维品质的影响
CAT是抗氧化酶系统的一种,可以清除光呼吸产生的H2O2,提高光合效率,增加碳水化合物的积累,从而提高棉纤维的品质[22]。相关研究表明,CAT可能影响纤维的伸长以及色素的形成。李玉青等[15]以百棉1号、中棉所41为试材,对其棉纤维发育过程中的CAT活性变化进行了研究,结果表明,CAT对于棉纤维的伸长具有抑制作用。苏翔[6]以棕色棉和白色棉为试材,对其纤维发育过程中种皮与纤维中抗氧化酶活性变化进行研究,结果表明,花后35 d,种皮CAT酶活性和棕色棉种皮中的棕色素呈极显著负相关。本研究相关性分析结果表明,花铃期和吐絮期棉纤维中的CAT活性与纤维长度呈负相关关系,高活性的CAT对棉纤维长度存在抑制作用。从花铃期到吐絮期,白色棉纤维中CAT活性高于绿色棉,且在花铃期差异达到极显著水平,这可能是白色棉纤维长度较绿色棉短的原因之一。
3.3 MDA含量对棉纤维品质的影响
丙二醛(MDA)是膜脂过氧化的终端产物,其含量的多少可以反映生物膜的损伤程度和细胞中的活性氧状况[23]。在棉纤维发育过程中,抗氧化酶通过影响质膜结构而影响非纤维素的糖类物质(如色素等)在初生壁的形成,最终造成棉纤维品质的差异[5]。詹少华等[24]研究认为,在棉纤维发育的整个时期,绿色棉MDA含量高于棕色棉与白色棉,由此推测,MDA含量高是导致绿色棉纤维品质差的原因之一。本研究发现,花铃期棉铃各器官中的MDA含量与衣分、衣指呈负相关关系,在棉纤维中呈极显著负相关。棉纤维发育过程中,绿色棉铃壳和棉籽中的MDA含量均高于白色棉,且在花铃期差异达到显著水平。表明在纤维发育进程中绿色棉中活性氧积累较多,膜系统损伤较大。此外,棉纤维发育后期,由于色素类物质在纤维次生壁上积累,竞争性地消耗纤维素合成所需要的底物,也是导致纤维含量降低和纤维品质较差的原因[25]。
[1]华水金.彩色棉与白色棉产量和品质差异的分子生理机制研究[D].杭州:浙江大学,2007.
[2]张美玲.彩色棉纤维分化发育规律与色素成分研究 [D].泰安:山东农业大学,2013.
[3]张述义,刘玲玲.水分胁迫对不同品种小麦幼芽抗氧化酶活性的影响[J].山西农业科学,2013,41(2):122-125.
[4]丁改秀,王保明,王小原,等.枣果实不同发育期果皮抗氧化酶类活性及MDA和脯氨酸含量变化研究 [J].山西农业科学,2014,42(10):1075-1077,1110.
[5]宋世佳,孙红春.彩色棉抗氧化系统生理特征及纤维素累积对纤维品质的影响[J].中国农业科学,2015,48(19):3811-3820.
[6]苏翔.棕色棉纤维色素积累及遗传规律的研究[D].合肥:安徽农业大学,2009.
[7]赵向前.彩色棉的纤维色素与品质形成机理[D].杭州:浙江大学,2003.
[8]ROESLER K.β-ketoacyl-ACP synthase of the tub B gene and identification ofthe cerulenin bindingresidue[J].Journal ofthe Science ofFood and Agriculture,2003,53:357-370.
[9]李东晓.干旱对棉花叶片的衰老生理及抗氧化酶同工酶谱特征的影响[D].保定:河北农业大学,2010.
[10]陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2006.
[11]MICHEAL M,MEYER Y,MARTIN B.Lokalisation der peroxidaseisozymes in protoplasten und zelwanden von Nicotiana tabacum L[J].Planta,1975,122:259-319.
[12]READ S M,NORTHCOTE D H.Minimization of variation in the response to different protein of the coomassic Blue Gdyedinding:assayfor Protein[J].Anal Biochem,1981,116:53-64.
[13]谢晓红.植物抗氧化酶系统研究进展[J].化工管理,2015(11):99-100.
[14]邓化冰,王天顺,肖应辉.低温对开花期水稻颖花保护酶活性和过氧化物积累的影响[J].华北农学报,2010,25(Z2):62-67.
[15]李玉青,王清连,胡根海.陆地棉纤维发育中的生理生化指标研究[J].湖北农业科学,2010,49(7):1573-1576.
[16]胡根海,王清连,张金宝,等.早熟棉花新材料生理指标动态变化规律[J].四川农业大学学报,2009,27(3):275-278.
[17]杜雄明,潘家驹,汪若海.棉纤维细胞分化与发育[J].棉花学报,2000,12(4):212-417.
[18] POTIKHA T S,LEVINE A.The involvement of hydrogen peroxide in the differentiation of secondary walls in cotton fibers[J].Plant Physiology,1999,119(3):849-858.
[19]王水平,沈曾佑,张志良,等.棉纤维细胞伸长生长与过氧化物酶和 IAA氧化酶的关系[J].植物生理学报,1985,11(4):409.
[20]刘思颖,沈曾佑,张志良.岱字15号棉纤维发育过程中纤维细胞壁组分变化的研究[J].植物生理学报,1983,9(4):347-350.
[21]张文静,周治国,胡宏标.棉花季节桃纤维发育相关酶活性变化与纤维比强度形成的关系[J].棉花学报,2008(5):342-347.
[22]张坤生,田荟琳.过氧化氢酶的功能及研究[J].食品科技,2007(1):8-11.
[23]林艳,郭伟珍,徐振华.大叶女贞抗寒性及冬季叶片丙二醛和可溶性糖含量的变化[J].中国农学通报,2012,28(25):68-72.
[24]詹少华,林毅,吕凯.天然彩色棉过氧化物酶、丙二醛及硝酸还原酶的测定[J].安徽农业科学,2005,33(1):17-18.
[25]汪淼.光质对棕色棉纤维发育及色素合成影响的研究 [D].合肥:安徽农业大学,2011.
——全棉籽的加工与利用

