八角提取物对多种植物病原真菌的抑制作用
程慧丽,赵慧琳,杨苏苏,郝晓娟,杨 春,曹 挥
(山西农业大学农学院,山西太谷 030801)
八角(Illicium verum Hook.f.)是双子叶植物纲木兰科八角属的一种[1],又称八角茴香、大茴香、大料、五香八角等[2],主要分布于我国的广西、广东、云南等以及东南亚地区,大部分为野生种,生长于天然杂木林内,是一种多年生的常绿乔木。其干燥成熟的果实中含有5%~8%的芳香油、约22%的脂肪油以及少量的蛋白质、树脂等[3],是优良的食品调料和中药。八角作为香辛料在我国已使用数百年,其可增香调味和配制卤汤[4];作为中药,其具有抗炎、镇痛[5]、抑菌等作用[6-7],还被广泛应用于化妆品中(如牙膏、香皂等[11])。
八角熟材不仅气味宜人,而且不受虫蛀。近年来,有研究表明,从天然八角茴香中提取得到的精油,具有较好的杀虫活性和抗自由基氧化的作用[8],可作为食品天然防腐剂和抗菌剂。此外,八角茴香水煎剂对结核杆菌及枯草杆菌具有抑制作用,其乙醇提取液对金黄色葡萄球菌、肺炎球菌及一些常见的致病性念珠菌具有抑制作用[9-10]。刘志希等[11]研究发现,八角茴香精油及其主要成分反式茴香醚对棉花枯萎病菌的菌丝生长具有明显的抑制作用。陆宁海等[12]研究结果表明,八角茴香的4种不同溶剂提取物对水稻纹枯病菌(Rhizoctonia solani)、大葱紫斑病菌(Alternaria porri)、番茄早疫病菌(Alternaria solani)和棉花枯萎病菌(Fusarium oxysporum)4 种植物病原菌都具有一定的抑制作用,丙酮和二甲苯提取八角茴香抑菌活性相对较强,甲醇次之,乙醇相对较弱。
本试验根据八角茴香精油及其主要成分对植物病原真菌的抑制作用,采用生长速率法,测定八角提取物对不同供试菌种的抑制效果[13-14],以筛选出作用效果较好的菌种,为进一步研究、开发八角的农用价值提供科学依据。
1 材料和方法
1.1 供试材料
1.1.1 植物材料 供试植物材料为八角果实提取物(购自太谷县中药市场)。
1.1.2 供试菌种 香蕉枯萎病菌(Fusarium oxysporum f.sp.cubense)、番茄早疫病菌(Alterrnaria solani)、番茄黑斑病菌(Pesudomonas syringae)、兰花枯萎病菌(Fusarium oxysporium)、苹果轮纹病菌(Botryosphaeria berengeriana)、核枯梢病菌(Phomopsis macrospora)、三七根腐病菌(Cylindrocaipon destructans)、番茄灰霉病菌(Botrytis cinerea)、玉米大斑病菌(Exserohilum turcicum)、甜瓜枯萎病菌(Fasarium oxysporum)、梨黑斑病菌(Alternaria kikuchiana)、苹果炭疽病菌(Colletotrichum gloeosporioides)、豆角炭疽病菌(Colletotrichum lindemuthianum)、枣炭疽病菌 (Colletotrichum gloeosporioidies)、葡萄根腐病菌(Fusarium oxysporum)、番茄枯萎病菌(Colletotrichum gloeosporioidies)、辣椒灰霉病菌 (Botrytis cinerea)、 茄子 枯 萎病 菌(Colletotrichum gloeosporioidies)、苹果树腐烂病菌(Cytospora mandshurica)西瓜枯萎病菌(Fusarium oxysporum f.sp.niveum)等20种病菌,由山西农业大学农学院植物病理实验室提供,经分离纯化后,在PDA培养基上保存备用。
1.1.3 试剂和主要仪器 化学试剂为丙酮分析纯。主要仪器为1702-MP8型电子天平、100~1 000 mL移液器、微波炉、灭菌锅、培养箱、超净操作台、成像显微镜。
1.2 试验方法
1.2.1 培养基的制备 称取马铃薯200 g,加入1 000 mL水,煮沸0.5 h,用纱布过滤汁液,然后加入20 g葡萄糖、20 g琼脂,加水补充到1 000 mL,分装锥形瓶,放入灭菌锅中进行灭菌,常温条件下保存备用。
1.2.2 八角初提取物的制备 称量45 g八角回香,研磨成粉末后,与225 mL的丙酮装入浸提缸内;用超声波(室温、1 h)提取[15],静置 12 h 后,用真空抽滤泵进行抽滤;将抽滤液放置于旋转蒸发仪内浓缩至一定浓度,测定其浓度;将抽滤完的八角回香再次在相同条件下提取,重复以上操作3次;将3次的提取物质量相加,计算八角茴香的提取率及测定其浓度。
1.2.3 1 mg/mL八角提取物的制备 取八角丙酮提取物1 mL于离心管中,进行离心真空抽提后称质量,测定八角丙酮提取物的质量浓度为40 mg/mL。取0.5 mL的药物提取液于离心管中,加入灭菌后的培养基定容至20 mL,用振荡器混合均匀,制成质量浓度为1 mg/mL的备用药液。丙酮对照用相同方法配制。
1.2.4 抑菌活性测定 八角茴香提取物对20种病原菌丝生长的抑制作用采用生长速率测定法[16]进行,用打孔器(6 mm)在菌落边缘菌丝生长茂盛的地方打孔,用接种针接种至加药的PDA平板上培养(药与培养基比为1∶19),同时以培养基内加入一定比例的丙酮为对照,每个处理重复3次,置于25℃下恒温培养。用十字交叉法测定每个菌落的直径,以其平均值代表菌落的直径(上述一系列操作必须在严格无菌条件下进行)。
菌丝生长抑制率=(对照菌落直径-处理菌落直径)/(对照菌落直径-0.6 cm)×100%(1)
1.2.5 八角提取物对菌丝形态的影响 在PDA培养基中加入一定量的八角提取物,配制成含八角提取物浓度为0.1 mg/mL的PDA培养基,用打孔器(直径6 mm)在生长旺盛的番茄灰霉病菌的菌落边缘打取菌饼,用接种针将菌饼接入事先准备好的含药培养基上,以培养基内加同等比例的丙酮培养基作为对照,在适宜的条件下振荡培养(150 r/min,25℃)。处理72 h之后,分别挑取处理组和对照组的菌丝,用0.1 mol/L的磷酸缓冲液冲洗菌丝表面的培养基,显微镜下观察[17]。
2 结果与分析
2.1 八角提取物对不同病菌生长速率的影响
试验分别对比了1 mg/mL八角提取物不同病菌的抑制作用,结果列于表1。
从表1可以看出,在八角提取物质量浓度为1 mg/mL时,对番茄灰霉病菌和辣椒灰霉病菌的抑制效果最为明显,对这2种病原菌的抑制率都在96%以上,而且随着时间的延长,抑菌效果相对稳定;对其他18种病原真菌的抑菌率也都在45%以上。所以,以番茄灰霉病菌为供试菌,研究不同质量浓度的八角提取物对番茄灰霉病菌生长速率的抑制效果。
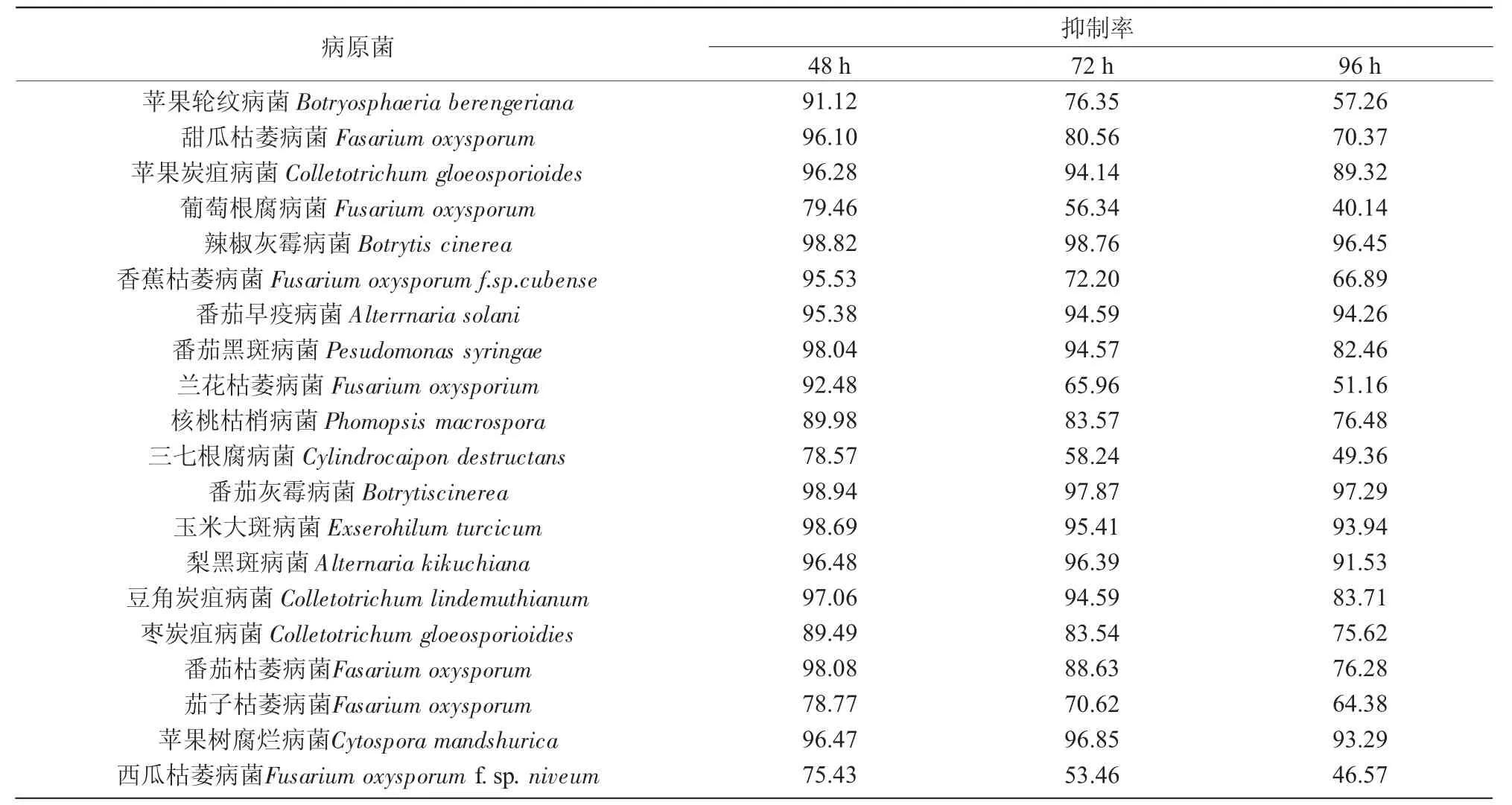
表1 八角提取物对不同病菌的抑制作用 %
2.2 不同浓度八角提取物对番茄灰霉病菌的毒力作用
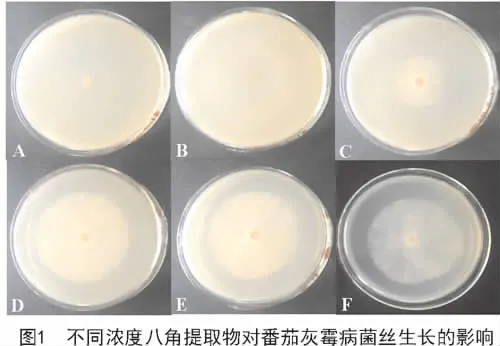
根据上述试验对番茄灰霉病菌的抑制效果,设置 1(A),0.5(B),0.25(C),0.125(D),0.062 5(E),0(F)mg/mL不同浓度梯度的八角提取物溶液,观察其经过48,72,96 h的抑菌效果,其结果如图1所示。为进一步研究本试验中八角茴香提取物对番茄灰霉病菌抑制最佳时间和最强抑制效果,分别计算出八角茴香提取物在48,72,96 h时,番茄灰霉病菌的毒力回归方程(y=ax+b)、抑制作用的有效浓度(EC50)以及相关系数(表2)。
由表2可知,在不同时间内,当相关系数无限趋近于1时,变数间的关系接近于直线相关。此外,以番茄灰霉病菌作为供试菌,在48 h时,有效中浓度EC50值为0.135 3 mg/mL,与72,96 h时的EC50值相比最小。由此可知,八角提取物对番茄灰霉病菌在48 h内抑菌效果较好。
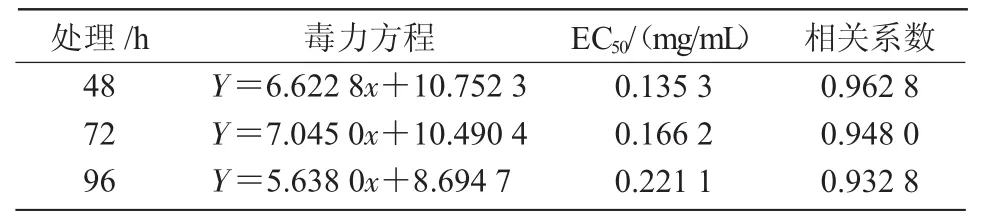
表2 八角提取物对番茄灰霉病菌的毒力
2.3 八角提取物对菌丝形态的影响
图2为供试菌在不含八角提取物的培养基中的生长状况,图3为供试菌在含有八角提取物浓度为0.125 mg/mL时的生长状况。与图2(对照组)相比,在含药培养基中生长的菌丝粗细程度不一,菌丝表面多有凹凸,菌丝内溶物变少或者流失(图3)。


3 结论与讨论
本试验以20种供试菌种作为筛选样本,检验八角提取物的抑制作用,结果表明,其提取物对多种病原菌的抑制效果较好,其中,对于番茄灰霉病和辣椒灰霉病效果显著,抑制率均达到96%以上,而且随着时间的延长,作用效果相对比较稳定。此外,以番茄灰霉病菌作为供试菌,在48 h时,有效中浓度EC50值为0.135 3 mg/mL,所以,八角提取物对番茄灰霉病菌在48 h内抑菌效果明显。通过在显微镜下观察菌丝的形态,可以明显地观察到菌丝的变化,菌丝表面出现凹凸,内溶物流失,为进一步研究八角提取物对番茄灰霉病的作用机制奠定了基础。
我国物产丰富,许多植物资源尚未得到充分利用。八角为我国南方的特产香辛料,不仅是一种“药食同源”的经济物种,而且其代谢产物中富含多种活性成分,开发价值巨大[18]。本试验从人们关注的环保出发,对八角茴香果实提取物进行抑菌活性测定,但并未对其他部位的提取物进行药效试验,不能确定其抑菌活性。八角茴香提取物在室内试验中表现出很好的抑菌效果,但其是否在活体盆栽试验以及室外试验中也能表现出显著的抑菌效果,还需要进一步研究证实。
[1]连锦花,孙果宋.八角的研究进展[J].化工技术与开发,2010,39(3):31-33.
[2]陆宁海,吴利民,赵荣艳,等.不同溶剂提取八角茴香抑菌活性物质初步研究[J].广东农业科学,2011,38(22):75-77.
[3]王琴,蒋林,温其标.八角茴香的研究进展[J].中国调味品,2005(5):18-22.
[4]吴周和,徐燕,吴传茂.八角中天然防腐剂的提取方法及其抑菌作用研究[J].中国调味品,2003(9):18-20,47.
[5]李伟,杨旭.八角茴香及其提取物莽草酸的研究进展[J].中国调味品,2008(1):24-28.
[6]赫林.食品微生物实验技术 [M].北京:中国农业出社,2001:138-139.
[7]张玲,李植峰,谭亚芳,等.一种简便、快速的真菌油脂提取方法[J].生物技术,1999,9(6):43-44.
[8]王同禹,田玉红.八角茴香水溶性挥发成分的提取和分析[J].安徽农业科学,2009,37(14):6308-6309,6339.
[9]赵俊丽,骆志成.八角茴香挥发油抗念珠菌活性的体外研究[J].中华皮肤科杂志,2004,37(8):475-477.
[10]ISAOKOUNO,YANGCS,TAKUYAMORISALCI,et al.Twonew sesqnineolignans from the bark of illicinm dnnniannm[J].Chem PharmBull,1991,39(10):2606.
[11]刘志希,李锋,张腊梅.八角茴香精油及其主成分对棉花枯萎病 菌 的 拮 抗 作 用 [J]. 安 徽 农 业 科 学 ,2010,38(32):18193-18194.
[12]陆宁海,吴利民,赵荣艳,等.不同溶剂提取八角茴香抑菌活性物质初步研究[J].广东农业科学,2011,38(22):75-77.
[13]田菲菲,蒋继志,沈凤英,等.126种中草药提取物对两种植物病原菌的抑菌活性[J].华北农学报,2006,21(Z1):131-134.
[14]张文渊,王文桥,张小风,等.土木香对植物病原菌抑菌活性的初步研究[J].华北农学报,2007,22(3):115-118.
[15]冯亦平,程杰瑞,陈丽君,等.泡桐花抑菌活性成分最佳提取工艺研究[J].山西农业科学,2014,42(5):445-447,451.
[16]宋昱,谢三刚,王玉香,等.地黄根腐病的诊断及科农牌1号生物制剂对地黄根腐病的防治效果 [J].山西农业科学,2006,34(1):73-75.
[17]沈晓强.丁香提取物对番茄疫霉根腐病菌生物活性的研究[D].太谷:山西农业大学,2015.
[18]BAKER D D,CHU M,OZA U,et al.The value of natural products tofuture pharmaceutical discovery[J].Nat Prod Rep,2007,24(6):1225-1241.

