常规弥散加权成像表观弥散系数在局部进展期直肠癌新辅助放化疗疗效评价中的应用价值
胡飞翔,张换,汤伟,彭卫军,童彤*
研究显示,局部进展期直肠癌患者经治疗后获得病理完全缓解(pCR)时预后较好,有利于降低总复发率和提高无病生存率[1-2]。近些年局部进展期直肠癌的治疗方式从手术切除加辅助放疗转向术前联合放化疗(CRT),术前CRT可提高局部控制率、降低复发率并且减少细胞毒性[3]。术前6~8周长程CRT的优势是可以明显缩小肿瘤体积、降低肿瘤分期,且10%~30%的患者可以达到pCR[4-5]。近期有数据提示经新辅助CRT后获得pCR的患者是否可以行非手术治疗[6],能否对这部分患者进行有效的个体化治疗?此时早期准确评估pCR就显得十分重要。目前对于pCR的患者是否采取手术治疗仍存在争议,在术前能否给外科医生提供准确的pCR信息尤为重要,这些信息可以让外科医生制定治疗策略,并且有希望缩小手术范围,部分患者可行保留肛门括约肌的局部切除手术。
常规磁共振扩散加权成像(DWI)表观弥散系数(ADC)可用来评价局部进展期直肠癌患者新辅助CRT后的疗效,常用的评价标准为pCR、肿瘤退缩分级(TRG)和肿瘤降期情况,以往的研究常引入其中一项作为疗效评价标准,并没有做对照研究,然而三者是有差异的。因此,本研究主要判断ADC在哪一项疗效评价标准中具有较高的诊断效能,并探索分析局部进展期直肠癌新辅助CRT后ADC的改变是否有利于预测pCR。
1 资料与方法
1.1 一般资料 收集2014年1月—2015年9月复旦大学附属肿瘤医院收治的局部进展期直肠癌患者60例,患者均经病理活检证实为直肠腺癌。纳入标准:(1)最初磁共振分期显示为局部进展期(≥T3期和/或淋巴结阳性);(2)术前行新辅助CRT;(3)新辅助CRT前后各行1次3.0 T MRI检查且包含DWI序列;(4)新辅助CRT后行手术治疗,有完整的术后病理资料。排除标准:(1)MRI检查禁忌证患者(n=0);(2)MRI检查或病理数据不完整(n=1);(3)延迟手术(新辅助CRT后超过1个月未手术)或取消手术(n=2);(4)药物或造影剂过敏(n=0);(5)在本研究之外行CRT(n=1)。排除4例患者后,56例局部进展期直肠癌患者组成了最终的研究人群,其中女16例,男40例;平均年龄(52±11)岁。
1.2 新辅助CRT 放疗采用三维立体定向技术,患者取俯卧位,照射范围包括原发肿瘤及淋巴引流区,骨盆照射总剂量为45 Gy(1.8 Gy/d,每周5 d,持续5周)。此外,使用6~15 MV能量光子对肿瘤进行照射,总剂量为5.4~9.0 Gy(3~5 d,1.8 Gy/d)。同期行化疗,每周放疗第1天给予奥沙利铂(南京制药厂有限公司,IKO-091Z)(50 mg/m2)静脉滴注2 h,整个疗程持续给予5-氟尿嘧啶(上海旭东海普药业有限公司,IKD-060)〔200 mg·(m2)-1·d-1〕静脉滴注。于CRT完全结束后行第2次MRI检查(平均7周),第2次MRI检查后的1~4 d内进行手术。
1.3 MRI检查 采用3.0 T MR扫描仪(MAGNETOM Skyra, Siemens Healthcare, Erlangen, Germany)检查,16通道体部相控阵线圈作为接收线圈。患者新辅助CRT前后两次MRI检查均包括DWI序列,传统磁共振序列包括T2加权快速自旋回波序列(T2WI)及T1加权序列。直肠癌分期需要高分辨的T2矢状位、轴位及冠状位成像。以矢状位为参考指导轴位扫描(在肿瘤水平垂直于直肠壁),平行于肛管行冠状图像扫描。斜轴位DWI采用单次回波平面成像(SSEPI)序列紧随常规MRI扫描后,采用相同的参数在斜轴位T2WI匹配肿瘤位置。DWI序列分别采用4个b值:0、700、1 400、2 100 s/mm2,MRI参数及序列归纳(见表1)。患者均按照标准的直肠扫描协议进行扫描,检查前均未行特殊肠道准备(直肠充填或灌肠),膀胱充盈适度。
1.4 ADC的测量 通过软件Body Diffusion Toolbox(Siemens Healthcare GmbH, Erlangen, Germany)计算得出ADC,感兴趣区(ROI)参照相应的T2加权像于轴位ADC图上沿肿瘤边缘画取整个肿瘤组织,由两位放射科医师达成一致意见后选取ROI。其中经验丰富的医师有10年以上的临床经验,而经验较少的医师在直肠磁共振诊断上也有5年的临床经验,两位医师均不知晓病理结果。如果治疗后没有肿瘤残余或肿瘤退缩十分明显,特别是新辅助CRT后获得pCR的患者,则治疗后的ROI是以治疗前所选择区域为对照,以相应增厚的肠壁或正常残留直肠为范围绘制。ADCpre及ADCpost分别指CRT前、后的ADC值,而ADC比值ADCratio=(ADCpost-ADCpre)/ADCpre。

表 1 磁共振扫描参数Table 1 Imaging protocol for MRI sequences
1.5 评价标准 由1名经验丰富的胃肠道病理学专家分析术后组织病理分期及分级。直肠癌术后分期根据第7版美国癌症联合委员会(AJCC)分期标准[7]。T分期:Tx,原发肿瘤无法评估;T0,无原发肿瘤的确切证据;Tis,原位癌,仅局限在上皮内或侵犯黏膜固有层;T1,侵犯黏膜下层;T2,侵犯固有肌层;T3,穿透固有肌层侵犯结直肠旁组织;T4,直接侵犯其他结构或器官。N分期:Nx,无法评估区域淋巴结;N0,无区域淋巴结转移;N1,1~3枚区域淋巴结转移;N2,≥4枚区域淋巴结转移。M分期:M0,无远处转移;M1,有远处转移。TRG[8]:0级,完全缓解,无癌细胞残留;1级,中度缓解,仅小簇状或单个癌细胞残留;2级,轻度缓解,仍有肿瘤细胞残留,但主要表现为纤维化;3级,较差缓解,少量或无肿瘤细胞被杀死,广泛残余癌。通过比较治疗前和术后病理分期来确定是否降期,并且定义为ypStage 0-I(ypT0-2N0M0,“yp”中的y表示CRT后分期、p表示术后病理分期)。术前分期为T3~4期,术后T分期降至T2期及以下的患者为T降期组;术后TRG 0~1级患者为TRG缓解组,TRG 2~3级患者为TRG非缓解组;如果在切除标本中未发现肿瘤细胞,只存在纤维团块或无癌细胞的黏液蛋白池,即TRG 0级,并且无阳性淋巴结存在,则表示为完全缓解(ypT0N0),最终将ypT0N0期患者均归类为pCR组。
1.6 统 计 学 方 法 采 用 SPSS 21.0(Chicago,IL,USA)统计软件和MedCalc 12.7.2( MedCalc Software,Ostend,Belgium)进行统计分析。计量资料以表示,两组间比较采用成组t检验;计算ADC各参数对于疗效评价的灵敏度、特异度、阳性预测值、阴性预测值及正确率,采用受试者工作特征曲线(ROC曲线)评价各参数的诊断效能。截断值采用最大约登指数计算:约登指数=灵敏度-(1-特异度)。以p<0.05为差异有统计学意义。
2 结果
2.1 分组情况 T降期组26例,T非降期组30例;TRG缓解组22例,TRG非缓解组34例;pCR组14例,非pCR组42例。
2.2 ADC参数比较 pCR组ADCpost、ADCratio均高于非pCR组,差异有统计学意义(P均<0.001);pCR组、非pCR组ADCpre比较,差异无统计学意义(P>0.05,见表2)。TRG缓解组ADCpost、ADCratio均高于TRG非缓解组,差异有统计学意义(p<0.05);TRG缓解组、TRG非缓解组ADCpre比较,差异无统计学意义(P>0.05,见表3)。T降期组ADCpost、ADCratio均高于T非降期组,差异有统计学意义(p<0.05);T降期组、T非降期组ADCpre比较,差异无统计学意义(P>0.05,见表4)。
2.3 ADC参数疗效评价效能 ADCpre评价pCR最佳截断值≤0.82×10-3mm2/s时,ROC曲线下面积为0.583〔95%CI(0.44,0.71)〕,灵敏度为57.1%(8/14),特异度为69.0%(29/42),阳性预测值为38.1%(8/21),阴性预测值为82.9%(29/35),正确率为66.1%(37/56)。ADCpost评价 pCR 最佳截断值 >1.17×10-3mm2/s时,ROC曲线下面积为0.823〔95%CI(0.70,0.91)〕,灵敏度为92.9%(13/14),特异度为66.7%(28/42),阳性预测值为48.1%(13/27),阴性预测值为96.6%(28/29),正确率为73.2%(41/56)。ADCratio评价pCR最佳截断值>0.43时,ROC曲线下面积为0.793〔95%CI(0.66,0.89)〕,灵敏度为78.6%(11/14),特异度为73.8%(31/42),阳性预测值为50.0%(11/22),阴性预测值为91.2%(31/34),正确率为75.0%(42/56)。
ADCpre评价TRG最佳截断值≤0.88×10-3mm2/s时,ROC曲线下面积为0.567〔95%CI(0.43,0.70)〕,灵敏度为77.3%(17/22),特异度为50.0%(17/34),阳性预测值为50.0%(17/34),阴性预测值为77.3%(17/22),正确率为60.7%(34/56)。ADCpost评价TRG最佳截断值>0.20×10-3mm2/s时,ROC曲线下面积为0.773〔95%CI(0.64,0.87)〕,灵敏度为72.7%(16/22),特异度为79.4%(27/34),阳性预测值为69.6%(16/23),阴性预测值为81.8%(27/33),正确率为76.8%(43/56)。ADCratio评价TRG最佳截断值>0.37时,ROC曲线下面积为0.721〔95%CI(0.59,0.83)〕,灵敏度为68.2%(15/22),特异度为70.6%(24/34),阳性预测值为60.0%(15/25),阴性预测值为77.4%(24/31),正确率为69.6%(39/56)。
表 2 pCR组和非pCR组ADC参数比较(Table 2 Comparison of ADC parameters between pCR and non-pCR groups

表 2 pCR组和非pCR组ADC参数比较(Table 2 Comparison of ADC parameters between pCR and non-pCR groups
注:pCR=病理完全缓解,ADC=表现弥散系数
pCR组 14 0.82±0.11 1.31±0.13 0.64±0.34非pCR组 42 0.86±0.15 1.12±0.16 0.33±0.27 t值 -0.978 4.385 3.104 P值 0.332 <0.001 <0.001
表 3 TRG缓解组和TRG非缓解组ADC参数比较()Table 3 Comparison of ADC parameters between TRG0-1 and TRG2-3 groups
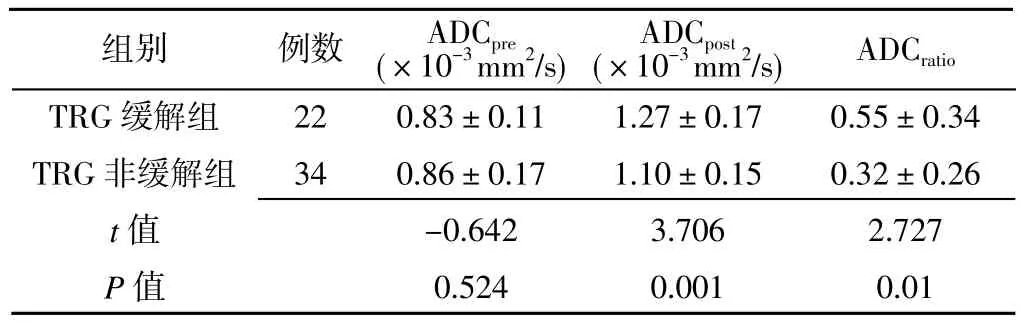
表 3 TRG缓解组和TRG非缓解组ADC参数比较()Table 3 Comparison of ADC parameters between TRG0-1 and TRG2-3 groups
注:TRG=肿瘤退缩分级
组别 例数 ADCpre(×10-3 mm2/s) ADCpost(×10-3 mm2/s) ADCratio TRG缓解组 22 0.83±0.11 1.27±0.17 0.55±0.34 TRG非缓解组 34 0.86±0.17 1.10±0.15 0.32±0.26 t值 -0.642 3.706 2.727 P值 0.524 0.001 0.01
表 4 T非降期组和T降期组ADC参数比较()Table 4 Comparison of ADC parameters between T downstaging and non-T downstaging groups
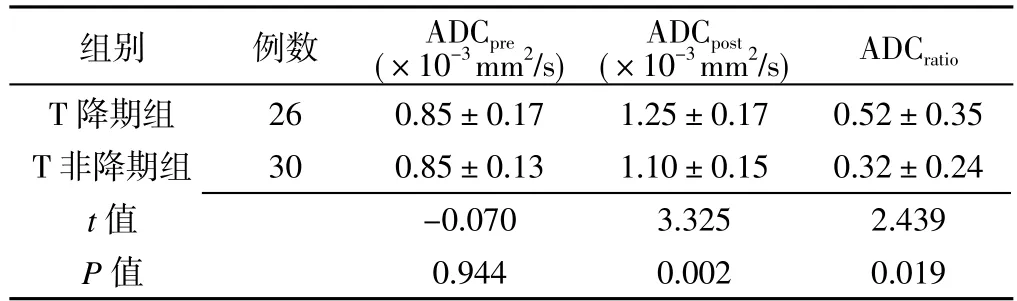
表 4 T非降期组和T降期组ADC参数比较()Table 4 Comparison of ADC parameters between T downstaging and non-T downstaging groups
T 降期组 26 0.85±0.17 1.25±0.17 0.52±0.35 T非降期组 30 0.85±0.13 1.10±0.15 0.32±0.24 t值 -0.070 3.325 2.439 P值 0.944 0.002 0.019
ADCpre评价T降期最佳截断值≤0.82×10-3mm2/s时,ROC曲线下面积为0.545〔95%CI(0.41,0.68)〕,灵敏度为46.2%(12/26),特异度为70.0%(21/30),阳性预测值为48.0%(12/25),阴性预测值为67.7%(21/31),正确率为58.9%(33/56)。ADCpost评价T降期最佳截断值>1.23×10-3mm2/s时,ROC曲线下面积为0.747〔95%CI(0.61,0.85)〕,灵敏度为57.7%(15/26),特异度为90.0%(27/30),阳性预测值为68.2%(15/22),阴性预测值为79.4%(27/34),正确率为75.0%(42/56)。ADCratio评价T降期最佳截断值>0.59时,ROC曲线下面积为0.682〔95%CI(0.54,0.80)〕,灵敏度为46.2%(12/26),特异度为90.0%(27/30),阳性预测值为63.2%(12/19),阴性预测值为73.0%(27/37),正确率为69.6%(39/56)(见图1)。
2.4 典型病例 患者,女,36岁,经新辅助CRT后获得pCR。治疗前肿块侵犯整个肠圈,肠壁毛糙伴周围条索影,局限于中位直肠系膜内,中低位直肠无浆膜被覆,未侵及浆膜层。治疗前分期为T3期,经新辅助CRT治疗后,肠壁周围仍有条索影,无法区分是肿瘤外侵还是治疗后纤维结缔组织形成,术后病理提示为pCR。因此通过MRI来定量评价疗效。CRT治疗前T2WI及ADC(见图2A、2B),CRT治疗后T2WI及ADC(见图 2 C、2 D),ADCpre为 0.93×10-3mm2/s,而 ADCpost为1.24×10-3mm2/s,ADC升高的比值具有统计学差异(t=3.104,p<0.001)。
3 讨论
目前,临床医生主要通过计算机断层扫描(CT)、MRI或正电子发射计算机断层显像(PET-CT)判断肿瘤大小来评估疗效[9]。以形态学和大小改变作为评判标准去鉴别缓解组与非缓解组的准确度并不高,因为这些标准无法检测出较小的病灶或肿瘤残余[10]。有研究发现,CRT后DWI在鉴别pCR与肿瘤残余方面较传统形态学MRI具有更高的诊断价值,在DWI图像上,残余肿瘤较易识别且表现为高信号,而周围非肿瘤组织为低信号[11-12]。DWI可以显示出微观结构状态,有研究者认为DWI可以在肿瘤学领域作为预测疗效反应的生物学指标[13-14]。DWI可以描述为水分子的随机性布朗运动,反映微观结构的状态,水分子在这些微观结构中弥散状态的改变可以用ADC来表示[13]。ADC与组织细胞结构呈负相关,并且在区别肿瘤残余与炎性或坏死上具有较高的特异度[12,15-16],这使得DWI十分适合CRT后的疗效评估。

图 1 新辅助放化疗前后ADC参数评价各标准的ROC曲线Figure 1 ROC curves of ADC parameters for the diagnosis of pCR, TRG and T-downstaging in LARC patients before and after neoadjuvant CRT
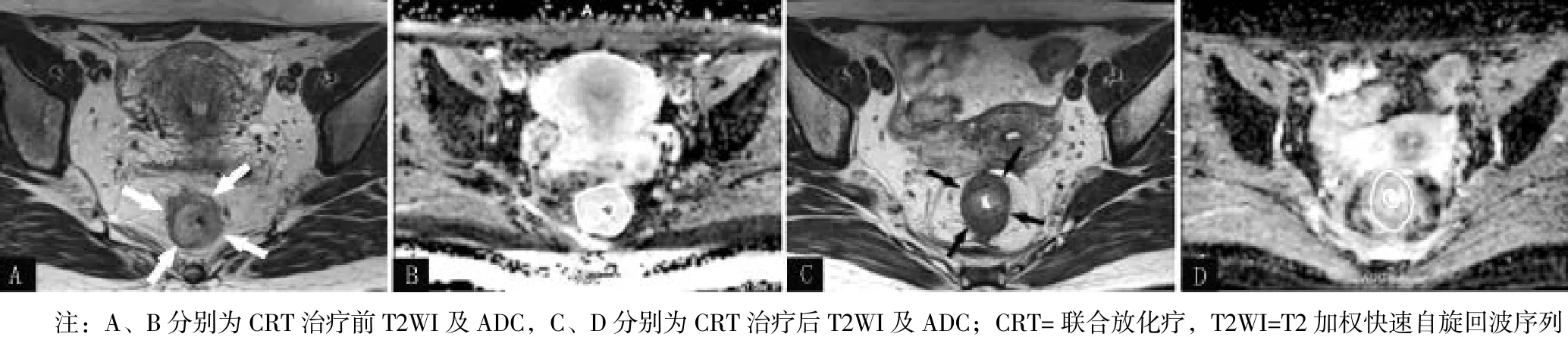
图 2 CRT治疗前后T2WI及ADCFigure 2 T2WI and ADC images of a 36-year-old female LARC patient before and after neoadjuvant CRT
本研究通过评价ADC改变判断局部进展期直肠癌患者新辅助CRT后是否达到pCR。本研究结果显示,TRG缓解组、TRG非缓解组ADCpre无差异,与DEVRIES等[17]的结果相似,缓解组治疗前ADC均值〔(0.65±0.20)×10-3mm2/s〕与非缓解组〔(0.66±0.17)×10-3mm2/s〕无统计学差异(P=0.825)。HEO等[18]的研究结果显示ADCpre与TRG无统计学差异。但是,DZIK-JURASZ等[19]认为局部进展期直肠癌治疗前ADC在缓解者(n=7)中似乎要比非缓解者低(n=7)。本研究结果显示,T降期组、T非降期组ADCpre无差异。然而,SUN等[20]认为治疗前T降期患者ADC值〔(1.07±0.13)×10-3mm2/s〕明显低于非T降期患者〔(1.19±0.15)×10-3mm2/s〕(P=0.013)。这些结果差异可能归因于以下因素:(1)缓解的评判标准不同,DZIK-JURASZ等[19]使用肿瘤大小作为评价标准,当体积缩小50%时表示缓解。SUN等[20]使用T降期来定义缓解组。此外,DEVRIES等[17]按照ypT0-2定义缓解组。有许多学者认为肿瘤体积缩小的截断值其实并不可靠[9-10,21],并且认为是否为T降期与CRT治疗前的MRI分期的准确度相关。因此,本研究采用了pCR、TRG及肿瘤降期三种疗效评价标准判断ADC是否均可以预测三者情况。pCR可以客观地反映患者病灶退缩、有无肿瘤残存情况,而TRG缓解组及T降期组中,仍有部分患者可以有少量肿瘤残存(如TRG1,T3~4期降至T1~2期患者)。(2)上述这些研究的样本量较小,并且缓解组的例数也不多,而本研究较前扩大了样本量,56例(pCR=14,non-pCR=52)。(3)DWI序列所采用的b值不同,本研究采用了4个b值(0、700、1 400、2 100 s/mm2)。(4)肿瘤ROI的画取有差别,本研究采用提取整个肿瘤ROI的方法,客观地反映整个肿瘤的信息。PATTERSON等[22]对治疗前ADC预测治疗结果进行了综述,采用五分法(轻度、中度、非常、坚信、明确)基于回顾性分析大量文献来判定结果的可靠程度,并认为结果中度可靠。尽管有研究认为治疗前ADC可作为潜在的生物定量指标来区分T降期组与T非降期组[20],但是,ADCpre似乎仍具有很多局限性,尤其是当关注点为pCR时。并且,CRT治疗前ADC也不能很好的区别非缓解组中的明显缓解组与轻度缓解组。因此,仅依靠治疗前ADC来评价疗效,作为是否对患者进行个体化治疗的证据并不充分。本研究结果显示,TRG缓解组ADCpost高于TRG非缓解组,并且结果与KIM等[12]的研究结果相似,缓解组ADCpost〔(1.62±0.36)×10-3mm2/s〕明显高于非缓解组〔(1.04±0.24)×10-3mm2/s〕(p<0.000 1),缓解组中ADCpost的截断值为1.20×10-3mm2/s时,正确率为85%。本研究结果显示,在评价pCR时,ADCpost截断值>1.17×10-3mm2/s时,正确率为73.2%;在评价TRG时,ADCpost的截断值>1.20×10-3mm2/s时,正确率为76.8%;评价T降期时,ADCpost的截断值>1.23×10-3mm2/s时,正确率为75.0%;与ABDEL RAZEK等[16]的研究相似,通过这样的截断值区别出头颈部肿瘤放疗后的纤维化与肿瘤残余。当ADCpost截断值>1.17×10-3mm2/s时,可以获得较高的阴性预测值(96.6%),有助于选择出非pCR患者,从而决定下一步是否行手术治疗,而非保守策略。然而,此截断值获得的阳性预测值为48.1%(13/27),认为原因可能是病理缓解组与非pCR组的ADC值有相当一部分的重叠。因此鉴别pCR仍是一项挑战。尽管ADC可以作为潜在的生物标志物来预测疗效,但是其仍然需面对着如何区别肿瘤残余与纤维灶的困扰[12]。
本研究结果显示,TRG缓解组与TRG非缓解组ADCratio有差异。在pCR组中,当ADC升高比值大于43%时,正确率为75.0%(42/56),与SUN等[20]的研究相一致,他们还发现ADC升高比值也可以很好的鉴别T降期组与非降期组(p<0.001)。PATTERSON等[22]综述了ADC改变率在预测某些肿瘤的临床结果上具有中度可靠的价值。
ADC可作为潜在的生物标志物,并且ADCpost及ADCratio在预测及评价局部进展期结直肠癌患者新辅助CRT后的疗效中具有较高的诊断效能,尤其在鉴别pCR上,并可以有效的区别TRG缓解情况。
作者贡献:胡飞翔进行文章的构思与设计,文章的可行性分析,文献及资料的收集、整理并撰写论文;张换、汤伟进行论文的修订,英文的修订;彭卫军、童彤负责文章的质量控制及审校,对文章整体负责。
本文无利益冲突。
本研究局限性:
(1)采用均值的方式描述ADC值,可能会忽略部分肿瘤的异质性,但采取这种算法的优势是简便易统计,直方图分析可能更有利于评估肿瘤的异质性,将在后期研究中加入直方图分析。(2)总样本量仍然较少,pCR的患者也相对较少。(3)研究并没有做读者间一致性检验,尝试在两位经验丰富的影像科医生共同测量下是否能够获得更佳的数据结果。(4)只评估CRT前后的ADC参数,并且将第二次检查尽可能地接近手术日期,以期可以最接近术后的病理状态,而未将更多的时间节点纳入研究,还需要评估不同治疗时间的情况,以获得预测pCR的最佳时间节点。
[1]HUGHES R,GLYNNE-JONES R, GRAINGER J,et al.Can pathological complete response in the primary tumour followingpreoperative pelvic chemoradiotherapy for T3-T4 rectal cancerpredict for sterilisation of pelvic lymph nodes, a low risk of local recurrence and the appropriateness of local excision?[J].Int J Colorectal Dis,2006,21(1):11-17.DOI: 10.1007/s00384-005-0749-y.
[2]STIPA F,CHESSIN D B,SHIA J,et al.A pathologic complete response of rectal cancer to preoperative combined-modality therapy results in improved oncological outcome compared with those who achieve no downstaging on the basis of preoperative endorectal ultrasonography[J].Ann Surg Oncol,2006,13(8):1047-1053.DOI:10.1245/ASO.2006.03.053.
[3]TURAL D,SELCUKBIRICIK F,YILDIZ O,et al.Preoperative versus postoperative chemoradiotherapy in stage T3, N0 rectal cancer[J].Int J Clin Oncol,2014,19(5):889-896.DOI: 10.1007/s10147-013-0636-4.
[4]HABR-GAMA A,PEREZ R O,NADALIN W,et al.Long-term results ofpreoperative chemoradiation for distal rectal cancer correlation between final stage and survival[J].J Gastrointest Surg,2005,9(1):90-99;discussion99-101.DOI: 10.1016/j.gassur.2004.10.010.
[5]VALENTINI V,COCO C,CELLINI N,et al.Ten years of preoperative chemoradiation for extraperitoneal T3 rectal cancer: acute toxicity,tumor response, and sphincter preservation in three consecutive studies[J].Int J Radiat Oncol Biol Phys,2001,51(2):371-383.
[6]HABR-GAMA A,PEREZ R O,NADALIN W,et al.Operative versus nonoperative treatment for stage 0 distal rectal cancer following chemoradiation therapy: long-term results[J].Ann Surg,2004,240(4):711-717;discussion 717-718.DOI:10.1097/01.sla.0000141194.27992.32.
[7]EDGE S B,COMPTON C C.The American Joint Committee on Cancer:the 7th edition of the AJCC cancer staging manual and the future of TNM[J].Ann Surg Oncol,2010,17(6):1471-1474.DOI: 10.1245/s10434-010-0985-4.
[8]RYAN R,GIBBONS D,HYLAND J M,et al.Pathological response following long-course neoadjuvant chemoradiotherapy for locally advanced rectal cancer[J].Histopathology,2005,47(2):141-146.DOI:10.1111/j.1365-2559.2005.02176.x.
[9]DENECKE T,RAU B,HOFFMANN K T,et al.Comparison of CT,MRI and FDG-PET in response prediction of patients with locally advanced rectal cancer after multimodal preoperative therapy: is there a benefit in using functional imaging?[J].Eur Radiol,2005,15(8):1658-1666.DOI: 10.1007/s00330-005-2658-4.
[10]BARBARO B,FIORUCCI C,TEBALA C,et al.Locally advanced rectal cancer: MR imaging in prediction of response after preoperative chemotherapy and radiation therapy[J].Radiology,2009,250(3):730-739.DOI: 10.1148/radiol.2503080310.
[11]LAMBREGTS D M, VANDECAVEYE V,BARBARO B,et al.Diffusionweighted MRI for selection of complete responders after chemoradiation for locally advanced rectal cancer:a multicenter study[J].Ann Surg Oncol,2011,18(8):2224-2231.DOI:10.1245/s10434-011-1607-5.
[12]KIM S H,LEE J M,HONG S H,et al.Locally advanced rectal cancer:added value of diffusion-weighted MR imaging in the evaluation of tumor response to neoadjuvant chemo- and radiation therapy[J].Radiology,2009,253(1):116-125.DOI: 10.1148/radiol.2532090027.
[13]PADHANI A R,LIU G,KOH D M,et al.Diffusion-weighted magnetic resonance imaging as a cancer biomarker: consensus and recommendations[J].Neoplasia,2009,11(2):102-125.DOI: 10.1593/neo.81328.
[14]KOH D M, COLLINS D J.Diffusion-weighted MRI in the body:applications and challenges in oncology[J].AJR Am J Roentgen ol,2007,188(6):1622-1635.DOI: 10.2214/AJR.06.1403.
[15]VANDECAVEYE V,De KEYZER F,NUYTS S,et al.Detection of head and neck squamous cell carcinoma with diffusion weighted MRI after (chemo)radiotherapy: correlation between radiologic and histopathologic findings[J].Int J Radiat Oncol Biol Phys,2007,67(4):960-971.DOI: 10.1016/j.ijrobp.2006.09.020.
[16]ABDEL RAZEK A A, KANDEEL A Y, SOLIMAN N, et al.Role of diffusion-weighted echo-planar MR imaging in differentiation of residual or recurrent head and neck tumors and posttreatment changes[J].AJNR Am J Neuroradiol,2007,28(6):1146-1152.DOI:10.3174/ajnr.A0491.
[17]DEVRIES A F,KREMSER C,HEIN P A,et al.Tumor microcirculation and diffusion predict therapy outcome for primary rectal carcinoma[J].Int J Radiat Oncol Biol Phys,2003,56(4):958-965.
[18]HEO S,JEONG S,YOUNG J,et al.A comparative study of histopathologic parameters and apparent diffusion coefficient values on 3T rectal MRI in locally advanced rectal cancer following neoadjuvant chemoradiation therapy (abstr)[C]//European Congress of Radiology (ECR) Annual Meeting Program.Vienna,Austria:2010.
[19]DZIK-JURASZ A,DOMENIG C,GEORGE M,et al.Diffusion MRI for prediction of response of rectal cancer to chemoradiation[J].Lancet,2002,360(9329):307-308.DOI:10.1016/S0140-6736(02)09520-X.
[20]SUN Y S,ZHANG X P,TANG L,et al.Locally advanced rectal carcinoma treated with preoperative chemotherapy and radiation therapy: preliminary analysis of diffusion-weighted MR imaging for early detection of tumor histopathologic downstaging[J].Radiology,2010,254(1):170-178.DOI: 10.1148/radiol.2541082230.
[21]DRESEN R C,BEETS G L,RUTTEN H J,et al.Locally advanced rectal cancer: MR imaging for restaging after neoadjuvant radiation therapy with concomitant chemotherapy. Part I. Are we able to predict tumor confined to the rectal wall?[J].Radiology,2009,252(1):71-80.DOI: 10.1148/radiol.2521081200.
[22]PATTERSON D M,PADHANI A R,COLLINS D J.Technology insight: water diffusion MRI--a potential new biomarker of response to cancer therapy[J].Nat Clin Pract Oncol, 2008,5(4):220-233.DOI: 10.1038/ncponc1073.

