ROC曲线在河源市新生儿G6PD缺乏症筛查截断值中的应用
刘运华 吴坤 刘晓燕
大多数葡萄糖-6-磷酸脱氢酶(Glucose-6-Phosphate Dehydrogenase Deficiency,G6PD)缺乏症终生无症状,而感染等促发因素作用下或者在伯氨喹、拉布立酶等药物使用下,会导致严重急性溶血性贫血和黄疸[1]。研究发现,新生儿黄疸患者中G6PD 缺乏症的优势比(Odds Ratio)为8.01[2],及早发现和治疗能够有效避免和减少输血治疗。
按《新生儿疾病筛查技术规范(2010年版)》[3]和《新生儿疾病筛查管理办法》[4]要求,用荧光免疫分析法测G6PD 活性进行筛查。G6PD 活性受基因调控,研究表明G6PD 缺乏症有遗传异质性,发现200 多种G6PD 基因突变位点[5]。G6PD 的活性和稳定性与突变位点密切相关[6]。因不同种族、地域G6PD 基因突变频率不同及实验环境等多方面的差异,需建立实验室的截断值。用ROC 曲线法建立河源地区新生儿G6PD 缺乏症筛查截断值,为当地出生人群G6PD 防控策略提供依据。
1 材料与方法
1.1 标本
标本均在家属同意条件下采集。检测2015年1月至2020年12月在辖区内分娩的新生儿干血斑,共213 261 例,男性113 842 例,女 性99 419例。按《新生儿疾病筛查技术规范(2010年版)》[3]要求,纳入标准:充分哺乳条件下,于分娩后3~7 天(早产儿、极低体重儿等可延迟至20 天)采血,至少3 个血斑,且每个血斑直径大于8 毫米,血滴自然渗透,滤纸正反面血斑一致,无污染。常温下平放晾干,应避免紫外线或阳光照射,信息完整。排除标准:血斑过小,血滴未渗透,有污染,溶血,信息不完整等。研究经医院伦理委员会批准同意开展。
1.2 试剂与仪器
G6PD 测定试剂盒(荧光法,6199860,芬兰雷勃诊断试剂有限公司,960T/盒)、G6PD 测定试剂盒(比值法,20152400813,科方生物技术股份有限公司,A 液:5 mL/盒,B 液:5 mL/盒)、G6PD 基因突变检测试剂盒(20071501,厦门致善生物科技股份有限公司,48T/盒)。Fluoroskan Ascent 荧光读数仪(Thermo,美国)、iEMS 恒温孵育振荡器(Thermo,美国)、ANI Labsystems Woodpecker 打孔仪(Thermo,美国)、日立7180 全自动生化分析仪(HITACHI,日本)、核酸提取仪Lab-Aid 824(致善,中国)、实时荧光PCR 仪CFX96(伯乐,美国)。
1.3 筛查方法
按说明书操作,以中、低值的质控品作为质量控制,每年参与并通过国家临床检验中心室间质量评价。结果判断:以说明书推荐的截断值(≤3.00 U/gHb)或暂行截断值(≤4.50 U/gHb),如G6PD活性≤3.00 或4.50 U/gHb 为筛查阳性;如G6PD 活性>3.00 或4.50 U/gHb 为筛查阴性。按《新生儿疾病筛查管理办法》[4]召回管理制度,非本院分娩的筛查阳性新生儿由采血单位召回验证。
1.4 验证方法
取枸橼酸抗凝血2 mL,以G6PD/6PGD 比值法进行验证。验证结果判断:新生儿(年龄≤28 d),比值>1.1,判为阴性,1.05≤比值≤1.10 为可疑阳性,建议复查,比值<1.05,判为阳性;非新生儿(年龄>28 d),比值>1.0,判为阴性,0.95≤比值≤1.00 为可疑阳性,建议复查,比值<0.95,判为阳性。
1.5 G6PD 基因突变检测
取EDTA 抗凝血2 mL,用荧光PCR 熔解曲线法测中国人群常见12 种突变点:c.517T>C、c.392G>T、c.487G>A、c.592C>T、c.95A>G、c.871G>A、c.1004C>A、c.1024C>T、c.1360C>T、c.1376G>T、c.383T>C 和c.1388G>A。
1.6 统计学分析
用SPSS 19.0 软件进行分析;计数资料用n(%)表示,用χ2检验;计量资料用()表示,组间比较用独立样本t检验;筛查截断值用ROC 曲线,用MedCalc 软件制作受试者工作特征曲线;P<0.05 表示差异有统计学意义。
2 结果
2.1 G6PD 缺乏症筛查截断值的建立
在男性和女性组中,G6PD 缺乏症分别占21.00%(1548/7373)、25.04%(335/1338),ROC 曲线下面积分别为0.995(标准误为0.001,95%CI:0.993~0.997,U=367.727,P<0.001)、0.983(标 准误 为0.0002,95%CI:0.974~0.989,U=174.302,P<0.001),对应男、女性的截断值均为4.42 U/gHb。见图1。

图1 G6PD 活性ROC 曲线Figure 1 ROC Curve for G6PD Activity
2.2 不同G6PD 截断值的相关指标评价
对说明书推荐的截断值(3.00 U/gHb)、暂行截断值(4.50 U/gHb)、ROC 曲线推荐的截断值(4.42 U/gHb)进行分析,不同截断值在不同性别中的相关评价指标。见表1、表2。
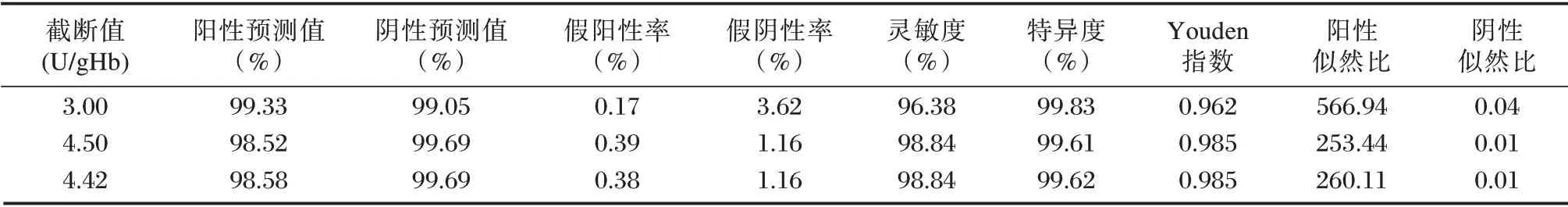
表1 男性新生儿不同G6PD 截断值的相关指标评价Table 1 Evaluation of relevant indicators of different G6PD cut-off values in male newborns

表2 女性新生儿不同G6PD 截断值的相关指标评价Table 2 Evaluation of relevant indicators of different G6PD cut-off values in female newborns
2.3 部分新生儿G6PD 基因突变情况
随机选取14 名男性与27 名女性新生儿行G6PD 基因检测,结果:在男性组,11 名未发现突变位点,3 名半合子突变,突变位点分别为c.1376G>T、c.95A>G、c.871G>A。在女性组,4 名未发现突变位点,1 名双杂合子突变(c.1024C>T 合 并c.1376G>T),22 名杂合子突变:突变位点依次为9例c.1376G>T、6 例c.1388G>A、2 例c.95A>G、1 例c.871G>A、1 例c.392G>T、1 例c.517T>C、1 例c.519C>T、1 例c.592C>T。选择女性新生儿的G6PD 突变基因与G6PD 活性和G6PD/6PGD 比值均进行相关性分析,21 例G6PD 杂合突变新生儿G6PD 活性大于3.00 U/gHb,其中8 例G6PD/6PGD比值<1.05 为G6PD 缺乏症者,13 例G6PD/6PGD 比值≥1.05。见图2。
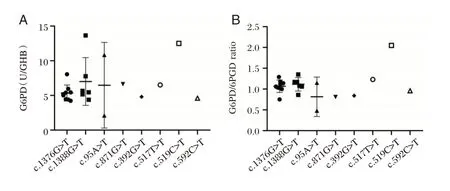
图2 41 例新生儿G6PD 突变基因分析Figure 2 Analysis of G6PD mutation gene in 41 newborns
2.4 不同截断值G6PD 缺乏症筛查情况
截断值由3.00 U/gHb 升至4.50 U/gHb,女性阳性率明显升高,男性升高不明显,见表3。
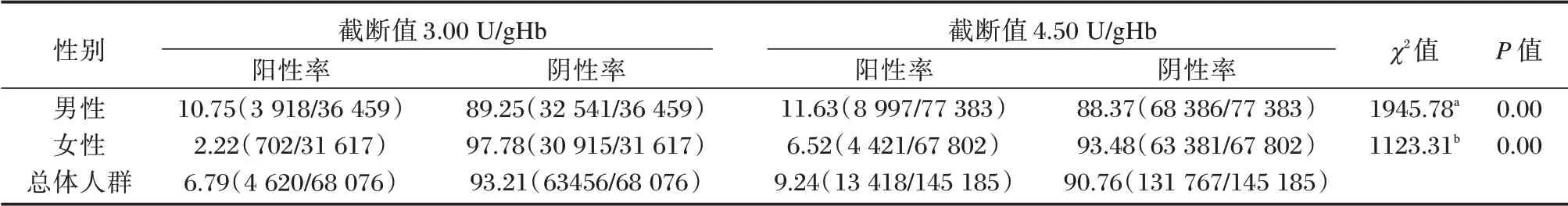
表3 不同截断值G6PD 缺乏症筛查结果[n(%)]Table 3 Screening results for G6PD deficiency at different cut-off values[n(%)]
2.5 不同截断值G6PD 缺乏症筛查阳性确诊情况
截断值为3.00 U/gHb 时,本院标本筛查总阳性率为6.66%(1 171/17 575),男性为10.59%(1 019/9 625),女性为1.91%(152/7950)。截断值为4.50 U/gHb 时,本院标本筛查总阳性率为8.89%(3 669/41 251),男性为11.61%(2 587/22 285),女性为5.70%(1 082/18 966)。截断值为3.00 U/gHb 与4.50 U/gHb 时确诊情况如表4。由截断值为3.00 U/gHb、4.50 U/gHb 时可推算河源新生儿G6PD 缺乏症总体发生率分别为6.57%、8.84%。
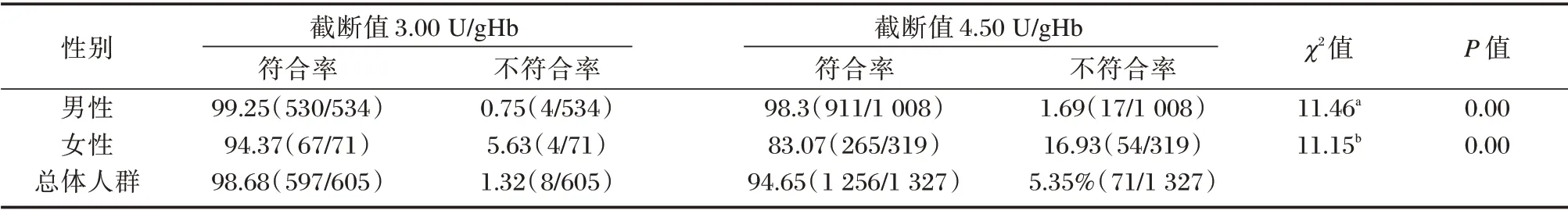
表4 不同截断值缺乏症初筛阳性新生儿确诊情况[n(%)]Table 4 Confirmation of newborns with positive primary screening for deficiency at different cut-off values[n(%)]
2.6 河源地区新生儿G6PD 活性分布情况
113 842 例男性和99 419 例女性新生儿G6PD活性均属正偏态性分布,见图3。男性组,1%、5%、10%分位数值分别为0.21 U/gHb、0.62 U/gHb、2.00 U/gHb,均值为8.06 U/gHb,标准差为3.49 U/gHb;女性组,1%、5%、10%分位数值分别为1.02 U/gHb、4.01 U/gHb、4.91 U/gHb,均值为8.34 U/gHb,标准差为2.88 U/gHb。截断值由3.00 U/gHb 升至4.50 U/gHb 时,男女可分别新增917、3 791 名 可 疑G6PD 缺乏症。
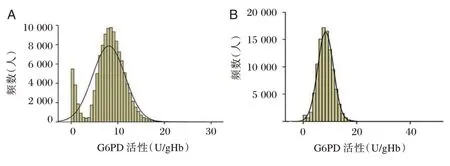
图3 新生儿G6PD 活性分布Figure 3 Distribution of G6PD activity in newborns
3 讨论
筛查截断值选择有三种方式,一是根据试剂盒截断值来判读结果[7],二是参考G6PD 缺乏症新生儿筛查诊断和治疗专家共识[8],三是根据当地情况,建立截断值。尽管国内有将百分位数法作为制定筛查截断值的研究,但其无法具体表达敏感度和特异度两者间的关系,仅适用于建立医学参考范围。ROC 曲线通过动态改变G6PD 活性的截断值,获得对应灵敏度与特异度,较百分位数法更能展示任意截断值时对疾病的识别能力。ROC 曲线的截断值为4.42 U/gHb,男性和女性ROC 曲线下面积分别为0.995、0.983。一般认为ROC 曲线下面积大于0.9 时诊断准确性较好。研究发现,以说明书推荐的3.00 U/gHb 为截断值,可大大减少召回数量,减轻家长经济负担,但会大幅增加假阴性,让G6PD 缺乏症新生儿错过最佳治疗时期,造成严重后果。综合各评价指标,实验室仍用4.50 U/gHb 作为G6PD 缺乏症筛查截断值。
为验证截断值的科学性,随机选取14 名男性与27 名女性新生儿行G6PD 基因检测,研究发现,不同基因突变会导致不同水平的G6PD 活性下降,与以往研究一致,女性杂合子G6PD 活性范围波动较大[9]。部分携带G6PD 突变基因的女性,其G6PD 活性为3.00~4.50 U/gHb,按3.00 U/gHb 作为截断值,将会漏诊。男性组未发现G6PD 活性为3.00~4.50 U/gHb 的半合子新生儿,其原因可能是标本量少。此外发现c.1376G>T、c.1388G>A、c.95A>G 是3 种主要基因突变类型,与全国其它地区一致[10]。
河源地区出生人群G6PD 缺乏症阳性率高于同为粤北地区的梅州市5.18%[11]、清远市7.94%[12]、韶关市5.19%[13],结论同以往研究一致[14-15]。男性G6PD 缺乏症比女性更易受累,主要临床表现一般在半合子男性和纯合子女性中被注意到[16],而一些杂合女性因临床表现轻而拒绝召回。
研究收集部分新生儿数据绘制ROC 曲线,建立的G6PD 筛查截断值需在临床实践中不断进行验证,定期重新评估。研究发现,常规G6PD 酶测定法易漏诊杂合子女性,了解女性G6PD 基因的杂合子状态将有助避免杂合子女性成为氧化应激食物和药物的受害者[17]。近年来,有研究人员设置不同G6PD 活性的截断值,以区分正常、杂合基因突变个体[18],丰富了常规G6PD 酶测定法的意义。
建立河源地区G6PD 筛查截断值,有助于提高本地G6PD 缺乏症检出率,减少和预防G6PD 缺乏引起的系列疾病发生。

