肛肠科外用凝胶剂的制备及其体外透皮性能考察
庞晓晨,成睿珍,赵静
肛洗二号是一种熏洗汤剂,是天津市滨海新区中医医院肛肠科使用多年的临床经验方,由黄柏、槐花、苦参、白蔹、五倍子等十余种中药组成,临床常用于治疗湿热瘀阻型混合痔术后的水肿及疼痛,具有清热解毒、消肿止痛的功效[1-2]。尽管此方临床应用广泛,但该剂型存在使用不方便、剂量不准确等缺点,为了克服上述不足,将传统剂型改为外用凝胶剂。外用凝胶剂不但具有使用方便、黏性好、刺激性小等特点,而且提高了药物维持时间,方便局部给药[3]。凝胶剂中的药物经皮肤吸收后,可在作用部位直接发挥药效,避免了因胃肠道吸收而产生不良反应,且凝胶剂易于涂展和洗除,能吸收组织渗出液,不妨碍皮肤正常功能,有利于药物吸收[4-6]。本研究在肛洗二号原方的基础上,从中医整体观念出发,采用现代中药制剂的开发研究方法,对其制备工艺进行优化研究,并通过改良扩散池法,对制剂的透皮性能进行考察,为保障和提高凝胶剂质量以及该制剂的进一步研究和临床应用提供科学依据。
1 材料与方法
1.1 仪器与试药
1.1.1 仪器 美国Waters超高效液相色谱系统(配有四元高压梯度泵、在线真空脱气装置、自动进样器、柱温箱、TUV检测器、Empower 色谱工作站);十万分之一分析天平(XP205,Mettler Toledo公司);万分之一电子天平(EN 1434,上海民桥精密科学仪器有限公司);电热套(北京中兴伟业仪器有限公司);高速离心机(Sorvall ST 16R,德国Thermo Fisher公司);Milli-Q型超纯水制备仪(美国Millipore公司)。
1.1.2 试剂与药物 卡波姆® (Noveu,USA);乙腈(色谱纯,Fisher Scientific公司);甲酸为色谱纯芦丁对照品(批号100080-201409),购自中国食品药品生物制品检定所;中药饮片(购自天津市中药饮片厂有限公司和北京盛世龙药业有限公司,均符合相关规定[7])。
2 制备方法
本研究时间为2016年9—11月。
2.1 肛肠外用凝胶剂的制备 分别选取浓度为0.5%、1.0%、1.5%、2.0%、2.5%的卡波姆为基质制备成水溶性凝胶剂。以外观性状、离心实验、耐热耐寒实验为指标,筛选最佳浓度的基质。
2.1.1 外观性状及评分标准 外观:黄色或黄褐色半固体、质地均匀、无分层现象;涂展性:易于涂展于皮肤或黏膜上;细腻度:均匀,涂布于手上无粗粒存在,在玻璃板上涂布薄薄一层时无肉眼可见的单独颗粒或气泡。评分标准:无分层现象、稠度适中、细腻光滑易涂展、保湿效果好为10分,部分分层、稠度较合适、稍有颗粒感易涂展、保湿效果一般为5分,完全分层、稠度过稠、有颗粒感不易涂展、保湿效果不好为0分。以不同浓度的卡波姆制成的凝胶基质外观形状评分见表1。
2.1.2 离心实验及评分标准 将制备好的凝胶剂置于10 ml离心管中,3 000 r/min离心30 min(离心半径10 cm),观察有无分层现象。评分标准:无分层现象为20分,部分分层为10分,完全分层为0分。以不同浓度的卡波姆制成的凝胶基质离心试验评分见表1。
2.1.3 耐热耐寒实验及评分标准 将制备好的凝胶剂分别置于-15 ℃冷冻箱24 h、55 ℃恒温干燥箱6 h后取出,将置于冷冻箱的基质水浴加热复融,分别观察有无分层现象。评分标准:无分层为10分,部分分层为5分,完全分层为0分。以不同浓度的卡波姆制成的凝胶基质耐热耐寒实验评分见表1。
2.1.4 最佳浓度基质筛选 卡波姆浓度为0.5%和1.0%时凝胶基质为液体,能够流动,不适合作为凝胶基质;而卡波姆浓度为2.0%时凝胶基质则略显黏稠,卡波姆浓度为1.5%时制剂评分最高。
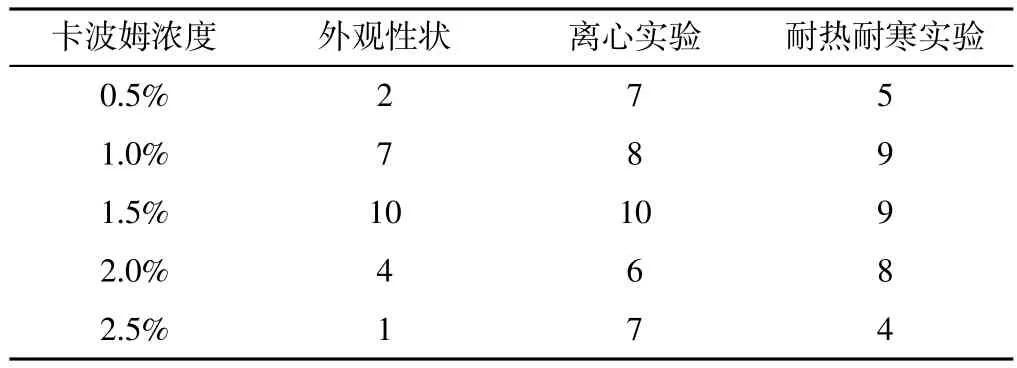
表1 不同浓度卡波姆为基质时凝胶剂的评分(分)Table 1 Scores of the formulation with different concentrations of carbomer
考虑到处方所用部位及涂布的困难程度,本研究最终选用1.5%作为处方的基质浓度。
2.2 体外透皮色谱条件 色谱柱ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm);流动相:A 0.1%甲酸水溶液,B乙腈溶液;梯度洗脱:0~6 min,15% B;6~7 min,15%B~25% B;7~8 min,25% B;流速0.3 ml/min;检测波长:260 nm;柱温:30 ℃;进样量:2 μl。
2.3 对照品、供试品溶液的制备 对照品溶液:精密称取适量芦丁,用甲醇溶解并稀释至刻度,制成每1 ml含有4 100 ng芦丁的对照品溶液。供试品溶液:称取一定量凝胶剂于50 ml量瓶中,加入甲醇超声溶解,溶解后甲醇定容,取出部分溶液于离心机内10 000 r/min离心10 min(离心半径10 cm),取上清液,经0.20 μm有机滤膜过滤,即得供试品溶液。
2.4 方法学考察
2.4.1 专属性 取对照品溶液、不加芦丁的空白溶出物以及凝胶剂的透皮溶出物,采用超高效液相色谱(UPLC)法进行分析,结果显示UPLC法对于本研究的专属性较好(见图1)。

图1 超高效液相色谱图Figure1 UPLC chromatogram
2.4.2 标准曲线制备 精密称取对照品溶液,配成含205、410、820、1 640、2 050、4 100 ng/ml芦丁的样品溶液。按照2.2中的色谱条件行UPLC分析,记录色谱峰面积(A)。以A为因变量(Y),以浓度(C)(ng/ml)为自变量(X)进行线性回归分析,绘制A与C的标准曲线。标准曲线方程为Y=14.282X+862.32(r=0.999 9),线性范围为205~4 100 ng/ml。
2.4.3 精密度实验 精密吸取含410、1 640、2 050 ng/ml芦丁的对照品溶液,连续进样5次,连续进样3 d,测定A,计算日内、日间精密度(RSD)。结果显示3种浓度的对照品溶液日内RSD分别为1.07%、1.19%、1.82%,日间RSD分别为0.33%、1.96%、0.45%,表明仪器RSD良好。
2.4.4 重复性实验 取凝胶剂适量,共6份,按2.3中的方法制备供试品溶液,进行含量测定。芦丁的平均浓度为(488.9±7.8)ng/ml,RSD为1.58%,表明供试品溶液的方法重复性良好。
2.4.5 加样回收率实验 精密称取已测定含量的样品溶液适量,共6份,分别精密加入一定量的对照品溶液,按2.3中的方法制备供试品溶液进样测定,计算加样回收率,结果显示,芦丁的平均回收率(n=6)为100.35%,RSD<2.00%(见表2)。

表2 透皮吸收加样回收率实验结果Table 2 Results of the recovery rats of transdermal absorption
2.5 体外透皮实验
2.5.1 离体鼠皮的制备 剃去大白鼠腹部绒毛,脱颈处死,剥离皮肤。小心剔除皮下的脂肪组织及粘连物至皮肤成半透明状;用0.9%氯化钠溶液反复冲洗干净,将破损处剪除,加入适量0.9%氯化钠溶液浸没鼠皮,密封放于冰箱(-20 ℃)中保存。
2.5.2 分组 分为制剂组和溶液组,制剂组使用自制的外用凝胶剂,溶液组使用肛洗二号提取后得到的复方汤剂。
2.5.3 体外透皮实验方法 采用改良Franz扩散池法,将离体鼠皮固定在改良Franz扩散池的供给池和接受池之间,角质层面向供给池,以新鲜配制的接受递质,预热(32±1)℃,在供给池中加入制剂,于循环水浴(32±1) ℃中连续磁力搅拌(约300 r/min)。在实验开始后分别于0.5、1.0、2.0、3.0、4.0、5.0、6.0、8.0、10.0、12.0 h从接受池中取出2 ml接收递质,同时向接受池中补加等量的供给液。样品经0.22 μm微孔滤膜过滤后,UPLC法测定C,并以此计算累积渗透量(Q)、表观渗透系数(Papp)及稳态流量(Jss)。
2.5.4 数据处理 采用UPLC法测定样品含量,计算单位面积内药物Q(μg/cm2),以Q对t/h做图,得药物累积渗透曲线。对所得曲线的直线部分进行回归分析,斜率即为药物的Jss(μg·cm-2·h-1)。

其中Cn为t时间药物的测定浓度,Ci为t时间前的测定浓度,V0为接受池中溶液体积,V为取样体积。

其中C0为供给池初始药物浓度;A为有效透过面积;ΔQ/Δt可由累积透过量-时间曲线稳态部分的斜率求得。Jss= C0·Papp
2.5.5 体外透皮实验结果 将样品各时间点渗透量的均数与时间的关系,分别采用零级动力学、一级动力学、Higuchi方程、Ritger-Peppas方程4种数学模型进行拟合,分析其体外渗透性。溶液组和制剂组的透皮扩散均符合Higuchi方程,说明二者均有缓释的作用。溶液组的渗透动力学方程为Q=0.964 8t1/2+7.678,r2= 0.926 8,制剂组的渗透动力学方程为Q=2.171 1t1/2+6.993 7,r2= 0.995 6(见表 3)。
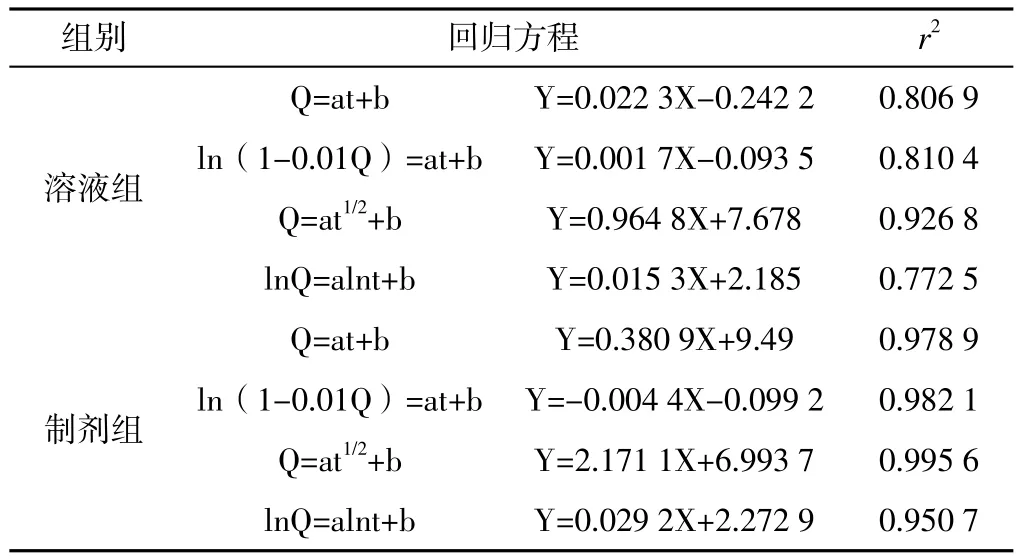
表3 体外透皮实验参数Table 3 Experimental parameters of in vitro transdermal experiments
从药物累积渗透曲线(见图2)可以看出,芦丁在皮肤中的渗透可维持24 h 以上的稳态释放速率。溶液组24 h内的Q 为(11.57±0.28)ng·cm-2·h-1,制剂组24 h 内的Q为(17.86±1.26)ng·cm-2·h-1,制剂组的Q是溶液组的1.54倍。溶液组的Papp和Jss分别为(12.43 ±1.26)cm/s 和(5.00 ±0.51)ng·cm-2·h-1,而制剂组的Papp和Jss分别为(26.29 ±3.49)cm/s和(12.70±1.68)ng·cm-2·h-1。两组Papp和Jss比较,差异有统计学意义(tPapp=0.001,p<0.01;tJss=0.001,p<0.01)。
3 讨论
3.1 外用凝胶剂的制备 水溶性凝胶剂是常用的透皮给药剂型,是指药物与形成凝胶的辅料溶解或分散在高分子材料中,形成的均一、混悬的黏稠液体或半固体制剂。本实验将传统剂型制备为外用凝胶剂,不但使其局部给药更加方便、减少了刺激性,而且避免了因胃肠道吸收而产生不良反应,延长了药物维持时间。
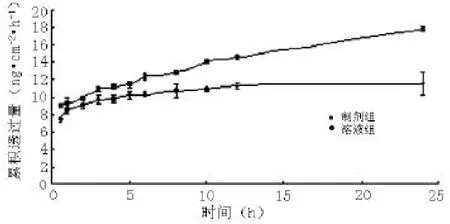
图2 药物累积渗透曲线(,n=5)Figure 2 Drug cumulative permeability curves
3.2 体外分析方法 本研究建立的体外分析方法不但分析速度快而且专属性较强、灵敏度高。在既往文献报道[8-9]的基础上,本研究结果显示,芦丁在260 nm有较好的吸收,因此,选取260 nm作为芦丁的最大吸收波长,以UPLC法作为分析方法,采用梯度洗脱,建立了体外透皮研究的含量测定方法。3.3 体外透皮实验 本研究结果显示,制剂组的Q是溶液组的1.54倍,且两组的Papp和Jss间有明显差异。说明与水溶液相比,凝胶制剂具有良好的经皮渗透性,能够显著增加单位面积的Q和Jss,有较好的透皮渗透性。
总之,本研究将传统剂型制备为外用凝胶剂,不但使其局部给药更加方便、减少了刺激性,而且避免了因胃肠道吸收而产生不良反应,延长了药物维持时间。且与水溶液相比,凝胶制剂具有良好的经皮渗透性,能够显著增加单位面积的Q、稳态透皮速率,说明凝胶剂能显著提高透皮渗透性。在今后的研究中,可以根据处方的特点,对促渗剂进行筛选,加入适合的促渗剂,以更好地提高凝胶剂的透皮效果。
作者贡献:庞晓晨进行文章的构思与设计,文献和资料的收集、整理,撰写论文;成睿珍进行论文的修订;赵静进行论文的审校,对文章整体负责,监督管理。
本文无利益冲突。
[1]庞晓晨,刘志东,黄瑞,等.多指标加权评分法优选肛洗二号凝胶剂的提取工艺[J].中国实验方剂学杂志,2016,22(16):31-34.DOI:10.13422/j.cnki.syfjx.2016160022.PANG X C,LIU Z D,HUANG R,et al.Optimization of extraction technology of Gangxi Ⅱ Gels by multi-index weighted scoring method[J].Chinese Journal of Experimental Traditional Medical Formulae,2016,22(16):31-34.DOI:10.13422/j.cnki.syfjx.2016160022.
[2]庞晓晨,成睿珍,李玥,等.肛洗二号中药复方熏洗剂的含量测定及其临床应用[J].中国中西医结合外科杂志,2017,23(5):527-531.PANG X C,CHENG R Z,LI Y,et al. Determination and clinical application of compound analgesic and smoked lotion for anal chinese[J]. Chinese Journal of Integrated Traditional and Western Medicine,2017,23(5):527-531.
[3]赵振宇,孙浩.微乳凝胶新制剂的研究进展[J].中国医院药 学 杂 志,2014,34(5):411-415.DOI:10.13286/j.cnki.chinhosppharmacyj.2014.05.23.ZHAO Z Y, SUN H.Research progress of novel on of microemulsion gels[J].Chinese Journal of Hospital Pharmacy, 2014,34(5):411-415.DOI:10.13286/j.cnki.chinhosppharmacyj.2014.05.23.
[4]杨秀丽,羊波,李承乐,等.紫杉醇纳米脂质体凝胶剂的制备及体外透皮研究[J].中国现代应用药学,2015,32(2):156-161.DOI:10.13748/j.cnki.issn1007-7693.2015.02.007.YANG X L, YANG B, LI C L,et al.Preparation and in vitro transdermal diffusion characteristics of paclitaxel nano-liposomes gels[J].Chin J Mod Appl Pharm,2015,32(2):156-161.DOI:10.13748/j.cnki.issn1007-7693.2015.02.007.
[5]CADDEO C,SALES O D,VALENTI D,et al.Inhibition of skin inflamation in mice by diclofenac in vesicular carriers: liposomes,ethosomes and PEVs[J].Int J Pharm,2013,443(1/2):128-136.DOI: 10.1016/j.ijpharm.2012.12.041.
[6]EL-NABARAWI M A,BENDAS E R,EL REHEM R T,et al.Transdermal drug delivery of paroxetine through lipid-vesicular formulation to augment its bioavailability[J]. Int J Pharm,2013,443(1/2):307-317.DOI:10.1016/j.ijpharm.2013.01.016.
[7]国家药典委员会.中华人民共和国药典:2015年版一部[S].北京:中国医药科技出版社,2015:305,354.
[8]田振坤,顾媛媛,宋成贵,等.HPLC测定凤仙透骨草中的芦丁、槲皮素和山奈酚的含量[J].中国实验方剂学杂志,2012,18(18):106-108.DOI:10.13422/j.cnki.syfjx.2012.18.044.TIAN Z K,GU Y Y,SONG C G,et al. Determination of content of eldrin,Quertetin and Kaempferol in impatiens balsamina by HPLC[J].Chinese Journal of Experimental Traditional Medical Formulae,2012,18(18):106-108.DOI:10.13422/j.cnki.syfjx.2012.18.044.
[9]阿吉姑·阿布都热西提,楚刚辉,木合塔尔·吐尔洪.高效液相色谱法同时测定玫瑰花口服液中没食子酸、芦丁、槲皮素和山奈素[J].分析科学学报,2013,29(5):738-740.AJIGU A,CHU G H,MUHETAER T.Simultaneous determination of four effective components in rose oral liquid by high performance liquid chromatograghy[J].Journal of Analytical Science,2013,29(5):738-740.

