襄麦冬多糖提取物体外抗氧化活性的光谱学分析
潘婉莲,杨佳娣,叶国栋,赵苗,余海忠
(湖北文理学院化学工程与食品科学学院,湖北襄阳441053)
襄麦冬(Liriope spicata var.prolifera),即湖北麦冬,又叫麦门冬,味甘、微苦,性微寒,常用于治疗肺燥干咳、虚劳咳嗽、津伤口渴、心烦失眠、内热消渴、肠燥便秘、咽白喉等症[1]。襄阳欧庙被誉为中国麦冬之乡,位居中国三大麦冬产地之首,单产高于川、杭麦冬,品质优,具有“白、干、净、匀、大”的特点。麦冬多糖是动物体中降血糖最主要的有效成分,可降低正常小鼠的血糖,同时对葡萄糖、肾上腺素、四氧嘧啶所导致的小鼠高血糖有明显的抑制作用[2]。已有学者完成了川麦冬、杭麦冬多糖的抗氧化性测试[3-5],但是鲜见关于襄麦冬多糖提取物抗氧化能力的报道。本研究采用α-脱氧核糖法、邻苯三酚自氧化法、DPPH法、ABTS法、亚油酸体系法及铁氰化钾还原法等方法,利用紫外-可见分光光度计对襄麦冬多糖提取物的体外抗氧化活性及还原能力进行评价,以期能为新的天然抗氧化剂的开发提供理论支持,也为襄麦冬多糖的综合利用提供一种新的思路。
1 材料与方法
1.1 材料
襄麦冬块根:采自湖北襄阳欧庙襄麦冬GAP基地。
1.2 仪器
UV-2500紫外-可见光分光光度计:日本岛津公司;JA5003B型电子分析天平:上海越平科学仪器有限公司;3K15型小型冷冻高速离心机:德国Sigma公司;Finnpipette移液枪:美国热电公司;FZ-102微型植物粉碎机:天津泰斯特公司;KH3200DB超声波清洗器:昆山禾创超声仪器有限公司;DKB-501A超级恒温水槽:上海精宏实验设备有限公司;G-1磁力搅拌器:巩义市予华仪器有限责任公司;RE-52AA旋转蒸发仪:上海亚荣生化仪器厂;GZX-9030-MBE电热恒温鼓风干燥箱:上海博讯实业有限公司医疗设备厂。
1.3 试剂
DPPH:美国 Sigma公司;乙醚、FeSO4、EDTA、α-脱氧核糖、磷酸、H2O2、三氯乙酸、硫代巴比妥酸、Tris-HCl、邻苯三酚、HCl、亚油酸、钨酸钠、甲醇、Tween-20、铁氰化钾:上海国药(集团)公司;生育酚:购自中国食品药品检定研究院。
1.4 襄麦冬多糖提取物的制备
将新鲜襄麦冬块根洗净沥干后60℃烘干至恒重,粉碎。称取100 g样品于烧杯中,加入4倍体积95%乙醇,搅拌,过滤,如此重复操作3次,使其充分脱脂,滤渣放入烘箱中烘干。然后,称取脱脂烘干后的样品80 g,按料液比1∶10(g/mL)加蒸馏水,80℃恒温水浴磁力搅拌2 h,提取2次,合并两次提取液进行离心,取上清液置透析袋中透析48 h后减压浓缩得浸膏,再用4倍体积95%乙醇对浸膏进行醇沉,产物依次经过无水乙醇、丙酮、乙醚洗涤后,真空干燥,获得襄麦冬多糖提取物[6]。制备的提取物分别用甲醇或乙醇梯度稀释成 6.25、12.5、25、50、100、150、200 mg/mL 样品溶液,备用。
1.5 襄麦冬多糖提取物体外抗氧化活性测定
1.5.1 对·OH清除活性的测定
采用α-脱氧核糖法[7],准确移取0.20 mL的FeSO4-EDTA混合液(10 mmol/L)于具塞试管中,加入 0.20 mL α-脱氧核糖溶液(10 mmol/L),然后各管再依次加入1 mL不同浓度的样品溶液、0.4 mL磷酸缓冲液(pH7.4,0.1mol/L)以及0.2mLH2O2(10mmol/L),混匀后将具塞试管置于37℃水浴恒温保持1 h;然后再加入1mL2.8%(质量比)三氯乙酸溶液和1.0mL 1.0%(质量比)硫代巴比妥酸溶液,迅速摇匀置沸水浴中加热10 min,冷水冷却后在532 nm处测定吸光值AS。不加襄麦冬多糖提取物,同上操作处理,测定其对比吸光值AC。不加襄麦冬多糖提取物且不在37℃水浴中反应,其它处理同上,测定空白吸光值A0,每个样品重复3次,按下式计算清除率:
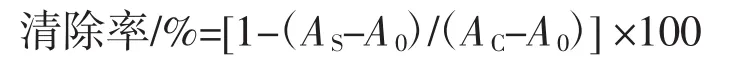
1.5.2 对·O2-清除活性的测定
采用邻苯三酚自氧化法[8],移取pH8.2的Tris-HCl缓冲液4.5 mL于具塞试管中,放入25℃水浴20 min,然后在各管分别加入0.4 mL不同浓度的样品溶液和0.1 mL 25℃保温的邻苯三酚溶液,混匀,25℃下准确反应4min,立即用10 mol/L HCl溶液2滴终止反应,在325 nm处测定吸光值。对照品以蒸馏水代替糖液,缓冲液加蒸馏水作为空白,每个样品重复3次,按下式计算清除率:

1.5.3 对DPPH自由基清除活性的测定
采用DPPH法[9],移取3.9 mL DPPH甲醇溶液(25 mg/mL)于不同的具塞试管中,分别加入0.1 mL不同浓度的样品溶液,混匀后,将试管放入暗处反应0.5 h后立刻取出,在515 nm波长处测定其吸光值A,空白用甲醇代替样品测得空白吸光值为A0,其它方法都一样。每个样品重复3次,按下式计算清除率:清除率/%=[(A0-A)/A0]×100。
1.5.4 对ABTS自由基清除活性的测定
采用ABTS法[10],移取7.4 mmol/L的ABTS溶液0.2 mL,加入2.6 mmol/L K2S2O8溶液 0.2 mL,混匀,在室温条件下放入黑暗区域12 h,再用95%的乙醇稀释40倍,此时在734 nm处测得吸光度值为0.7±0.02即可。取不同的具塞试管,分别加入0.8 mL上述溶液和0.2 mL不同浓度的样品溶液,剧烈振摇10s,静置6min后,立刻在734nm处测得其吸光值AS。空白用乙醇代替测得吸光值为A0,每个样品重复3次,按下式计算清除率:清除率/%=(1-AS/A0)×100。
1.5.5 抗脂质过氧化活性的测定
采用亚油酸体系法[11],称取0.29 g亚油酸和0.29 g Tween-20,再加50 mL 0.2 mol/L pH=7.5的KH2PO4-NaOH缓冲溶液。吸取不同浓度的样品溶液,移入试管中,加2 mL样油,37℃恒温水浴15 h,加6 mL 60%(体积比)甲醇溶液终止反应,在234 nm波长处测定吸光度。以空白作参比,每个样品重复3次,按下式计算其抗氧化活性:抗氧化活性/%=[(A空白-A样品)/A空白]×100。
1.5.6 还原能力的测定
采用铁氰化钾还原法[12],取不同浓度样品溶液于具塞试管中,加入2.5 mL pH 6.6的磷酸盐缓冲液(0.2 mol/L)及2.5 mL 1%铁氰化钾溶液混合,将混合好的溶液置50℃水浴保温20 min,再加入2.5 mL 10%三氯乙酸溶液,混匀,静置10 min后,用分光光度计于700 nm处测其吸光值。以吸光值大小表示还原能力大小,每个样品重复3次,求其平均值。
2 结果与分析
2.1 对·OH清除能力的测定结果
Fenton反应体系在催化剂作用下,过氧化物能产生两种活泼的氢氧自由基,从而引发和传播自由基链反应,加快有机物和还原性物质的氧化,从而产生·OH。本研究考察在襄麦冬多糖提取物存在时,·OH对α-脱氧核糖分子的氧化、破坏情况,从而来确定麦冬多糖对·OH的清除活性,结果见图1。
由图1可以看出,襄麦冬块根多糖溶液对羟自由基的清除活性,随着其质量浓度的增加而逐渐增强,在浓度达到100 mg/mL之前,清除率保持较大的增幅,此后,尽管随浓度的增大而清除率继续增强,但是增幅明显降低,清除活性维持在51%左右。而阳性对照生育酚的清除率,从50 mg/mL浓度开始,增幅显著减小,总体上清除率维持在80%左右。

图1 襄麦冬多糖提取物的体外清除羟基自由基的能力Fig.1 In vitro scavenging hydroxyl radical ability of L.spicata var prolifera polysaccharide
2.2 对·O2-清除能力的测定结果
在碱性条件下(pH8.2)邻苯三酚发生自氧化反应,生成超氧阴离子自由基(·O2-)和中间产物,该中间产物在325 nm处有一特征吸收峰。当加入自由基清除剂时,·O2-的生成会受到抑制作用,自氧化过程也会受阻,中间产物生成减少,在325 nm处的吸收减弱。因此,可以通过测定A325的变化来评价襄麦冬多糖提取物对·O2-的清除能力,不同浓度的样品溶液清除结果见图2。
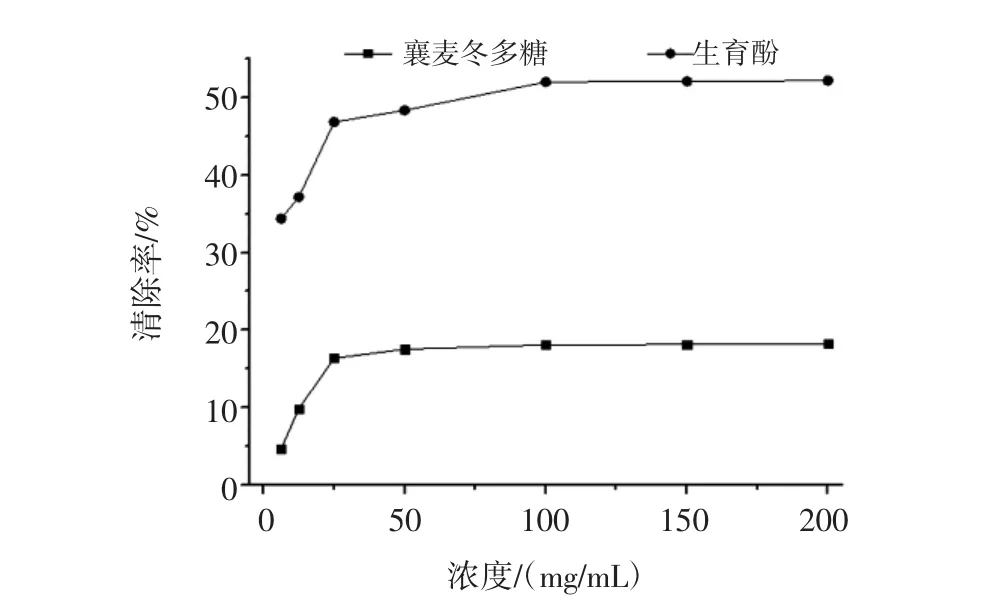
图2 襄麦冬多糖提取物的体外清除·O2-的能力Fig.2 In vitro scavenging·O2-of L.spicata var prolifera polysaccharide
由图2可知,不同浓度的襄麦冬多糖提取物与生育酚均对邻苯三酚自氧化反应有一定的抑制作用,即对·O2-有一定的清除能力,随着多糖浓度的增加,二者清除自由基的能力也逐渐增加,且清除率保持着类似的上升趋势。但是,总体上来看,襄麦冬多糖对·O2-的清除活性并不是太强,其清除率也仅维持在20%,远低于同浓度的生育酚的52%左右。
2.3 对DPPH自由基清除能力的测定结果
DPPH被甲醇溶解后形成一种稳定以氮为中心的质子的自由基(DPPH·),甲醇溶液呈紫红色,在515 nm处有强吸收。当自由基清除剂提供一个电子与DPPH·的孤对电子配对,而使其颜色消退,在最大吸收波长处减弱,其中褪色程度与其接受的电子呈定量的一种关系。这种颜色变浅的状况与配对电子数呈定量的关系可用于评价DPPH·的清除情况。不同浓度的襄麦冬多糖提取物清除DPPH·的活性测试结果见图3。
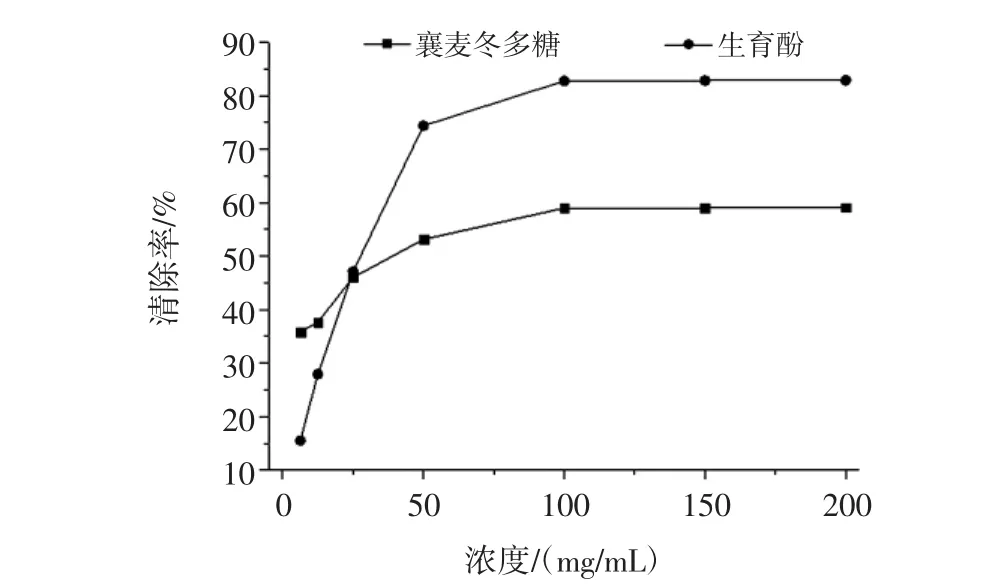
图3 襄麦冬多糖提取物的体外清除DPPH自由基能力Fig.3 In vitro scavenging DPPH radical ability of L.spicata var prolifera polysaccharide
从图3可以看出,襄麦冬多糖提取物体外清除DPPH·的活性较强,随着浓度的增加其清除DPPH自由基的能力也在逐渐增强,并呈现一定的量效关系,在浓度达到100 mg/mL之后,其清除率总体维持在59%左右,这表明襄麦冬多糖提取物对DPPH自由基有比较好的清除能力。同时,由图3还可发现,在浓度达到25 mg/mL之前,低浓度的样品溶液其清除DPPH自由基的活性,要高于同浓度的生育酚。
2.4 对ABTS自由基清除能力的测定结果
ABTS溶液在合适的氧化剂的作用下,会自动氧化成绿色的ABTS溶液,在734 nm处可以测定其吸光度。但是在抗氧化剂存在的情况下,ABTS自由基的产生会被抑制,溶液的颜色会变浅。因此,通过测定ABTS自由基在734 nm处的吸光度变化,即可测定出样品的总抗氧化活性大小。
襄麦冬多糖不同浓度的提取物体外清除ABTS自由基的测定结果见图4,由图4可知,随着提取物浓度的增大其清除ABTS自由基的能力越强,并呈现一定的量效关系:在供试溶液浓度达到100 mg/mL之前,不论是标准品还是样品,其清除率的增幅随浓度的增大而增加。此后,尽管二者清除率依然会随浓度的增大而继续增加,但是增幅急剧减小,二者对ABTS自由基的清除活性维持在50%和80%左右。
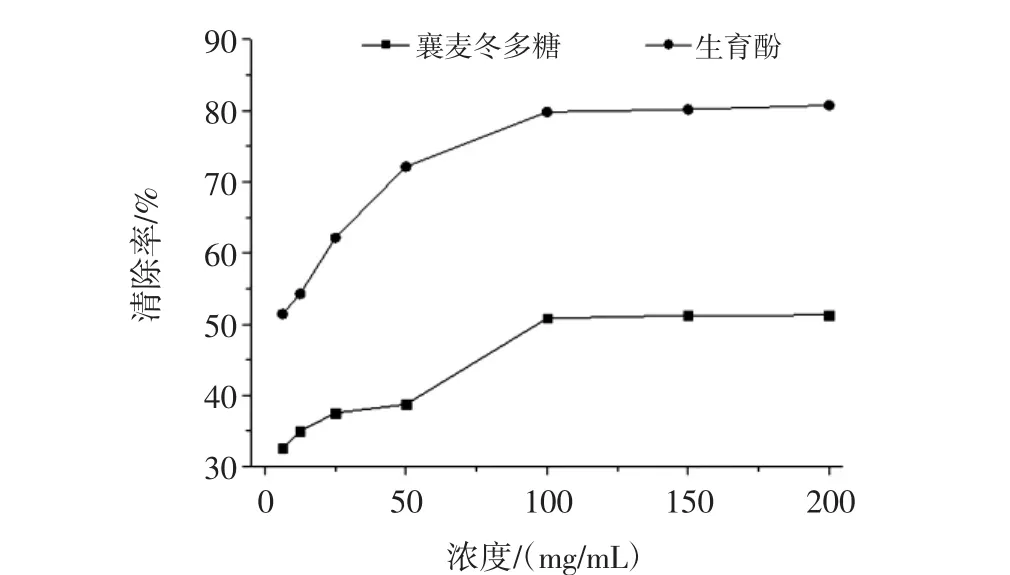
图4 襄麦冬多糖提取物的体外清除ABTS自由基的能力Fig.4 In vitro scavenging ABTS radical ability of L.spicata var prolifera polysaccharide
2.5 抗脂质过氧化活性的测定结果
脂质的自动氧化也称脂质的过氧化作用。脂质的过氧化一般定义为多不饱和脂肪酸或脂质的氧化变质。若糖类物质含量较高的情况下也会抑制脂质的氧化,襄麦冬多糖提取物的体外抗脂质过氧化活性见图5。
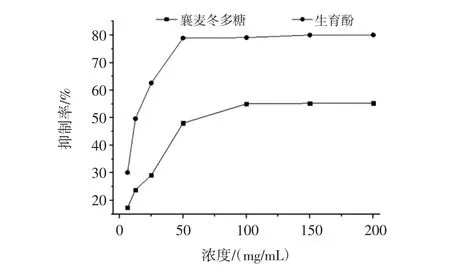
图5 襄麦冬多糖提取物的体外抗脂质过氧化活性Fig.5 In vitro anti lipid peroxidation activity of L.spicata var prolifera polysaccharide
由图5可知,襄麦冬多糖提取物能明显的抑制亚油酸的自氧化,同生育酚相比,虽然低浓度的多糖对亚油酸的抑制作用偏低,但随其浓度加大,其抑制脂质过氧化活性越强,且抑制增幅接近于生育酚的趋势。当浓度达到100 mg/mL之后,襄麦冬多糖提取物对脂质过氧化的抑制率保持在55%左右,显示出较强的抗脂质过氧化特性。
2.6 还原能力的测定结果
三价铁离子具有氧化性,还原糖可将其氧化。若反应体系中存在有还原性物质时,铁氰化钾会被还原成亚铁氰化钾,亚铁氰化钾在酸性条件下与三氯化铁反应,生成普鲁士蓝,在700 nm波长处有最大吸收波长。故吸光值越大,表示待测还原性物质的还原能力越强。
抗氧化剂清除自由基的机理是通过自身的还原作用给出电子来清除的,一般来说,吸光值越大,还原能力就越强,其抗氧化性就越好,襄麦冬多糖提取物的体外还原能力见图6。

图6 襄麦冬多糖提取物的体外还原能力Fig.6 In vitro reduction ability of L.spicata var prolifera polysaccharide
由图6可以看出,随着襄麦冬多糖提取物浓度的增大,处理后的样品溶液其吸光值也逐渐增大,即对铁氰化钾的还原能力也增强,当浓度达到50 mg/mL之后,其吸光值增幅显著减小,数值逐渐维持在0.073上下,这表明尽管浓度在不断增大,但是襄麦冬多糖的还原能力趋于稳定。
3 小结与讨论
目前,国内关于麦冬多糖的抗氧化活性报道,几乎全部集中在麦冬Ophiopogon jaonicus上,鲜见襄麦冬Liriope spicata var.prolifera的。本文采用α-脱氧核糖法、邻苯三酚自氧化法、DPPH法、亚油酸体系法、ABTS法以及铁氰化钾还原法等方法,对产自湖北襄阳的道地药材——襄麦冬多糖提取物的体外抗氧化活性进行了测定。结果表明,襄麦冬多糖的清除自由基活性与其提取物的浓度呈线性关系,浓度越高,其清除自由基能力和还原能力就越强。除了对超氧阴离子的清除率仅为20%之外,麦冬多糖对其它自由基的清除率都超过50%,尤其对DPPH自由基最高,维持在59%左右。同时,研究还发现,襄麦冬多糖提取物对铁氰化钾的还原能力以及抗脂质过氧化活性,均是随着多糖质量浓度的增高而增强。
严碧歌采用超声波处理提取川麦冬多糖,发现虽然不会影响多糖的单糖组成,但是会改变多糖的微观结构,提高多糖的抗氧化活性[13]。赵凯的报道则显示,经超声波处理所得麦冬多糖,除超氧阴离子自由基(O2-·)的清除作用丧失外,其它抗氧化活性均得到提高[14]。研究还发现,超声功率对麦冬多糖的抗氧化活性具有显著影响:随着超声功率的增大,麦冬多糖的抗氧化活性呈现出先增大后减小的趋势,且超声功率为400 W时其抗氧化活性最高[15]。王艳翠[16]对麦冬体外抗氧化测试结果显示麦冬的氯仿/甲醇提取物和正丁醇萃取物具有较好的抗氧化活性,而粗多糖的抗氧化活性较低。李明[17]研究发现麦冬多糖可提高长期负荷训练大鼠的免疫功能,抑制过氧化损伤和糖原的耗竭,具有良好的开发前景。张力妮[18]测试了经过硫酸化、磷酸化以及羧甲基化修饰的8种麦冬多糖的体外抗氧化活性,发现它们均具有一定的抗氧化活性,尤其对于DPPH自由基,清除率最高可达70%。陈刚[19]实验证明具有很好的吸湿保湿性能,具有很好的还原能力,为麦冬多糖开发成保健品或化妆品提供了一定的理论依据。张娅芳的实验表明6种麦冬多糖均具有体外抗氧化活性,且呈剂量依赖关系,其中POJ-SS体外抗氧化性最强,她推测这可能与其具有β-(1,3)键合的葡聚糖骨架有关系[20]。
襄麦冬是一种药食两用植物,目前已开发出麦冬酒、麦冬茶、麦冬酸奶等产品,本文对其多糖展开的抗氧化性研究,将非常有助于襄麦冬资源的综合利用,尤其是为植物性天然食品抗氧化剂的开发,提供了一种新的思路。
[1]刘立萍,李然.“纯补胃阴”论麦冬[J].辽宁中医杂志,2011(1):132-133
[2]王智杰,苟小林.麦冬降血糖作用的药效学研究[J].中医药学刊,2003,21(6):898-899
[3]张力妮,张静,孙润广,等.麦冬多糖的修饰及其抗氧化活性与空间结构的研究[J].食品与生物技术学报,2014,33(1):27-33
[4]王昭晶,罗巅辉.麦冬水溶性多糖OPA的分离纯化及其抗氧化活性研究[J].现代中医药,2008,28(5):77-79
[5]王昭晶,罗巅辉.麦冬水溶性多糖OPB的分离纯化及抗氧化活性研究[J].长春中医药大学学报,2008,24(3):254-255
[6]孙永林,余海忠,刘慧宏,等.湖北麦冬块根多糖提取工艺的优化[J].食品工业科技,2011(4):293-294
[7]周婷,刘统,林丹洁,等.鱼腥草甲醇提取物体外抗氧化性及抑菌活性评价[J].山地农业生物学报,2012,31(3):87-90
[8]陈留勇,孟宪军,贾薇,等.黄桃水溶性多糖的抗肿瘤作用及清除自由基、提高免疫活性研究[J].食品科学,2004,25(2):167-170
[9]余海忠,刘统,林丹洁,等.鄂西北产鱼腥草提取物体外抗氧化性的四种化学方法评价[J].中国野生植物资源,2012,31(1):22-25
[10]白海娜,王振宇,刘瑞海,等.白藜芦醇与黑木耳多糖协同清除ABTS自由基活性的研究[J].现代食品科技,2014,30(3):64-68
[11]聂伦,熊尚森,余海忠.襄麦冬不同极性部位粗提物抗氧化性能初步评价[J].山地农业生物学报,2013,32(1):87-90
[12]余海忠,阮士龙,刘统,等.鄂西北产猫眼草提取物体外抗氧化性及光稳定性测试[J].西北农业学报,2012,21(4):137-141
[13]严碧歌,赵凯,杜柯.超声波提取对麦冬多糖结构和抗氧化活性的影响[J].压电与声光,2011,33(6):859-862
[14]赵凯.超声波对麦冬多糖的提取率、结构及抗氧化活性的影响[D].西安:陕西师范大学,2011
[15]王小梅,孙润广,张静,等.超声提取功率对麦冬多糖结构及抗氧化活性的影响[J].陕西师范大学学报(自然科学版),2013,41(3):68-75
[16]王艳翠.麦冬化学和营养成分及其体外活性的研究[D].杨凌:西北农林科技大学,2016
[17]李明.麦冬多糖对训练大鼠免疫及抗氧化功能的影响[J].食品科技,2014,39(8):182-186
[18]张力妮.麦冬多糖的修饰、抗氧化活性以及结构的研究[D].西安:陕西师范大学,2014
[19]陈刚,郭晓蕾,宝丽.银耳、麦冬、燕麦多糖的抗氧化活性及吸湿保湿性能研究[J].中华中医药学刊,2013,31(1):212-214
[20]张娅芳.麦冬多糖的结构分析及其体外抗氧化活性研究[D].西安:陕西师范大学,2007

