犬新孢子虫巨噬细胞转移抑制因子的原核表达
金婷婷,曲光刚,王长江,武曰星,唐世云,沈志强,
( 1.山东省滨州畜牧兽医研究院,山东滨州 256600; 2.山东绿都生物科技有限公司,山东滨州 256600)
新孢子虫病是由犬新孢子虫(Neosporacaninum)寄生在犬、牛等宿主引起的一种原虫病[1]。该病主要导致孕畜流产、死胎及新生幼畜运动障碍和神经系统疾病,给畜牧业造成巨大经济损失[2-3]。目前针对犬新孢子虫病的疫苗主要有活疫苗和灭活疫苗[4],活疫苗虽然能诱发较好的免疫反应,但存在贮藏期短、需冷冻存储、弱毒株毒力易返强等缺点;而灭活疫苗不能诱导产生细胞免疫[5-6]。因此,筛选主要相关的保护性抗原用于制备新孢子虫病亚单位疫苗具有重要意义。
巨噬细胞转移抑制因子(macrophage migration inhibitory factor,MIF)[7-8]是20世纪60年度末被发现的细胞因子之一。MIF具有两种潜在的生物学催化活性(即互变异构酶与氧化还原酶活性),并参与固有免疫应答及适应性免疫反应过程[9-10]。MIF最重要的作用是对巨噬细胞[11-12]和淋巴细胞反应进行调节以及对激素功能进行调控[13-14]。MIF能够通过上调巨噬细胞TLR4的表达,增加病原刺激时NO的表达量。MIF也能诱导炎性细胞因子如TNFα、IL-1β、IL-2、IL-6、IL-8和IFNγ等的表达[15-17]。有研究表明,MIF的互变异构酶活性受抑制时,当脂多糖(LPS)刺激巨噬细胞时其产生的TNF的量会降低,因此,败血症动物模型的存活率会提高[18-19]。本试验克隆了犬新孢子虫巨噬细胞转移抑制因子(macrophage migration inhibitory factor ofNeosporacaninum,NcMIF)基因,利用大肠埃希菌进行目的蛋白的表达,并对该蛋白的反应原性进行研究,为进一步研究NcMIF在宿主免疫调节中的作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 质粒、菌种和试验用动物 犬新孢子虫NC1株,山东省滨州畜牧兽医研究院实验室保存;大肠埃希菌DH5α,宝生物工程(大连)有限公司产品;BL21 (DE3),Novagen;pGEM-T,Promega;pET26b(+),EMD Millipore;试验用绵羊,山东省滨州畜牧兽医研究院繁育。
1.1.2 主要试剂及其配方 限制性内切酶Hind Ⅲ、NdeⅠ、TaqDNA聚合酶、10×PCR buffer(含Mg2+)、dNTP(2.5 mmol/L),宝生物工程(大连)有限公司产品;M-MuLV反转录酶(NEB Ipswich MA)、氨苄青霉素(Ampicillin)、卡那霉素(Kanamycin),Sigma公司产品;RNA提取试剂盒,RNeasy Mini Kit(Qiagen,MD)、PCR纯化试剂盒(Promega,Madsion,WI)、质粒提取试剂盒WizardPlus SV Minipreps kits(Promega,Madsion,WI)、Lysis buffer(50 mmol/L NaH2PO4,pH 8.0,300 mmol/L NaCl)、Triton X-114(Sigma,St. Louis,MO);兔抗羊IgG-HRP,太平洋免疫学公司产品。
1.1.3 主要仪器与设备 PCR仪、Gdldoc EQ凝胶成像系统,美国Bio-Rad公司产品;Thermo Scientific Nano DROP2000微量分光光度计,北京科尔德科贸有限公司产品;核酸电泳仪器,北京六一仪器厂产品;冷冻离心机,美国Eppendorf公司产品;各种规格的移液器,德国Eppendorf公司产品;HH.B11.420型电热恒温培养箱,上海华辰医用仪表有限公司产品;VS-1300-U型超净工作台,苏州净化设备厂产品;Ni-NTA柱(St. Louis,MO)Sigma公司产品;ChemiImagerTM4400 Low Light成像系统(Alpha Innotech Corporation,San Leandro,CA);PVDF膜,Millipore,Bedford,MA。
1.2 方法
1.2.1 NcMIF及其突变体基因克隆 用RNeasy Mini Kit从NC1株犬新孢子虫速殖子中提取总RNA作为模板,使用M-MuLV反转录酶及反向引物合成cDNA。根据NC1 NcMIF mRNA序列(NCLIV-042400,previously known as NC-LIV-113040,www.genedb.org),利用分子生物学软件PRIMER 5.0设计1对特异性引物,采用PCR扩增NcMIF基因。上游引物序列为5′ -ATACATATGCCAAAGTGCATGATCTAC-3′ ,在其5′端加入NdeⅠ酶切位点;下游引物序列为5′ -TAAAGCTTTTAGCCAAAGGTGCGGTC-3′ ,在其5′端加入Hind Ⅲ酶切位点。利用上游引物序列5′-ATACATATGGGCAAGTGCATGATCTAC-3′和共用的下游引物获得第2位的脯氨酸突变为甘氨酸的NcMIF突变体NcMIFm基因。PCR反应条件如下:95℃ 10 min;95℃ 40 s,55℃ 30 s,72℃ 40 s,35个循环;72℃ 10 min。
将PCR产物纯化回收与pGEM-T载体连接,并将连接产物转入大肠埃希菌DH5α。使用质粒提取试剂盒WizardPlus SV Minipreps kits从PCR鉴定为阳性的大肠埃希菌中提取质粒,送上海生工生物工程技术服务有限公司测序。
1.2.2 NcMIF重组蛋白的表达、纯化及内毒素去除 分别亚克隆测序正确的NcMIF和NcMIFm基因,并将其连接到pET26b(+)载体上,然后转入BL21 (DE3)中进行表达,诱导条件为30℃诱导3 h,IPTG诱导浓度为1 mmol/L。诱导完成后,在4℃条件下将菌液4 000 r/min离心20 min,弃掉上清液,菌泥用Lysis buffer重悬,大肠埃希菌经过5次反复冻融后用10 μg/mL DNase/RNase在37℃下消化30 min,然后经20 000 r/min 4℃离心20 min,收集上清,使用Ni-NTA柱纯化。
目的蛋白采用Triton X-114去除内毒素[20]后进行纯化。将Triton X-114加入到可溶性裂解液中至终浓度为10 mL/L,将混合液涡旋10 s,冰上放置5 min,再涡旋10 s后静置于37℃ 10 min。之后将混合液在38℃条件下20 000 r/min离心2 min,收集上层水相部分得到重组蛋白。重复以上操作步骤7次,使内毒素完全去除。使用SEC-HPLC纯化萃取重组蛋白rNcMIF和rNcMIFm,用pH7.2的PBS(50 mmol/L Na2HPO4,200 mmol/L NaCl)作为流动相,流速0.5 mL/min。
1.2.3 NcMIF重组蛋白的复性及抗体制备 将纯化好的rNcMIF制备成疫苗免疫绵羊后采血制备抗NcMIF血清,免疫程序如下:免疫剂量为200 μg/只,皮下多点注射,共进行4次免疫。首次免疫使用等体积的弗氏完全佐剂与蛋白乳化后注射,后3次免疫使用等体积的弗氏不完全佐剂与蛋白乳化后注射,免疫间隔为2周,每次免疫1周后采血,血样抗体效价采用ELISA检测。
1.2.4 分泌排泄产物抗原(ESAg)以及可溶性抗原NcAg的制备 将纯化的速殖子用RPMI 1640 (25 mmol/L谷氨酰胺,50 μg/mL 庆大霉素)培养,至虫体数量为108个/mL,NC1分离株在37℃下培养,Nct分离株在32℃下培养;4℃条件下用5 μmol/L钙离子对2个分离株分别处理1 h,对照组不做处理。处理后在4℃条件下20 000 r/min离心20 min得上清液,置-70℃保存备用。进行SDS-PAGE分析前将上清样品在70℃加热10 min。速殖子在最大超声频率下超声3次获得NcAg,每次15 s,随后在4℃条件下20 000 r/min离心20 min,收集上清液并于-70℃保存备用。
1.2.5 NcMIF和ESAg的Western blot分析 采用50 g/L SDS-PAGE胶分离样品。电泳完成后将蛋白转至PVDF膜上。将膜浸泡于含30 g/L脱脂奶粉的PBS中孵育1 h,然后加入1∶500羊抗NcMIF抗体室温孵育1 h,洗涤后,加入1∶5 000兔抗羊IgG-HRP孵育1 h。洗涤后,在显色基质中显色。使用ChemiImagerTM 4400 Low Light成像系统采集图像。为了判断分泌的NcMIF的相对含量,使用三氯乙酸将ESAg进行20倍浓缩:三氯乙酸加入到0.8 mL 分泌排泄产物抗原(excretorysecretoryantigen,ESAg)中至终浓度为10 mL/L,然后冰上放置15 min,14 000 r/min离心10 min;将沉淀用100 μL丙酮洗涤2次,自然风干,加入50 μL 2×SDS buffer 吹打混匀。SDS-PAGE分析中同样加入同等浓度的在2×107速殖子中浓缩的ESAg。通过显像系统检测NcMIF的光密度(IOD)特殊波段,减去速殖子在37℃分泌的NcMIF的光密度(IOD)获得速殖子在4℃分泌的NcMIF光密度(IOD)值。
2 结果
2.1 NcMIF序列和进化分析
本研究中所用的NcMIF序列与利物浦犬新孢子虫的NcMIF cDNA序列同源性为100%(序列比对结果未展示),该序列编码116个氨基酸,分子质量约为12.2 ku。与哺乳类动物的MIFs相比,该序列在第12位处多出一个氨基酸。MIF序列比对和系统进化树分析结果显示,NcMIF与弓形虫的MIF同源性极高,达到81.9%,但与人和鼠的MIFs相比同源性较低,仅为24.3%~27.0%,与其他原生动物的MIFs同源性为31.0%~36.5%(图1和图2)。
与哺乳动物MIF一样,NcMIF蛋白没有信号肽,且哺乳动物MIF与互变异构酶功能密切相关的6个保守氨基酸中,NcMIF只有其中的第二位的脯氨酸和Lys33、Ile65及Tyr96(图1中以Δ标示);Plasmodiumspp.MIF中与趋化作用相关的Cys3及Cys4中,NcMIF只有Cys4((图1中以*标示)。
Cys57-X-X-Cys60是哺乳动物MIF介导氧化还原酶活性的结构域[21-22],但在NcMIF和弓形虫MIF(ToxoplasmagondiiMIF,TgMIF)中被Cys57-X-Ile59取代(图1中以▲标示)。

哺乳动物MIF中的六个氨基酸残基由无填充三角(Δ)标注。哺乳动物MIF上CXXC的趋化因子结构域用黑色三角形(▲)标注,恶性疟原虫中相邻的Cys2和Cys3用*标注
The six amino acid residues in mammalian MIF are marked by asterisks (Δ), the chemokine motif of CXXC present in mammalian MIF is marked by filled triangles (▲) and the adjacent Cys2 and Cys3 present inP.falciparumMIF are labeled with *
图1部分顶复门寄生虫和哺乳动物代表性的MIF同源基因的序列比对
Fig.1 Sequence alignment of representative MIF orthologues from part of Apicomplexan parasites and mammals
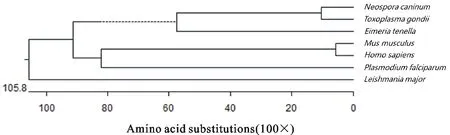
图2 部分顶复门寄生虫和哺乳动物代表性的系统进化树分析
2.2 rNcMIFs的表达与纯化
rNcMIF和rNcMIFm在E.coliBL21(DE3)表达菌株中均为可溶性表达(图3)。SDS-PAGE分析显示,rNcMIF和rNcMIFm蛋白分子质量约为12 ku(图4)。rNcMIF和rNcMIFm蛋白虽然经SDS-PAGE分析显示出相似的分子质量,但经SEC-HPLC纯化后,分析两种蛋白在280 nm处吸收峰发现,第2位的脯氨酸突变为甘氨酸的rNcMIFm经SEC-HPLC后,该蛋白的保留时间相比rNcMIF蛋白的保留时间(18 min~19 min)延长到35 min~45 min (图5)。
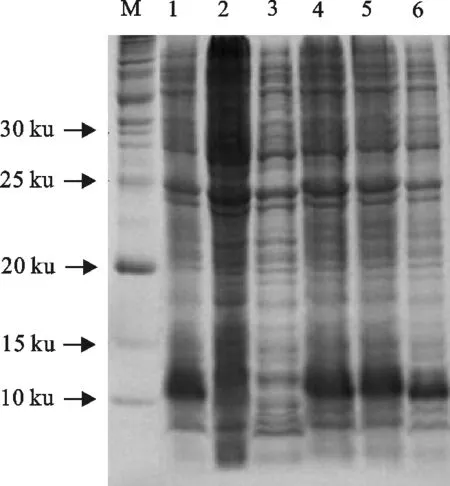
M.蛋白分子质量标准;1.阳性全菌体;2.阴性对照;3.rNcMIF超声沉淀;4.rNcMIF超声上清;5.rNcMIFm超声沉淀;6.rNcMIFm超声上清
M.Protein molecular weight Marker;1.Positive control;2.Negative control;3.Precipitate of rNcMIF after ultra-sonication;4.Precipitate of rNcMIF after ultra-sonication;5.Precipitate of rNcMIFm after ultra-sonication;6.Precipitate of rNcMIFm after ultra-sonication
图3重组蛋白rNcMIF和rNcMIFm表达产物可溶性分析
Fig.3 Soluble analysis of recombinant protein NcMIF and rNcMIFm by SDS-PAGE
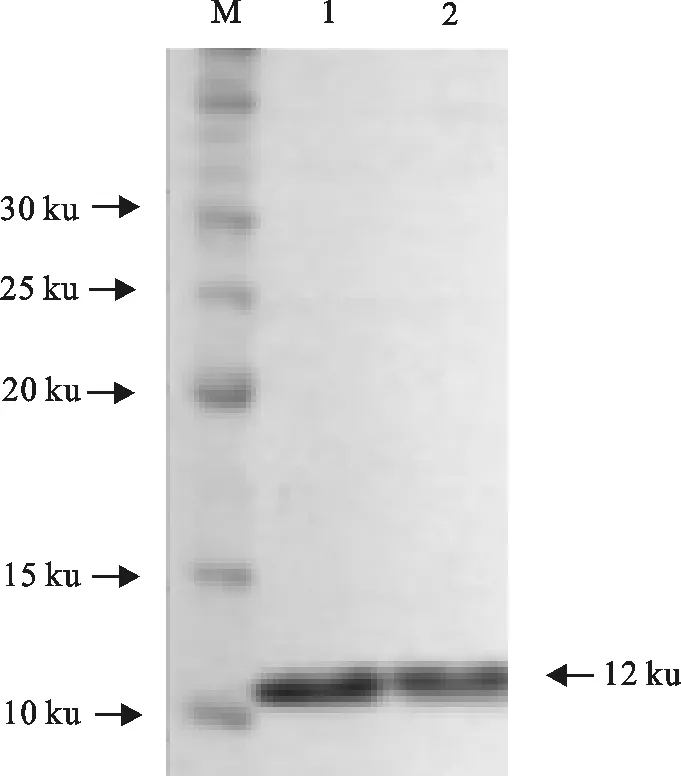
M.蛋白分子质量标准; 1.纯化的rNcMIF;2.纯化的rNcMIFm
M.Protein molecular weight Marker;1.Purified rNcMIF;2.Purified rNcMIFm
图4纯化NcMIF和rNcMIFm的SDS-PAGE分析
Fig.4 Analysis of purified rNcMIF and rNcMIFm by SDS-PAGE
2.3 免疫印迹分析
Western blot分析等量的ESAg中的NcMIF水平或不同条件下NC1、Ncts8速殖子的所有细胞裂解产物中NcMIF的水平。在4℃放置的ESAg里检测到很低水平的NcMIF(图6泳道7和8),而从37℃培养的NC1速殖子中释放的NcMIF水平也没有增加(图6泳道4和图7)。然而,当NC1加入钙离子共培养时NcMIF的释放量有了显著的增加(约85倍)(图6泳道4与泳道6对比,图7) (P<0.05)。Ncts8速殖子的NcMIF基础释放量比NC1速殖子高(P<0.05),但NcTs8速殖子加入钙离子处理后NcMIF释放量比基础释放量增加约6倍(P<0.05)。总的来说,与NC1速殖子相比,Ncts8速殖子在4℃和32℃ NcMIF的释放量均较高。另外,在整个Ncts8速殖子细胞裂解产物中NcMIF的分泌量也比在NC1速殖子的高(P<0.05)。

图5 rNcMIF和rNcMIFm液相色谱分析
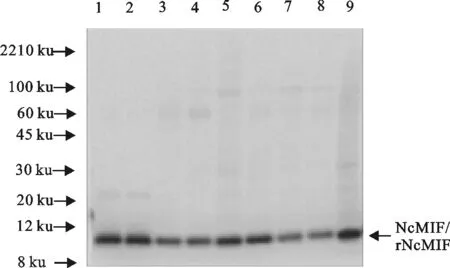
1.rNcMIF (25 ng); 2.rNcMIFm (25 ng); 3.NC1 ESAg 37℃;4.Ts-8 ESAg 32℃;5.5 μmol/L Ca2+37℃ 1 h NC1 ESAg; 6.5 μmol/L Ca2+32℃ 1 h Ts-8 ESAg; 7.4℃ 1 h Nc1 ESAg; 8.4℃ 1 h Ts-8 ESAg; 9.NC1 NcAg (5 μg)
图6速殖子裂解过程中NcMIF的表达水平分析
Fig.6 Analysis of experession levels of NcMIF in the process of tachyzoite lysis (NcAg)

图7 NcMIF带的OD值分析
3 讨论
犬新孢子虫MIF同系物与其同属的弓形虫的MIF高度同源,同源性为81.9%,而与哺乳类动物和其他寄生虫的MIF序列的同源性不到50%。尽管同源性不高,NcMIF蛋白含有哺乳类动物MIF蛋白大多数特征性的氨基酸残基。这为进一步研究NcMIF蛋白可能存在的与哺乳类动物的MIFs具有相似的生物活性提供了理论基础。
本研究采用原核系统成功表达了NcMIF基因及其突变体基因NcMIFm,经过诱导温度、IPTG诱导浓度、表达时间等条件的优化,使rNcMIF和rNcMIFm在E.coliBL21(DE3)中实现可溶性表达;SDS-PAGE分析显示,rNcMIF和rNcMIFm蛋白分子质量为12 ku。利用分子筛对2种蛋白进行纯化发现,2种蛋白在柱中停留时间不一致,说明很有可能第2位氨基酸的突变导致整个NcMIF结构的变化,这为进一步研究NcMIF互变异构酶等相关生物学活性奠定了基础。Western blot分析证明,该重组NcMIF蛋白和NcMIFm蛋白均能够与NcMIF绵羊多抗血清特异性结合,具有很好的反应原性,同时比较分析结果显示,NcMIF大量存在于速殖子分泌和排泄抗原中(ESAg)。NcMIF在弱毒株Ncts-8的分泌量比在野生型分离株(NC1)中多。此外,在钙离子载体存在的条件下,2个分离株分泌的NcMIF均会增加,下一步将继续开展NcMIF相关生物学和免疫学功能研究,以期阐明寄生虫感染后NcMIF在发病过程中的作用机制。
[1] Dubey J,Carpenter J,Speer C,et al.Newly recognized fatal protozoan disease of dogs[J].J Am Vet Med Assoc,1988,192(9):1269.
[2] Wang C H,Ji X C,Yang F,et al.Epidemiological investigations of infections withNeosporacaninumand Brucellosis in abortion dairy cattle of Xinjiang region[J].Xinjiang Agr Sci,2009,46(3):657-660.
[3] Dubey J P,Schares G.Neosporosis in animals-the last five years[J].Vet Parasitol,2011,180(1):90-108.
[4] 宋新刚,赵 辉,李辰龙,等.犬新孢子虫抗原的研究进展[J].畜牧兽医科技信息,2013(1):6-9.
[5] 王 雪,孟庆峰,刘新欣,等.新孢子虫抗原及疫苗研究进展[J].动物医学进展,2015,36(12):129-133.
[6] 贾立军,张守发,栾 杨,等.牛新孢子虫NcSAG1基因工程亚单位疫苗的免疫试验[J].畜牧与兽医,2010,42(1):20-22.
[7] Bernhagen J,Calandra T,Mitchell R A,et al.MIF is a pituitary-derived cytokine that potentiates lethal endotoxaemia[J].Nature,1993,365(6448):756-759.
[8] Bloom B R,Bennett B,Oettgen H F,et al.Demonstration of delayed hypersensitivity to soluble antigens of chemically induced tumors by inhibition of macrophage migration[J].Proceed Nat Acad Sci,1969,64(4):1176-1180.
[9] Machicado C,Marcos L A.A computational assessment of the predicted structures of Human macrophage migration inhibitory factor 1 orthologs in parasites and its affinity to human CD74 receptor[J].J Mol Recogn,2017,DOI:10.1002/jmr.2640.
[10] Koizumi M,Nahar A,Yamabe R,et al.Positive correlations of age and parity with plasma concentration of macrophage migration inhibitory factor in Japanese black cows[J].J Reprod Develop,2016,62(3):257-263.
[11] Baugh J A,Bucala R J,Chitnis S,et al.Macrophage migration inhibitory factor (mif) promoter polymorphism in inflammatory disease:U.S.Patent Application 14/828,415[P].2015-8-17.
[12] Onodera S,Suzuki K,Matsuno T,et al.Macrophage migration inhibitory factor induces phagocytosis of foreign particles by macrophages in autocrine and paracrine fashion[J].Immunology,1997,92(1):131-137.
[13] Yaddanapudi K,Putty K,Rendon B E,et al.Control of tumor-associated macrophage alternative activation by macrophage migration inhibitory factor[J].J Immunol,2013,190(6):2984-2993.
[14] Mitchell R A,Metz C N,Peng T,et al.Sustained mitogen-activated protein kinase (MAPK) and cytoplasmic phospholipase A2 activation by macrophage migration inhibitory factor (MIF) regulatory role in cell proliferation and glucocorticoid action[J].J Biol Chem,1999,274(25):18100-18106.
[15] Bacher M,Metz C N,Calandra T,et al.An essential regulatory role for macrophage migration inhibitory factor in T-cell activation[J].Proceed Nat Acad Sci,1996,93(15):7849-7854.
[16] Roger T,Delaloye J,Chanson A L,et al.Macrophage migration inhibitory factor deficiency is associated with impaired killing of gram-negative bacteria by macrophages and increased susceptibility toKlebsiellapneumoniaesepsis[J].J Infect Dis,2012,207(2):331-339.
[17] Donnelly S C,Bucala R,Metz C N,et al.Macrophage migration inhibitory factor and acute lung injury[J].Chest J,1999,116(S1):111S-111S.
[18] Morand E F,Leech M,Bernhagen J.MIF:a new cytokine link between rheumatoid arthritis and atherosclerosis[J].Nat Rev Drug Discove,2006,5(5):399-411.
[19] Dabideen D R,Cheng K F,Aljabari B,et al.Phenolic hydrazones are potent inhibitors of macrophage migration inhibitory factor proinflammatory activity and survival improving agents in sepsis[J].J Med Chem,2007,50(8):1993-1997.
[20] Lubetsky J B,Dios A,Han J,et al.The tautomerase active site of macrophage migration inhibitory factor is a potential target for discovery of novel anti-inflammatory agents[J].J Biol Chem,2002,277(28):24976-24982.
[21] Tuo W,Fetterer R,Jenkins M,et al.Identification and characterization ofNeosporacaninumcyclophilin that elicits gamma interferon production[J].Infect Immun,2005,73(8):5093-5100.
[22] Yin J,Qu G,Cao L,et al.Characterization ofNeosporacaninummicroneme protein 10 (NcMIC10) and its potential use as a diagnostic marker for neosporosis[J].Vet Parasitol,2012,187(1):28-35.

