反复冻融次数和不同保存温度对病毒滴度的影响
陈柯君,李 佳,邓乐君,3,陈灶妹,赵 月,江 丽,3,张俊辉,李伟达,李茹冰,李 健1,*
(1.广东药科大学,广东广州 510006;2.广州总医院,广东广州 510010;3.南方医科大学,广东广州 510515;4.广州市电纺生物科技有限公司,广东广州 510604)
猪细小病毒(Porcine parvovirus,PPV)属于细小病毒科细小病毒属,可引起猪繁殖障碍,感染高发期为春夏秋季[1],主要表现为胚胎和胎儿的感染和死亡,特别是初产母猪发生死胎、畸形胎和木乃伊胎,但母猪本身无明显的症状。PPV可以分为PPV-1、PPV-2、PPV-3、PPV-4、PPV-5[2-3]和PPV-6[4]等6种不同遗传类型。PPV最早出现于欧洲,早在1967年Cartwright等通过对猪的不孕、流产、死胎等进行病原学研究时,分离出了猪细小病毒,首次证明了它的致病作用[5]。我国首株猪细小病毒是由潘雪珠等[6]在1983年分离得到的。随后,张婉华等[7]也把猪死胎的内脏经过处理后接种于ST细胞进行病毒分离,细胞可产生相应的病变,主要表现为细胞固缩、拉网等变化,结果证实该分离毒株为PPV。起初猪是PPV的传播源,后来有报道称,在牛、羊、猫、大鼠和小鼠体内都可以检测到PPV的特异性抗体,且在感染PPV后可出现流产、死产的现象,这些现象都预示着PPV的宿主范围不断扩大[8]。目前猪细小病毒感染在我国乃至世界范围呈递增趋势,该病使畜牧业的发展受到了一定的阻碍。
伪狂犬病病毒(Pseudorabies virus,PRV)属于疱疹病毒科A型疱疹病毒亚科猪疱疹病毒1型,主要通过呼吸道传染,宿主范围广,可导致多种家畜及野生动物被感染,其中患病猪是伪狂犬病病毒的主要储存宿主和传染源。患病仔猪群主要表现为神经症状、腹泻,病死率可高达100%,保育及育肥猪群主要表现为呼吸障碍综合征,种猪群则主要表现为流产、弱胎、繁殖障碍等症状[9]。感染的成年猪以潜伏感染和隐性感染居多,无典型的临床症状出现,但感染猪一直携带病毒并自身可进行周期性排毒,为该病的根除增加了一定的难度[10-11]。2011年在河南省及其临近省市暴发了极其严重的伪狂犬病疫情,随后疫情迅速向南方蔓延,覆盖了大半个中国,对我国的养殖业造成了巨大的经济损失[12]。
在一些血液制品的生产中,需要用猪细小病毒和伪狂犬病病毒来验证生产工艺中所使用的灭活方法灭活病毒的效果,由于病毒是用于工艺验证的,所以病毒的滴度和保存至关重要,这将影响到病毒的质量,从而影响病毒灭活效果的判断。
PPV为单股负链DNA、无包膜病毒;PRV为双链DNA、有囊膜病毒。由于PPV在侵染宿主细胞时属于隐性感染,PPV相对于其他病毒来说属于致细胞病变能力较弱的一类病毒,病毒的滴度难以提高,想要宿主细胞出现病变则需要将PPV盲传数代才能实现[13],这主要是由于PPV独特的分子生物学特性造成的。有文献报道[5],可以通过与胰酶短时间(1 h内)接触来可提高PPV的感染力,所以在进行PPV培养时,可以用该方法来提高PPV的滴度,但是关于该方法的具体操作却没有文献具体说明。虽然在一些文献中提到可以采用反复冻融的方法来提高病毒滴度,但是具体提高了多少滴度却不得而知。笔者以此为切入点,探讨不同的反复冻融次数对病毒滴度的影响。在病毒的保存过程中,温度对病毒滴度的影响起到关键作用,因此,本研究探讨病毒的保存温度对病毒滴度的影响,希望能为病毒的研究过程提供一些参考和科学依据。
1 材料与方法
1.1 材料
1.1.1 细胞和病毒 猪睾丸细胞(ST细胞)、猪细小病毒,中国兽医药品监察所提供;非洲绿猴肾细胞(Vero细胞)、伪狂犬病病毒,广州军区广州总医院输血科提供。
1.1.2 试剂 DMEM培养基,Gibco公司产品 ,置2℃~8℃保存;PBS,Hyclone公司产品 ,置15℃~30℃保存;胎牛血清、胰酶,Gibco公司产品,置-20℃保存;细胞生长培养液:在500 mL DMEM培养液中加入50 mL胎牛血清,10 000单位/mL的青霉素,10 000单位/mL的链霉素,配成含100 mL/L胎牛血清的培养基,4℃保存备用;细胞生长维持液:在500 mL DMEM培养液中加入10 mL胎牛血清,配成含20 mL/L胎牛血清的培养基,4℃保存备用。
1.2 方法
1.2.1 病毒的收集 细胞培养采用T25细胞培养瓶培养,培养基采用含100 mL/L胎牛血清的细胞生长用培养液。病毒培养采用含20 mL/L胎牛血清的细胞生长维持培养液。文中除特别说明外,病毒接种均按照如下方法进行:先倒掉培养瓶中的细胞生长用培养基,用PBS清洗2次,每瓶接种1 mL病毒液,37℃吸附培养2 h,弃病毒上清液,加入与初始生长培养液等体积的细胞生长维持液继续培养。待80%以上的细胞出现病变时收获病毒悬液,即为病毒原液。
1.2.2 反复冻融次数试验 将收集的含ST细胞的猪细小病毒和含Vero细胞的伪狂犬病病毒经过不同的反复冻融次数,冻融次数分别为0、1、3、5、7次,测定上清液中的病毒滴度。
1.2.3 保存期试验 将病毒原液分别于4、22、-20、-80℃保存,分别在1 d、1周、2周、4周后测定其病毒滴度。
1.2.4 病毒半数组织细胞感染剂量(TCID50)测定 将待测病毒用细胞生长维持液按10倍系列梯度稀释,即10-1、10-2~10-9等。将100 μL不同稀释度的病毒液加入长满单层宿主细胞的96孔培养板中,每个稀释度4孔,然后置于37℃、体积分数为5%的CO2培养箱中培养,每日观察,逐孔记录细胞病变情况。
病毒滴度以半数组织细胞感染剂量(TCID50)表示,按Reed-Muench法计算TCID50,TCID50的对数值计算公式如下:
TCID50对数值=病变率高于50%组稀释度的对数值+距离比例
距离比例=(高于50%病变率的百分数-50%)/(高于50%病变率的百分数-低于50%病变率的百分数)

2 结果
2.1 病毒反复冻融次数的试验结果
含ST细胞的猪细小病毒在冻融3次时病毒滴度最高,比冻融0次的病毒滴度提高了大约1.81 lg。冻融1次比冻融0次的病毒滴度提高了约0.47 lg。冻融5次比冻融0次的病毒滴度提高了约0.61 lg。冻融7次比冻融0次的病毒滴度降低了约0.19 lg。冻融0次和7次、冻融1次和5次、PPV的病毒滴度不存在统计学意义(P>0.05)。冻融0次和1次、冻融1次和7次、冻融5次和7次,PPV的病毒滴度存在显著性差异(P<0.05)。冻融0次和3次、冻融0次和5次、冻融1次和3次、冻融3次和5次、冻融3次和7次,PPV的病毒滴度的差异极显著(P<0.01)(表1)。
含Vero细胞的伪狂犬病病毒在冻融3次时病毒滴度最高,比冻融0次的病毒滴度提高了大约1.86 lg。冻融1次比冻融0次的病毒滴度提高了约0.39 lg。冻融5次比冻融0次的病毒滴度提高了约0.71 lg。冻融7次比冻融0次的病毒滴度降低了约0.30 lg。冻融0次和1次、冻融1次和5次、PRV的病毒滴度差异不显著(P>0.05)。冻融0次和5次、冻融0次和7次、冻融1次和7次、冻融3次和5次,PRV的病毒滴度差异显著(P<0.05)。冻融0次和3次、冻融1次和3次、冻融3次和7次、冻融5次和7次,PRV的病毒滴度的差异极显著(P<0.01)(表1,图1和图2)。

表1 含宿主细胞的病毒反复冻融对病毒滴度的影响
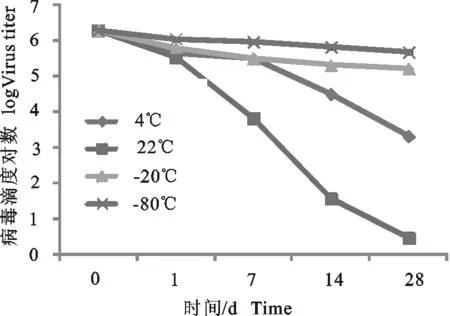
图1 含ST细胞的PPV反复冻融对病毒滴度的影响

图2 含Vero细胞的PRV反复冻融对病毒滴度的影响
2.2 猪细小病毒液的保存期试验结果
不同保存温度和时间PPV病毒滴度的检测结果见表2。各个检测时间点病毒滴度与初始结果比较,在-80℃保存条件下,经过了1 d猪细小病毒与初始病毒滴度(6.29 lg)相比,差异有统计学意义(P<0.05);在1周~4周,猪细小病毒与初始病毒滴度(6.29 lg)相比,具有极显著差异(P<0.01)。在-20℃保存条件下储存1 d~4周,猪细小病毒与初始病毒滴度(6.29 lg)相比,具有极显著差异(P<0.01)。在4℃保存条件下储存1 d~4周,猪细小病毒与初始病毒滴度(6.29 lg)相比,具有极显著差异(P<0.01)。在22℃保存条件下储存1 d~4周之后,猪细小病毒与初始病毒滴度(6.29 lg)相比,具有极显著差异(P<0.01)(图3)。
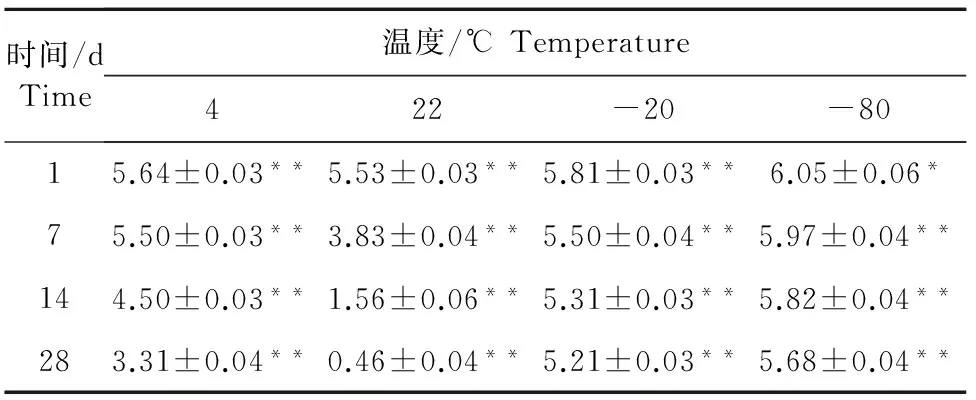
表2 猪细小病毒液的保存期试验
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
Note:*Means significant difference(P<0.05);**Means extremely significant difference(P<0.01).
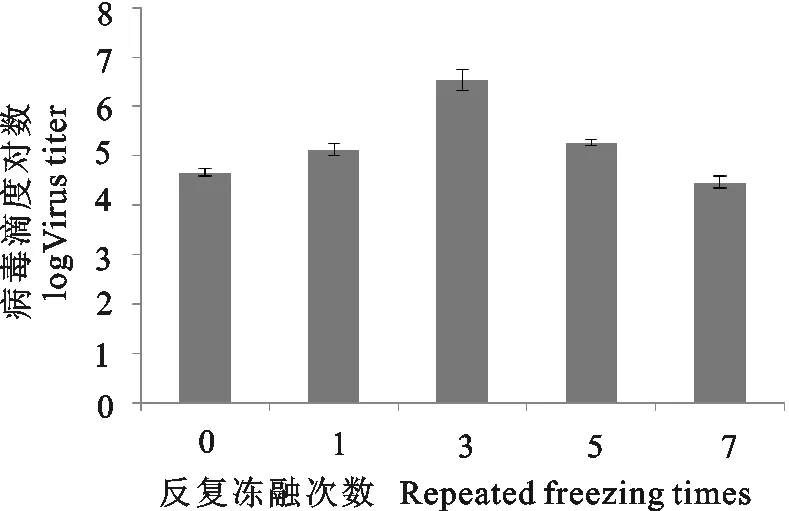
图3 猪细小病毒的病毒滴度随温度变化
2.3 伪狂犬病病毒液的保存期试验结果
经过不同的保存温度和时间,PRV滴度的TCID50检测结果见表3。各个检测时间点病毒滴度与初始结果比较,在-20℃和-80℃保存条件下,经过了1 d~1周伪狂犬病病毒滴度与初始病毒滴度(8.00 lg)相比,差异不显著(P>0.05);在2周~4周之后,伪狂犬病病毒滴度与初始病毒滴度(8.00 lg)相比,差异极显著(P<0.01)。在4℃保存条件下,经过了1 d~4周伪狂犬病病毒滴度与初始病毒滴度(8.00 lg)相比,差异极显著(P<0.01)。在22℃保存条件下,在1周~4周伪狂犬病病毒与初始病毒滴度(8.00 lg)相比,差异极显著(P<0.01)(图4)。
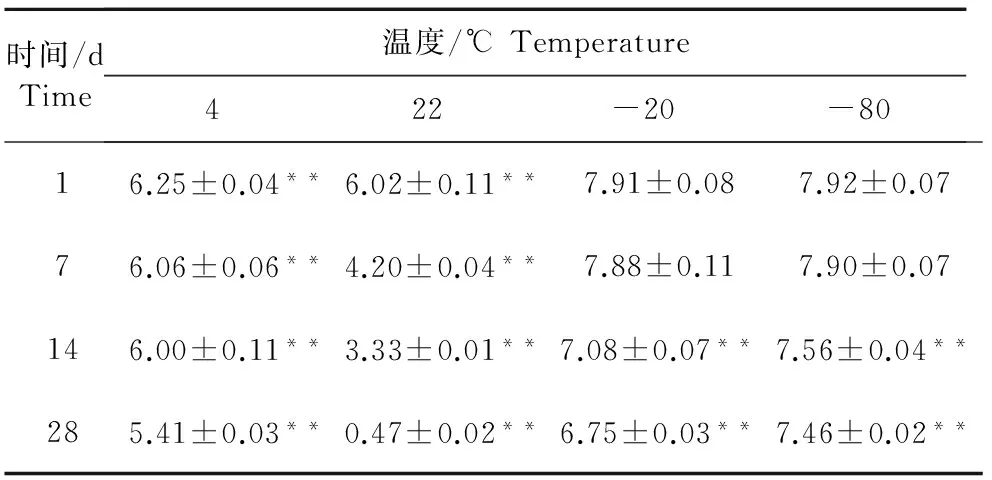
表3 伪狂犬病病毒液的保存期试验
注:**表示差异极显著(P<0.01)。
Note:**Means extremely significant difference(P<0.01).

图4 伪狂犬病病毒的病毒滴度随温度变化
3 讨论
在病毒的收集过程中,病毒的冻融次数是影响病毒滴度的关键因素。一般情况下冻融3次可以提高病毒的滴度约1.80 lg,这可能与冻融可以使吸附在宿主细胞体内的病毒释放有关。但不是冻融次数越多病毒滴度越高,在冻融5次时即出现病毒滴度下降的趋势,冻融7次甚至出现了比冻融0次的滴度还低的情况,这可能是由于宿主细胞中的病毒已经完全释放,而之后的冻融操作会降低上清液中的病毒滴度所造成的。
廖焕兰等[14]与本试验的探讨对象不同,他们旨在探讨反复冻融次数对不含宿主细胞的人乳头瘤病毒DNA载量的影响,其结果显示经过冻融1、5、10次的人乳头瘤病毒的DNA载量与原初始结果比较,差异均无统计学意义。而本试验的探讨对象是含宿主细胞的病毒,且本试验的结果显示,含宿主细胞的病毒经过3次冻融可以使病毒滴度提高至少1.8 lg。对于猪细小病毒而言,冻融1、3、5次均与冻融0次的病毒滴度有显著性差异,而冻融7次与冻融0次的病毒滴度没有显著性差异。对于伪狂犬病病毒而言,冻融3、5、7次均与冻融0次的病毒滴度有显著性差异,而冻融1次与冻融0次的病毒滴度没有显著性差异。造成这样的原因可能与猪细小病毒是隐性感染特质有关。
在实际生产、运输、储存、使用过程中影响病毒滴度的因素之中,温度是一个非常重要的因素。不同保存温度会对病毒滴度造成一定的影响。一般情况下,温度越低,病毒滴度的变化越小,故病毒在较低的温度下可保存更长的时间。
张苗苗等[15]的保存期试验结果表明,伪狂犬病病毒液在2℃~8℃至少可存放3个月,但在-20℃以下存放病毒滴度下降较快。这与本试验中所得出的结果不同,笔者在4℃保存条件下,放置了1 d~4周的伪狂犬病病毒滴度与初始病毒滴度相比,差异极显著(P<0.01),而在-20℃放置1 d~1周伪狂犬病病毒滴度与初始病毒滴度相比差异没有统计学意义,病毒滴度的变化不大。邬君等[16]还研究了在病毒液中加入甘油和MgCl2的情况,他们认为甘油和MgCl2对病毒载体的活性影响不大。笔者认为甘油可作为微生物冻存的保护剂,它的加入是允许的,在病毒的培养过程中也不需要去除。
本试验研究发现,猪细小病毒、伪狂犬病病毒对温度都比较敏感。猪细小病毒在-80℃温度下储存病毒滴度虽然稍有下降,但是与初始病毒滴度相比变化不大。猪细小病毒在-20℃温度下储存病毒滴度虽然有所下降,但是病毒滴度下降的速度比在4℃和22℃下降的慢,所以4℃和22℃只能作为猪细小病毒的短期储存温度(图1)。伪狂犬病病毒在-20℃和-80℃温度下储存1周内病毒滴度没有明显的变化,从第2周开始病毒滴度有所下降,但是病毒滴度变化不大;但是在-80℃温度保存的病毒滴度下降的速度比在-20℃温度的慢些(图2)。在22℃温度下储存4周,就已经完全丧失毒力、失去感染力,即使是病毒毒力很强、侵染能力很强的伪狂犬病病毒(8.00 lg)也不例外。总的来说,-20℃和-80℃对病毒的保存来说是一个相对比较好的保存温度,温度越低,对病毒的保存越有利。但是如果要保存更长时间,如几年甚至十几年,则需要用真空冷冻干燥法将病毒制成冻干粉剂,一般会在病毒冻干时加入50 g/L蔗糖。在某种意义上,病毒的保存与细胞的保存方法相似。但是与病毒保存方式不同的是,细胞一般是在液氮中可储存长达数年,而且细胞冻存液中需要加入甘油或者DMSO作为保护剂。
综上所述,在培养病毒时,研究者可用反复冻融3次的方法将病毒的滴度提高至少1.80 lg以上,避免将弃去宿主细胞之后收集的病毒进行反复冻融,以免降低病毒滴度。
[1] 许英民.猪细小病毒流行特点及其防制措施[J].兽医导刊,2015(5):57-58.
[2] Xiao C T,Halbur P G,Opriessning T.Molecular evolutionary genetic analysis of emerging parvoviruses identified in pigs[J].Infect Genet Evol,2013,16(2):369-376.
[3] Ni J,Qiao C,Xue H,et al.Identification and genomic characterization of a novel porcine parvovirus(PPV6) in China[J].Virol J,2014,11(1):1-8.
[4] Antonis A F G,Bruschke C J M,Paloma R,et al.A novel recombinant virus-like particle vaccine for prevention of porcine parvovirus-induced reproductive failure[J].Vaccine,2006,24(26):5481-5490.
[5] 殷 震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:1150-1155.
[6] 潘雪珠,刘洪云,严仲烈,等.猪细小病毒S-1毒株的分离和鉴定[J].上海畜牧兽医通讯,1983(1):1-3.
[7] 张婉华,朱永军,张春玲,等.猪细小病毒的分离与鉴定[J].上海农业学报,2014,30(6):20-23.
[8] 王 冠,代小芳,谢之景.猪细小病毒的研究进展[J].山东畜牧兽医,2012,33(1):78-80.
[9] Mettenleiter T C.Immunobiolgy of pseudorabies (Aujeszky's disease)[J].Vet Immunol Immunopathol,1996,54(1-4):221-229.
[10] Pedersen K,Bevins S N,Baroch J A,et al.Pseudorabies in feral swine in the United States,2009-2012 [J].J Wildl Dis,2013,49(3):709-713.
[11] 祖立闯,王金良,苗立中,等.猪伪狂犬病常用诊断方法概述[J].养猪,2013(4):124-127.
[12] Chang H T,Liu H M,Guo Z D,et al.Investigation of etiology of massive infection with porcine pseudorabies virus in Henan and neighboring provinces[J].Bing Du Xue Bao,2014,30(4):441-449.
[13] 魏战勇,崔保安,黄克和,等.猪细小病毒在PK细胞中的增殖过程[J].中国兽医学报,2005,25(5):453-455.
[14] 廖焕兰,周妙姬,冯 辉,等.不同保存时间和反复冻融对人乳头瘤病毒DNA检测结果的影响[J].检验医学与临床,2014,11(21):3024-3025.
[15] 张苗苗,王 丹.伪狂犬病病毒HB-98株不同保存条件下病毒滴度的比较[J].动物医学进展,2012,33(11):77-79.
[16] 邬 君,陈 骁,陈 璇,等.不同保存条件对病毒载体活性及对类癌细胞杀伤的影响[J].广东药学院学报,2014,30(2):228-231.

