用恒温热重法测定 1-己基-3-甲基咪唑苏氨酸离子液体[C6mim][Thr]蒸汽压和蒸发焓
佟静,屈晔,井立强,刘璐,刘春辉
辽宁大学化学院,沈阳 110036
1 引言
离子液体(IL)作为一类全新的绿色溶剂体系被称为“未来的绿色设计溶剂”,因为它有特殊的物化性质,在众多领域有巨大的应用潜力1–3。2006年寇元教授4以及Fukumoto5等人利用天然氨基酸合成出一系列易被生物降解的、对环境更加友好的氨基酸离子液体(AAIL),受到学术界和产业界的高度重视6–8。
离子液体最有吸引力的特征之一是在室温下它的蒸气压可忽略不计。然而,在许多实际应用中,必须在较高的温度下使用IL,这时它们的蒸气压已经接近几个帕斯卡,在长期使用中再不能忽略因蒸汽压而造成的IL损失9,10,从而激发了人们研究离子液体蒸发过程的兴趣。蒸发焓和蒸汽压不仅是氨基酸离子液体在实际应用中不可或缺的基础数据,也是发展液体理论和量子化学计算的重要参数。实验测定离子液体蒸汽压和蒸发焓是一项十分辛苦并具有挑战性的工作,这是因为常温下离子液体的蒸汽压极低,致使大部分传统的测量实验技术都不适用。为了应对挑战,最近几年已有人开发了专门测定离子液体的蒸发焓的新方法11–15。在这些新方法中,恒温热重法基于现代高精度、高度自动化的热重分析仪,是一种快速测定蒸发焓和蒸汽压的有效方法,不仅适用于离子液体,也适用于低蒸汽压的其他物质,不仅对化学、化工领域有重要意义,同时还直接关系到无线电、电子、冶金、医药、环保等科技领域的研究和设计。我们用这种方法测定离子液体的蒸发焓16,17,并提出了离子液体蒸发焓模型和摩尔表面自由能新热力学函数,从理论上证明了白俄罗斯科学家Kabo18的蒸发焓经验方程的合理性。作为我们研究工作的继续19,20,本文合成了AAIL 1-己基-3-甲基咪唑苏氨酸盐[C6mim][Thr],并用1H NMR和13C NMR谱表征它的结构。以苯甲酸为参考物质,用恒温热重法确定了AAIL [C6mim][Thr]的蒸汽压和蒸发焓,讨论了离子液体蒸发过程的各个热力学参数。
2 实验部分
2.1 试剂
从国药集团化学试剂公司购买的717型阴离子交换树脂用常规方法活化后备用。其他试剂的来源和纯度都列入表1中。
2.2 离子液体[C6mim][Thr]的制备
应用Fukumoto等人5的中和法制备了AAIL[C6mim][Thr],详细过程已在前文8,16中叙述。分别用1H NMR和13C NMR谱进行了表征 (见Suporting Information中图S1和S2)。 差式扫描量热(DSC)数据是在−100–80 °C温度区间获得的, 先保持样品在−90 °C平衡5 min, 而后以10 °C·min−1的速率升温至80 °C。从DSC谱图(见Suporting Information中图S3)可见,[C6mim][Thr]没有明确的熔点, 只有玻璃化转变温度(Tg= −54.87 °C), 这一点与文献5中报道的氨基酸离子液体十分类似。合成的离子液体的含水量用ZSD-2型Karl Fischer法水份滴定仪测定,其质量分数(w)为(0.386 ± 0.01)%。
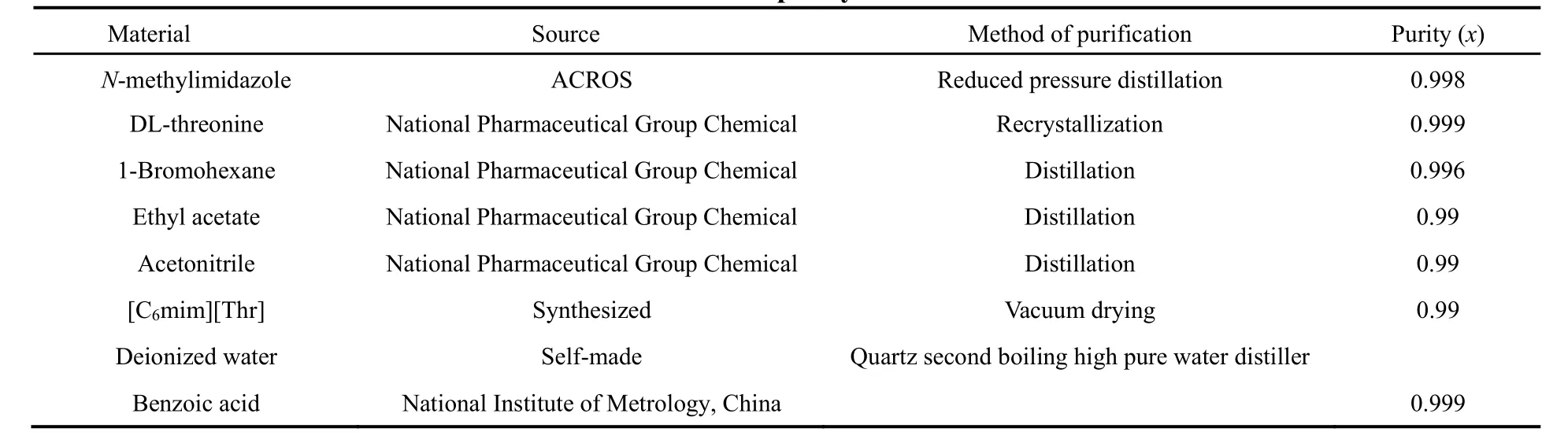
表1 试剂的来源和纯度Table 1 Source and purity of the materials.
2.3 AAIL [C6mim][Thr]和苯甲酸的恒温热重分析
首先,按照Stewart方法21用铟、锡、铋和铅等标准物质校正了梅特勒-托利多仪器公司生产的TGA/SDTA851e热重分析仪,然后对AAIL[C6mim][Thr]和苯甲酸分别进行了恒温热重分析实验。仪器的温度精度为±0.2 K, 热重天平的灵敏度为±0.01 μg。根据离子液体[C6mim][Thr]的传统热重曲线(样品重量12 mg,升温速率10 K·min−1)确定恒温热重实验的恒温区间,参考Verevkin等人18推荐的优化实验条件和我们的经验15,16,把大约为50 mg样品放入圆筒型铂金坩埚内,以氩气作为载气,其流速为100 mL·min−1,在每个恒温段持续时间内,样品的损失量控制在1.2到0.3 mg之间,恒温段之间的温度爬升速度为20 K·min−1。苯甲酸的恒温区间根据苯甲酸的蒸汽压文献值确定,把苯甲酸样品放入上述实验用过的坩埚中,苯甲酸热重实验方案的其他内容与AAIL [C6mim][Thr]方案类似。
根据AAIL [C6mim][Thr]和苯甲酸恒温热重实验数据,在指定温度下分别画出它们的(m0− m)对(t − t0)图(见图1),可得到一系列很好的直线,其中m为样品质量,t是时间,下角标0表示初始状态。分别将(m0− m)对(t − t0)作线性拟合,拟合相关系数的平方都超过0.999,其高度的线性相关性说明恒温热重的质量损失是严格的零级动力学过程,即离子液体的蒸发和苯甲酸的升华都是零级动力学过程22。将不同温度下得到的AAIL[C6mim][Thr]和苯甲酸直线方程的斜率分别列入表2中。在以上的实验步骤操作中,严格保证了样品的纯度,没有使样品受到其他有机物的污染。
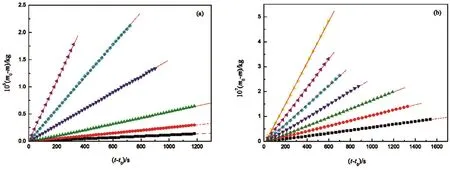
图1 AAIL [C6mim][Thr]和苯甲酸的(m0 − m)分别对(t − t0)作图
3 结果和讨论
3.1 离子液体[C6mim][Thr]的蒸汽压
Price23指出液体在真空中自由蒸发可以用Langmuir 方程描述:

其中–dm/dt是单位蒸发表面积质量损失速率,p是蒸汽压,M是蒸汽的摩尔质量(M = 285.38 g·mol−1),R是气体常数,T是热力学温标,α是蒸发系数,在真空自由蒸发过程通常假设α =1。然而,在恒温热重实验条件下,不能再假设α = 1,需借助已知蒸汽压的参考物质,例如苯甲酸,用它的热重实验来确定α值。为此,重排Langmuir 方程:

其中k = (2πR)1/2/α,ν = –dm/dt(T/M)1/2。将苯甲酸蒸汽压的文献值列入表2,供确定k值使用。利用方程(2)求出每个温度的k值,然后取平均值并将其也列入表2中。然后根据AAIL [C6mim][Thr]热重实验数据计算得到ν值,进而利用方程(2)计算不同实验温度下的离子液体蒸汽压并将其列入表2中。
3.2 AAIL离子液体[C6mim][Thr]的蒸发焓ΔglHɵm

表 2 AAIL [C6mim][Thr]和苯甲酸的蒸汽压(p), −dm/dt, ln[T1/2·(−dm/dt)]和 ν的值Table 2 Values of vapor pressure(p), −dm/dt, ln[T1/2·(−dm/dt)], and ν for AAIL [C6mim][Thr] at 413.15–463.15 K and for benzoic acid at 343.15–383.15 K.

图 2 AAIL [C6mim][Thr]的 ln ν vs 1/T 作图
根据Clausius–Clapeyron方程,蒸汽压p和摩尔蒸发焓之间关系为:

其中c为经验常数。将方程(2)代入(3)中则得到:
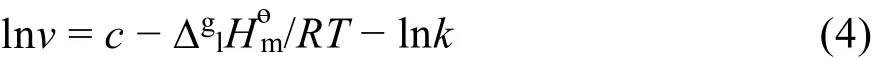
这样一来,利用AAIL [C6mim][Thr]热重实验得到的lnν值对1/T作图,能得到一条很好直线(见图2)。将lnν对1/T作线性拟合,拟合相关系数的平方为0.998,标准偏差为0.08429,由直线方程的斜率SL= −1.548 × 104K 可计算平均实验温度Tav(Tav= (Ti)/n)下的蒸发焓(Tav):

由此计算得到实验平均温度Tav= 438.15 K下的蒸发焓Tav) = (128.7 ± 6.0 kJ·mol−1)。
为了便于与其他方法测定的蒸发焓比较,需要将平均测定温度下的蒸发焓转换成参考温度298.15 K下的蒸发焓(298),转换方程为:

计算离子液体气态和液态的恒压热容差所需数据都列在Supporting Information中的表S1中27。利用方程(7)计算得到= −70.8 J·K−1·mol−1,进而根据方程(6)能够将Hm(Tav)转换成298.15 K的AAIL [C6mim][Thr]蒸发焓(298) = 138.4 kJ·mol−1。比我们前文28测得[C4mim][Thr]蒸发焓(298) = 130.0 kJ·mol−1大了8.4 kJ·mol−1,即每个咪唑支链的亚甲基(—CH2—)对蒸发焓的贡献—CH2—) = 4.2 kJ·mol−1,这个值正好在Archer等人29推荐的ΔglHɵm(—CH2—) = 4.85 ± 0.3 kJ·mol−1和 Zaitsau等人25推荐的ΔglHɵm(—CH2—) =3.89 kJ·mol−1之间,说明本文的结果有一定的合理性。
3.3 离子液体蒸发焓模型和摩尔表面自由能
2014年我们提出了非质子离子液体蒸发焓模型16,其工作方程为:

其中是表面张力,ΔglHɵm是摩尔蒸发焓,N 是Avogadro常数,Δε(kin)(J)为一对正负离子的气态和液态的动能差,x是离子液体在表面的配位数与体相配位数之比。佟静等人16的模型成功地从理论上证明了Kabo经验方程正确。如果用N1/3乘以方程(10)中各项,则得到:

其中 g = (γV2/3N1/3)为一个新的热力学函数,即摩尔表面自由能,NΔε(kin)为离子液体气态和液态的摩尔动能差。也能将方程(11)改写成:

其中A和B为经验常数。在前文28中利用离子液体[C2mim][Thr]和[C4mim][Thr]的摩尔表面自由能和蒸发焓实验数据,我们解出了A = 8.155 kJ·mol−1和B = 0.0325,并进一步利用方程(12)预测了AAIL[C6mim][Thr]的蒸发焓ɵ136.8 kJ·mol−1,与本文实验值相比只小1.6 kJ·mol−1,也小于恒温热重法的实验误差3.0 kJ·mol−1,说明我们提出的模型有一定的合理性。
3.4 离子液体[C6mim][Thr]的蒸发熵
根据Clausius-Clapeyron方程,可估算离子液体假想的正常沸点Tb/K:
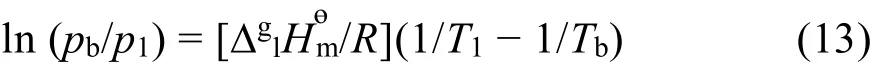
其中pb和p1分别为在正常沸点Tb和实验温度的蒸气压,pb= 101.325 kPa,为离子液体的蒸发焓。按方程(13)计算得到了离子液体[C6mim][Thr]假想的正常沸点Tb= 522.07 K。
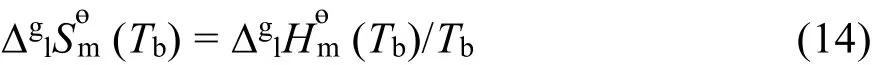

表 3 不同温度下离子液体[C6mim][Thr]蒸发过程的热力学参数T),T),S(T)T)的值和蒸汽压Table 3T),S(T), (T), (T) and vapor pressure of [C6mim][Thr] during the evaporationprocess at 298.15–500.15 K and at T = 522 K.

表 3 不同温度下离子液体[C6mim][Thr]蒸发过程的热力学参数T),T),S(T)T)的值和蒸汽压Table 3T),S(T), (T), (T) and vapor pressure of [C6mim][Thr] during the evaporationprocess at 298.15–500.15 K and at T = 522 K.
(T) is evaporation enthalpy,T) is evaporation entropy(T) is evaporation Gibbs free energy.
T/K ΔglHɵm(T)/(kJ·mol−1) ΔglSɵm(T)/(J·K−1·mol−1) TΔglSɵm(T)/(kJ·mol−1) ΔglGɵm(T)/(kJ·mol−1) p(T)/Pa 298.15 138.4 274.4 81.82 56.58 4.045 × 10−6 320.15 136.8 269.4 86.25 50.60 2.352 × 10−4 340.15 135.4 265.1 90.18 45.26 5.756 × 10−3 360.15 134.0 261.1 94.02 40.00 9.522 × 10−2 380.15 132.6 257.2 97.79 34.81 1.133 400.15 131.2 253.6 101.5 29.71 10.19 420.15 129.8 250.2 105.1 24.67 72.05 440.15 128.4 246.9 108.7 19.70 4.141 × 102 460.15 126.9 243.7 112.2 14.79 1.987 × 103 480.15 125.5 240.7 115.6 9.948 8.144 × 103 500.15 124.1 237.8 118.9 5.163 2.905 × 104 522.07 122.6 234.8 122.6 0 1.013 × 105
在298 K下,离子液体蒸发过程的Gibbs自由能变化ΔvapG(298):

将方程(15)和(16)中,298.15 K换成任意温度T,我们可以估算任何温度下的AAIL [C6mim][Thr]蒸发过程的自由能变化(T)、熵变T)和T), 另外,(T)可按方程(6)计算,把得到的这些数据都列入表3中。将方程(13)中的T1换成任意温度T,就可用这个方程计算不同温度下AAIL [C6mim][Thr]的蒸汽压,把计算得到的蒸汽压数据也列入表3中。图3为(T) vs T,(T) vs T、(T) vs T和p vs T变化曲线。从表3和图3可见,AAIL [C6mim][Thr]的蒸发自由能随温度升高而减小,到达假想沸点时为零,而蒸发熵随温度升高而增大,是离子液体蒸发过程的推动力;还计算了不同温度下AAIL [C6mim][Thr]的蒸气压,在室温附近蒸气压几乎为零,然而蒸汽压随温度升高呈指数增长,当温度接近假想正常沸点,蒸汽压接近一个大气压。
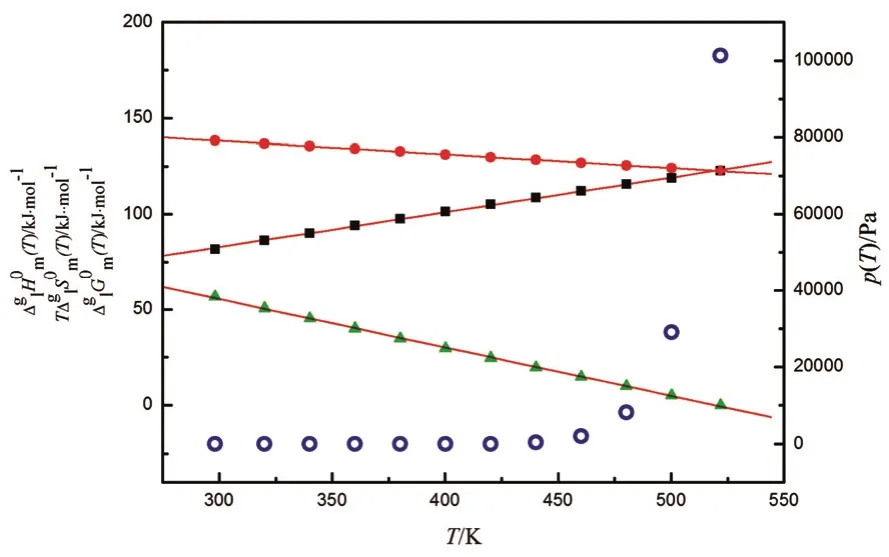
图 3 不同温度下的离子液体[C6mim][Thr]的(T)、(T)、(T) vs T 和 p(T) vs T 作图
4 结论
制备并用NMR法和元素分析法表征了离子液体 [C6mim][Thr]。以苯甲酸为参考物质,用恒温热重法测定了该离子液体的蒸汽压和298.15 K下的蒸发焓ΔglHɵm(298) = 138.4 kJ·mol−1,比用佟静等人提出的离子液体蒸发焓模型预测值只大1.6 kJ·mol−1,小于通常恒温热重法3.0 kJ·mol−1的实验误差,说明这个模型有一定的合理性。根据Clausius-Clapeyron方程,用[C6mim][Thr]蒸汽压确定了该离子液体的假想正常沸点Tb和沸点温度下的蒸发熵,进而计算了不同温度下[C6mim][Thr]的蒸发焓、蒸发熵和蒸发自由能。计算结果表明,离子液体的蒸发自由能随温度升高而减小,到达假想沸点时为零,而蒸发熵随温度升高而增大,是离子液体蒸发过程的推动力。本工作的结果表明,恒温热重法是基于现代高精度、高度自动化的热重分析仪,是一种快速测定离子液体蒸发焓和蒸汽压的有效方法,不仅适用于离子液体,也适用于低蒸汽压的其他物质。对化学、化工领域有重要意义。
Supporting Information:Details of1H NMR of[C6mim][Thr], analysis of 1H NMR spectrum for[C6mim][Thr],13C NMR of [C6mim][Thr], analysis of 1C NMR for [C6mim][Thr], elemental analysis of [C6mim][Thr],and DSC of [C6mim][Thr] were given. Data needed in the calculation of ΔglCpɵm/(J·K-1·mol-1) for [C6mim][Thr] at p = 0.1 MPa have been included. This information is available free of charge via the internet at http://www.whxb.pku.edu.cn.
(1) Zhang, S. J.; Liu, X. M. Ionic Liquid: From Basic Research to Industrial Applications; Science Press: Beijing, 2006. [张锁江, 吕兴梅. 离子液体: 从基础研究到工业应用. 北京: 科学出版社, 2006.]
(2) Armand, M.; Endres, F.; MacFarlane, D. R.; Ohno, H.; Scrosati, B.Nat. Mater. 2009, 8, 621. doi: 10.1038/NMAT2448
(3) Bu, X. X.; Fan, B. H.; Wei, J.; Xing, N. N.; Ma, X. X.; Guan, W. Acta Phys. -Chim. Sin. 2016, 32, 267. [卜晓雪, 樊本汉, 魏杰, 邢楠楠,马晓雪, 关伟. 物理化学学报, 2016, 32, 267.]doi:10.3866/PKU.WHXB201510303
(4) Tao, G. H.; He, L.; Liu, W. S.; Xu, L.; Xiong, W.; Wang, T.; Kou, Y.Green Chem. 2006, 8, 639. doi: 10.1039/B600813E
(5) Fukumoto, K.; Yoshizawa, M.; Ohno, H. J. Am. Chem. Soc. 2005, 127,2398. doi: 10.1021/ja043451i
(6) Zhang, S.; Wang, J.; Lu, X.; Zhou, Q. Structures and Interactions of Ionic Liquids; Springer: Heidelberg, 2014.
(7) Fang, D. W.; Tong, J.; Guan, W.; Wang, H.; Yang, J. Z. J. Phys. Chem.B 2010, 114, 13808. doi: 10.1021/jp107452q
(8) Tong, J.; Song, B.; Wang, C. X.; Li, L.; Guan, W.; Fang, D. W.; Yang,J. Z. Ind. Eng. Chem. Res. 2011, 50, 2418. doi: 10.1021/ie101903t
(9) Earle, M. J.; Esperanc, J. M. S. S.; Gilea, M. A.; Lopes, J. N. C. ;Rebelo, L. P. N.; Magee, J. W.; Seddon, K. R.; Widegren, J. A.Nature 2006, 439, 831. doi: 10.1038/nature04451
(10) Deyko, A.; Lovelock, K. R.; Corfield, J. A.; Taylor, A. W.; Gooden, P.N.; Villar-Garcia, I. J.; Licence, P.; Jones, R. G.; Krasovskiy, V. G.;Chernikova, E. A.; et al. Phys. Chem. Chem. Phys. 2009, 11, 8544.doi: 10.1039/b908209c
(11) Esperanc, J. M. S. S.; Lopes, J. N. C.; Tariq, M.; Santos, L. M. N. B.F.; Magee, J. W.; Rebelo, L. P. N. J. Chem. Eng. Data 2010, 55, 3.doi: 10.1021/je900458w
(12) Zaitsau, D. H.; Kabo, G. J.; Strechan, A. A.; Paulechka, Y. U.;Tschersich, A.; Verevkin, S. P.; Heintz, A. J. Chem. Phys. A 2006,110, 7303. doi: 10.1021/jp060896f
(13) Luo, H.; Baker, G. A.; Dai, S. J. Chem. Phys. B 2008, 112, 10077.doi: 10.1021/jp805340f
(14) Heym, F.; Etzold, B. J. M.; Kern, C.; Jess, A. Green Chem. 2011, 13,1453. doi: 10.1039/C0GC00876A
(15) Verevkin, S. P.; Ralys, R. V.; Zaitsau, D. H.; Emel’yanenko, V. N.;Schick, C. Thermochim. Acta 2012, 538, 55.doi: 10.1016/j.tca.2012.03.018
(16) Tong, J.; Yang, H. X.; Liu, R. J.; Li, C.; Xia, L. X.; Yang. J. Z.J. Phys. Chem. B 2014, 118, 12972. doi: 10.1021/jp509240w
(17) Hong, M.; Liu, R. J.; Yang, H. X.; Guan, W.; Tong, J.; Yang, J. Z. J.Chem. Thermodyn. 2014, 70, 214. doi: 10.1016/j.jct.2013.11.004
(18) Zaitsau, D. H.; Kabo, G. J.; Strechan, A. A.; Paulechka, Y. U.;Tschersich, A.; Verevkin, S. P.; Heintz, A. J. Chem. Phys. A 2006,110, 7303. doi: 10.1021/jp060896f
(19) Tong, J.; Chen, T. F.; Zhang, D.; Wang, L. F.; Tong, J.; Yang, J. Z.Acta Phys. -Chim. Sin. 2016, 32, 1161. [佟静, 陈滕飞, 张朵, 王林富, 佟健, 杨家振. 物理化学学报,2016, 32, 1161.]doi: 10.3866/PKU.WHXB201602232
(20) Li, C.; Yang, H. X.; Liu, R. J.; Yang, Q.; Tong, J.; Yang, J. Z. Acta Phys. -Chim. Sin. 2015, 31, 11. [李驰,杨宏旭,刘入境,杨奇,佟静,杨家振. 物理化学学报,2015, 31, 11.]doi: 10.3866/PKU.WHXB201411063
(21) Stewart, L. N. In Proceedings of the Third Toronto Symposium on Thermal Analysis; McAdie, H. G. Ed.; Chemical Institute of Canada:Toronto, 1969; p. 205.
(22) Hinks, D.; Rafiq, M. I.; Price, D. M.; Montero, G. A.; Smith, B. A.Color Technol. 2003, 119, 84.doi: 10.1111/j.1478-4408.2003.tb00155.x
(23) Price, D. M. Thermochim. Acta 2001, 253, 367.doi: 10.1016/S0040-6031(00)00676-6
(24) Verevkin, S. P.; Zaitsau, D. H.; Emel’yanenko, V. N.; Yermalayeu, A.V. J. Phys. Chem. B 2013, 117, 6473. doi: 10.1021/jp311429r
(25) Zaitsau, D. H.; Yernalayeu, A. V.; Emel’yanenko, V. N.; Verevkin, S.P.; Welz-Biermann, U.; Schubert, T. Sci. China Chem. 2012, 55, 1526.doi: 10.1002/cphc.201100879
(26) Paulechka, Y. U.; Zaitsau, D. H.; Kabo, G. J. J. Mol. Liq. 2004, 115,105. doi: 10.1016/j.molliq.2004.03.002
(27) Zhang, D.; Qu, Y.; Gong, Y. Y.; Tong, J.; Fang, D. W.; Tong, J.J. Chem. Thermodyn. Submitted.
(28) Tong, J.; Liu, L.; Li, H.; Guan, W.; Chen, X. J. Chem. Thermodyn.2017, 112, 293. doi: 10.1016/j.jct.2017.05.015
(29) Archer, D. G.; Widegren, J. A.; Kirklin, D. R.; Magee, J. W. J. Chem.Eng. Data 2005, 50, 1484. doi: 10.1021/je050136i

