鞘内注射赛庚啶缓解小鼠骨癌痛
杭黎华,卫世有,徐振锴,蔡玥娇,李姝娜,彭生
(1.江苏大学附属昆山医院麻醉科,江苏昆山215300;2.上海交通大学医学院附属新华医院耳鼻喉科,上海200092;3.上海中医药大学附属第七人民医院麻醉科,上海200137)
SET domain containing lysine methyltransferase 7/9(SET7/9)是组蛋白 H3赖氨酸4甲基转移酶,可使NF-κB、STAT3等转录因子甲基化,调控基因转录[1-2]。离体研究证实,SET7/9可通过激活 NF-κB p65,促进炎症基因的表达及炎性因子的产生[3]。多项研究证实,炎性因子与骨癌痛的产生存在着密切联系[4-5]。但是,SET7/9是否参与骨癌痛的发生目前并不明确。因此,本研究拟采用行为学实验、药理学及蛋白质印迹等方法来探讨SET7/9在小鼠骨癌痛中的作用。
1 材料与方法
1.1 动物及分组
雄性C3H/HeJ小鼠88只,体质量20~25 g,购于北京维通利华实验动物技术有限公司(许可证号:SCXK2016-0001)。小鼠自由饮水、摄食,所有动物实验符合江苏大学实验动物伦理委员会的要求。实验分2部分:第1部分实验分为假手术组和骨癌痛组,每组8只小鼠;造模后观察骨癌痛小鼠机械痛敏阈值(paw withdrawlmechanical threshold,PWMT)及SET7/9在骨癌痛小鼠脊髓背角中的表达变化。第2部实验分为假手术组、骨癌痛组、骨癌痛+赛庚啶10 nmol组、骨癌痛+赛庚啶20 nmol组、骨癌痛+SET7/9 0.2μg组、骨癌痛 +SET7/9 0.2μg+赛庚啶20 nmol组(鞘内注射SET7/9 30 min后鞘内注射赛庚啶)、骨癌痛+氯苯那敏200μg组,每组8只小鼠;观察鞘内注射赛庚啶对骨癌痛小鼠痛行为学及脊髓背角SET7/9表达的影响。
1.2 小鼠骨癌痛模型的建立
按Schwei等[6]报道的方法建立小鼠骨癌痛模型。将保存于液氮罐中的NCTC 2472纤维肉瘤细胞株(美国ATCC公司)取出,迅速37℃水浴复苏,然后将其注入有培养基的离心管中,20℃低速离心5 min。细胞沉淀用培养基适当稀释后,在37℃含5%CO2的培养箱中培养。收集处于对数生长期的细胞,用α-MEM培养基悬浮肿瘤细胞,调整密度至1×107/mL,置于冰上备用。腹腔注射戊巴比妥钠(50 mg/kg)麻醉小鼠后,在左膝关节处做一个长0.5~1 cm的皮肤切口,显露股骨平台;用牙科钻沿股骨长轴方向钻孔进入股骨骨髓腔,抽取NCTC 2472肿瘤细胞悬液20μL(2×105个),由钻孔向骨髓腔中缓慢注入。注射完毕后立即采用牙科汞合金封堵穿刺孔,最后缝合切口。
预实验中通过行为学、影像学及病理学等证实,该方法制模成功率在95%左右。本研究通过观察骨癌痛小鼠PWMT,证实纳入研究的样本均制模成功。假手术组小鼠于股骨骨髓腔注射生理盐水20 μL。第二部分实验于制模手术后15 d进行鞘内注射给药。
1.3 小鼠鞘内药物注射
SET7/9抑制剂赛庚啶及氯苯那敏购自上海Sigma-Aldrich公司;SET7/9蛋白为 Abcam公司产品。赛庚啶、氯苯那敏及 SET7/9均参照 Hylden等[7]的方法进行鞘内给药。右手持25μL微量注射器与脊柱上方成20°角于L5~6间隙进针,以鼠尾出现突然侧向运动为成功标志;缓慢注药,注射时间为5 s,剂量为5μL,留针10 s。预实验中,给10只小鼠鞘内注射2%利多卡因,每只5μL,小鼠均出现双后肢瘫痪,而双前肢运动正常,阻滞持续10~20 min后,双下肢活动恢复正常,表明鞘内注射部位正确。
1.4 小鼠机械痛敏阈值的检测
采用von Frey纤毛测定小鼠PWMT[8]。小鼠于测试笼中适应30 min,采用对数级数的von Frey纤毛垂直刺激小鼠左后肢足底中部,当小鼠出现快速缩足或甩足时为阳性反应,用 up-down法[9]计算50%缩足阈值。第1部分实验检测术前1 d及术后5、7、12、15 d假手术组与骨癌痛组小鼠 PWMT;第2部分实验检测鞘内给药前(0 h)及鞘内给药后1、3、6 h各组PWMT。
1.5 蛋白质印迹法检测小鼠脊髓SET7/9的表达
鞘内注射赛庚啶组脊髓背角取材时间为鞘内注射后6 h。第一部分实验假手术组、骨癌痛组及第二部分实验骨癌痛组、骨癌痛+赛庚啶20 nmol组小鼠深麻醉后断颈处死(n=4),冰上取小鼠左侧脊髓背角L4~6节段。溶解于裂解液中,4℃,15 000×g离心15 min,取上清液。SDS-PAGE胶垂直电泳分离蛋白,PVDF转膜45 min,5%脱脂奶粉溶液与室温孵育1 h;PBST洗膜3次,每次10 min;小鼠抗SET7/9(1∶1 000,Abcam公司)、β-肌动蛋白(1∶5 000,Sigma公司)4℃孵育过夜;辣根过氧化物酶标记的兔抗鼠二抗(1∶500,碧云天生物技术公司)室温孵育1 h;滴加化学发光液反应 1 min,吸干膜上的水分,暗室曝光,图片扫描。Image J软件对图片进行灰度分析。
1.6 统计学分析
采用SPSS 17.0统计学软件进行分析,计量资料以均数±标准差(±s)表示。行为学数据采用重复测量的方差分析,蛋白质印迹实验数据采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 骨癌痛小鼠痛行为学改变
两组小鼠在15 d的观察期限内健康状况良好,两组小鼠术前1 d的PWMT差异无统计学意义(P>0.05)。与假手术组比较,骨癌痛组手术后7,12,15 d PWMT明显降低(P<0.05或 0.01);与术前1 d相比,骨癌痛组术后7,12,15 d的PWMT逐渐降低(P<0.05或0.01)。见表1。
表1 两组小鼠机械痛敏阈值的变化g,±s,n=8

表1 两组小鼠机械痛敏阈值的变化g,±s,n=8
a:P<0.05,b:P<0.01,与术前1 d比较
手术后5 d 7 d 12 d 15 d假手术组 1.93±0.51 1.83±0.49 1.90±0.52 1.87±0.49 1.8组别 术前1 d 7±0.48骨癌痛组 1.87±0.48 1.85±0.47 1.38±0.46a 0.83±0.28b 0.51±0.21b t值0.417 0.379 0.032 0.007 0.003 0.697 0.821 5.607 9.773 12.851 P值
2.2 骨癌痛小鼠脊髓背角SET7/9的表达
蛋白质印迹结果显示,术前1 d假手术组和骨癌痛组小鼠脊髓背角SET7/9的表达差异无统计学意义(P>0.05);与术后15 d假手术组或自身术前1 d相比,术后15 d骨癌痛组小鼠脊髓背角SET7/9的表达水平显著增加(P<0.01)。见图1。
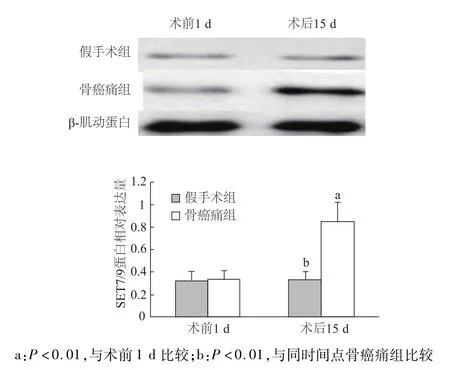
图1 骨癌痛小鼠脊髓背角SET7/9表达变化
2.3 鞘内注射赛庚啶对造模后15 d小鼠痛行为学及脊髓背角SET7/9表达的影响
由表2可见,鞘内注射前(0 h)骨癌痛各组的PWMT均明显低于假手术组(P<0.05);鞘内注射赛庚啶10、20 nmol呈剂量依赖性地增加造模手术后15 d骨癌痛小鼠的PWMT,在鞘内注射赛庚啶3 h后PWMT值达最高。与鞘内注射前0 h相比,骨癌痛 +SET7/9 0.2μg组、骨癌痛 +SET7/9 0.2μg+赛庚啶20 nmol组及骨癌痛+氯苯那敏200μg组在鞘内给药后1,3,6 h的PWMT均无明显变化(均 P>0.05)。
与骨癌痛组相比,骨癌痛+赛庚啶20 nmol组小鼠在鞘内给药6 h后脊髓背角SET7/9表达明显降低(P<0.01)。见图2。
表2 鞘内注射赛庚啶对造模手术后15 d骨癌痛小鼠机械痛敏阈值的变化g,±s,n=8

表2 鞘内注射赛庚啶对造模手术后15 d骨癌痛小鼠机械痛敏阈值的变化g,±s,n=8
a:P<0.05,与同时间点假手术组比较;b:P<0.05,与同时间点骨癌痛组比较;c:P<0.05,与自身鞘内注射前0 h比较
组别 鞘内注射前0 h 1 h 3 h 6 h F值 P值鞘内注射后假手术组 1.87±0.48 1.81±0.44 1.82±0.51 1.85±0.53 2.891 0.901骨癌痛组 0.50±0.18a 0.54±0.16a 0.52±0.17a 0.50±0.15a 3.142 0.974骨癌痛 +赛庚啶10 nmol组 0.53±0.19a 0.55±0.18a 0.96±0.24a,b,c 0.54±0.17a 3.443 0.043骨癌痛 +赛庚啶20 nmol组 0.51±0.17a 0.89±0.23a,b,c 1.53±0.41b,c 0.55±0.16a 4.761 0.001骨癌痛 +SET7/9 0.2μg组 0.52±0.17a 0.51±0.16a 0.53±0.17a 0.52±0.15a 2.761 0.837骨癌痛 +SET7/9 0.2μg+赛庚啶20 nmol组 0.51±0.18a 0.54±0.18a 0.58±0.18a 0.52±0.16a 3.004 0.887骨癌痛 +氯苯那敏200μg组 0.52±0.18a 0.52±0.14a 0.53±0.14a 0.52±0.14a 2.998 0.864 F值3.681 4.207 4.539 3.740 P值0.004 0.001 0.000 0.003

图2 鞘内注射赛庚啶对骨癌痛小鼠脊髓SET7/9表达的影响
3 讨论
表观遗传学是指基于非基因序列改变所致基因表达水平的变化,即通过组蛋白修饰、DNA甲基化及非编码 RNA调控等方式对基因的表达进行调控[10]。组蛋白修饰包括甲基化、乙酰化、磷酸化等。研究表明,表观遗传学参与慢性疼痛的调控过程[11]。SET7/9是催化染色质组蛋白H3K4单甲基化的关键酶。Laumet等[12]研究发现,在神经病理性疼痛模型中,组蛋白甲基转移酶G9a在背根神经节中表达明显增加,鞘内注射G9a抑制剂UNC0638可明显减轻小鼠的痛觉过敏。本研究结果显示,骨癌痛小鼠脊髓背角SET7/9的表达显著增加,鞘内注射SET7/9抑制剂赛庚啶可明显减轻小鼠骨癌痛且显著降低脊髓背角SET7/9的表达水平,提示SET7/9可能参与小鼠骨癌痛的发展过程。
本实验中发现,鞘内注射赛庚啶20 nmol可明显缓解小鼠骨癌痛,鞘内预先注射SET7/9 0.2μg对骨癌痛小鼠痛行为学没有影响,但却可抵消20 nmol赛庚啶缓解骨癌痛的作用,提示SET7/9在骨癌痛中起重要作用。预实验中,我们发现鞘内注射赛庚啶60 nmol对自主小鼠的痛行为学没有明显影响,故本实验中选择赛庚啶10、20 nmol鞘内注射,应可排除赛庚啶本身的药理作用对小鼠痛行为学的干扰,使实验结果更为可靠。这一观察结果与Suh等[13]的研究相似,该研究证实鞘内注射赛庚啶0.31~62 nmol对自主小鼠痛行为学没有影响。鞘内注射是研究药物作用于脊髓的好方法[7],但鞘内注射赛庚啶不可避免地也可作用于背根神经节。因此,本研究结果显示赛庚啶可减轻骨癌痛,也可能包含背根神经节SET7/9参与骨癌痛的外周机制。赛庚啶除了对SET7/9有抑制作用外,还有潜在的拮抗H1受体的作用。研究发现,鞘内注射足量拮抗H1受体作用的氯苯那敏 200μg[14],对骨癌痛小鼠痛行为学没有明显影响,提示赛庚啶减轻骨癌痛主要是通过抑制SET7/9。综上所述,脊髓SET7/9可能参与小鼠骨癌痛的发展过程。
[参考文献]
[1]Takemoto Y,Ito A,Niwa H,et al.Identification of cyproheptadine as an inhibitor of SET domain containing lysinemethyltransferase 7/9(Set7/9)that regulates estrogen-dependent transcription[J].JMed Chem,2016,59(8):3650-3660.
[2]Son MJ,Kim WK,Park A,et al.Set7/9,a methyltransferase,regulates the thermogenic program during brown adipocyte differentiation through themodulation of p53 acetylation[J].Mol Cell Endocrinol,2016,431:46-53.
[3]Li Y,Reddy MA,Miao F,etal.Role of the histone H3 lysine 4 methyltransferase,SET7/9,in the regulation of NF-κB-dependent inflammatory genes.Relevance to diabetes and inflammation[J].J Biol Chem,2008,283(39):26771-26781.
[4]Zhou YQ,Liu Z,Liu ZH,et al.Interleukin-6:an emerging regulator of pathological pain[J].J Neuroinflammation,2016,13(1):141.
[5]Lu C,Liu Y,Sun B,et al.Intrathecal injection of JWH-015 attenuates bone cancer pain via time-dependentmodification of pro-inflammatory cytokines expression and astrocytes activity in spinal cord[J].Inflammation,2015,38(5):1880-1890.
[6]Schwei MJ,Honore P,Rogers SD,etal.Neurochemical and cellular reorganization of the spinal cord in amurine model of bone cancer pain[J].J Neurosci,1999,19(24):10886-10897.
[7]Hylden JL,Wilcox GL.Intrathecal morphine in mice:a new technique[J].Eur J Pharmacol,1980,67(2/3):313-316.
[8]Hang LH,Li SN,Dan X,et al.Involvement of spinal CCR5/PKCγsignaling pathway in the maintenance of cancer-induced bone pain[J].Neurochem Res,2017,42(2):563-571.
[9]Dixon WJ.Efficient analysis of experimental observations[J].Annu Rev Pharmacol Toxicol,1980,20:441-462.
[10]Song Y,Wu F,Wu J.Targeting histonemethylation for cancer therapy:enzymes,inhibitors,biological activity and perspectives[J]. J Hematol Oncol,2016,9(1):49.
[11]Liang L,Lutz BM,Bekker A,et al.Epigenetic regulation of chronic pain[J].Epigenomics,2015,7(2):235-245.
[12]Laumet G,Garriga J,Chen SR,et al.G9a is essential for epigenetic silencing of K+channel genes in acute-tochronic pain transition[J].Nat Neurosci,2015,18(12):1746-1755.
[13]Suh HW,Chung KM,Kim YH,et al.Effects of histamine receptor antagonists injected intrathecally on antinociception induced by opioids administered intracerebroventricularly in themouse[J].Neuropeptides,1999,33(2):121-129.
[14]Zhang L,Jiang GY,Song NJ,et al.Extracellular signal-regulated kinase(ERK)activation is required for itch sensation in the spinal cord[J].Mol Brain,2014,7:25.

