细粒棘球蚴特异性诊断抗原Eg-07279的制备及免疫原性研究
,,,, ,
细粒棘球蚴病又称包虫病(echinococcosis),是由细粒棘球绦虫的蚴虫寄生于人体及一些哺乳动物体内所致的人兽共患寄生虫疾病,其中95%以上为囊型包虫病(cystisechinococcusis,CE)[1]。我国将其列为二类动物疫病,世界动物卫生组织将其列为B类动物疾病[2]。该病成世界性分布,我国是包虫病发病率最高的国家之一,人群患病率为0.6%~4.5%, 在23个省区发现原发性病例,流行分布面积占全国总面积的44%[3-4],主要分布于西部7省(新疆、甘肃、宁夏、青海、四川、内蒙和西藏),对人体健康产生一定的威胁,对经济发展产生较大阻碍,尤其以牧区和半牧区最为严重[5]。
细粒棘球蚴为双宿主寄生,其在中间宿主人体内的感染周期较长且过程复杂,包括虫卵、六钩蚴、原头蚴等多个生长阶段,中间宿主吞食虫卵或孕节后引发感染,在肝或肺等器官形成包囊,对机体产生损伤[6]。然而,目前包虫病治疗的有效手段主要是临床手术,若能在发病早期进行诊断可有效地降低对人体的损伤,因此找到病原体发育早期的特异性诊断抗原将可以有效地进行包虫病早期诊断。本研究通过对细粒棘球绦虫不同阶段表达谱的差异分析,筛选出的优势诊断抗原分子Eg-07279,该分子能够在棘球蚴原头节中高表达而六钩蚴阶段不表达,可能成为具有高效诊断价值的诊断抗原候选分子。
1 材料与方法
1.1材料
1.1.1主要试剂异丙基-β-D-硫代半乳糖苷(IPTG)购自Promega公司(美国);反转录试剂盒(Revert Aid First strand cDNA Synthesis Kit)购自Thermo公司(美国);重组蛋白纯化试剂盒购自德国墨克公司;弗氏完全/不完全佐剂购自SIGMA公司(美国);表达载体pET-28a由本实验室保存。
1.1.2实验动物购自宁夏医科大学实验动物中心6~8周雌性Balb/c小鼠50只,体重18~20 g。
1.1.3原头节来源于宁夏医科大学总医院肝胆外科提供的包虫病患者完整包囊,无菌分离原头节。
1.1.4感染血清由本实验室保存。
1.2方法
1.2.1筛选、合成抗原分子根据国家人类基因组南方研究中心(CHGC)公开发表的细粒棘球绦虫的11 325个mRNA测序数据,分别对其原头节阶段和六钩蚴阶段基因的表达丰度RPKM值和饱和度reads进行比较,筛选出在棘球蚴的原头节阶段和囊壁阶段高表达且reads > 20的片段,利用蛋白数据库uniprot和Softberry Prediction软件等对候选分子进行基因功能分析和亚细胞学定位,筛选出优势抗原分子Eg-07279并对其进行进一步探究、分析。
1.2.2表达载体的构建及鉴定引物序列及内切酶:CGAGCTCATGTCGTTTGATCACAGGAATATGGSacI:CCGCTCGAGTTAGAGTGCTTCAAAGAGATCAACAXhoI:用限制性内切酶SacI 和XhoI分别对重组质粒Eg-07279/pGEM-T和pET-28a在37 ℃双酶切, 获得目的片段和表达载体pET-28a,在T4连接酶的作用下4 ℃连接过夜,将连接产物转化至感受态细胞E.coliBL21(DE3)中,在含卡那霉素(终浓度为50 μg/mL)的LB平板培养基中37 ℃培养过夜。选取单克隆,摇菌培养后提取质粒,以限制性内切酶SacI 和XhoI双酶切鉴定,并将重组菌送生工生物工程(上海)股份有限公司测序鉴定。
1.2.3重组蛋白rEg-07279诱导表达与纯化将重组菌株37 ℃振荡培养至吸光度A=0.6时加入诱导剂IPTG 1 mmol/L诱导表达2 h, 6 000 r/min, 离心10 min,弃上清,收集细菌沉淀,用含有His-tag标签的镍柱在变性条件下分离纯化重组蛋白。将该重组蛋白经含尿素梯度浓度(6、4、2、0 mol/L)的PBS逐步透析复性, 并进行SDS-PAGE电泳分析。
1.2.4特异性抗血清制备免疫动物:60只雌性BABL/c小鼠(18~20 g)随机分为3组,见表1。
表1免疫动物分组
Tab.1Group of immunized animal

组别Group处理Treatment剂量Dosage空白组Blank不作处理100μL/只免疫组ImmunizationEg⁃07279+佐剂100μL/只免疫对照组ImmunizationControlPBS+佐剂100μL/只
采用皮下多点注射,初次免疫使用弗氏完全佐剂,2周后加强免疫使用弗氏不完全佐剂,均为100 μL/只(含重组蛋白10 μg)。分别于免疫前,首次免疫后1、2、4周每组小鼠尾静脉采血,免疫后6周进行去眼球采血。血样1 000 ×g离心10 min,取血清,于-80 ℃保存备用。
1.2.4小鼠血清中特异性IgG抗体检测稀释重组抗原rEg-07279 至终浓度为10 μg/mL,100 μL/孔包被ELISA板,PBST洗涤3次后,每孔150 μL 5%的牛血清白蛋白(BSA)封闭,37 ℃孵育2 h,洗涤3次,每孔加入上述3组小鼠血清 100 μL(1∶1 000),37 ℃孵育2 h,PBST洗涤3次,加入HRP-IgG山羊抗小鼠抗体100 μL(1∶5 000),37 ℃孵育2 h;PBST洗涤3次后每孔加入可溶性TMB底物100 μL,室温作用30 min,加入1 mol/L H2SO4终止反应,用酶标仪检测A450值。
1.2.5蛋白印迹法(Western blot)鉴定重组蛋白rEg-07279重组蛋白rEg-07279进行SDS-PAGE 电泳后,转移至硝酸纤维素膜上,再以5% 脱脂奶粉4 ℃封闭12 h,以PBST洗涤。各硝酸纤维素膜分别以空白组小鼠血清(1∶200)、重组蛋白rEg-07279免疫组小鼠血清(1∶200)、原头节继发感染小鼠血清(1∶200)、室温孵育2 h,PBST洗涤后再加入山羊抗鼠HRP-IgG抗体(1∶5 000)室温孵育1 h,经PBST洗涤后加入二氨基联苯胺(DAB)底物显色,5 min后,加ddH2O中止反应,进行成像。
1.2.6重组蛋白rEg-07279人类血清学分析包被缓冲溶液稀释重组蛋白rEg-07279后进行ELISA板包被,经5%牛血清白蛋白(BSA)封闭后分别用10位健康人血清(1∶2 000稀释)和10位病人血清(1∶2 000稀释)进行识别,37 ℃孵育2 h,PBST洗涤,再以辣根过氧化物酶(HRP)标记的山羊抗人总IgG抗体37 ℃孵育1 h,PBST洗涤后每孔加入可溶性TMB底物100 μL,室温作用30 min,加入0.5 mol H2SO4终止反应,于450 nm波长检测其OD值。
1.3统计分析采用SPSS17.0与Graph Pad5.0进行统计学的相关分析。多组之间采用单因素方差分析(ANOVA),两组间比较采用t检验。检验水平为α=0.05。
2 结 果
2.1生物信息学分析结果
2.1.1表达谱分析利用生物信息学差异分析比较细粒棘球绦虫表达谱,经筛选可得基因Eg-07279在六钩蚴阶段的饱和度(Reads)和表达丰度(RPKM)均为0,在原头蚴阶段饱和度值和表达丰度分别为28和161,囊壁中的饱和度值和表达丰度分别为47和190,即Eg-07279只在棘球蚴阶段的原头蚴和囊壁中表达,而在六钩蚴中不表达,是编码膜蛋白的基因,分子大小为1 890 bp,见表2。
2.1.2Eg-07279抗原表位预测分析通过软件DNAStar对Eg-07279进行抗原表位预测分析, 选取其中抗原表位丰富的片段作为抗原分子的靶序列。结果见图1显示,抗原表位主要位于2-20,50-80, 185-235,315-334, 340-382,432-455,467-526,570-582等氨基酸残基及其附近。
表2Eg-07279不同阶段表达谱差异分析
Tab.2Eg-07279 differential expression profiling

GeneIDLength/bpAdultOncPSCCystReadsRPKMReadsRPKMReadsRPKMReadsRPKMEg⁃07279189049173002816147190
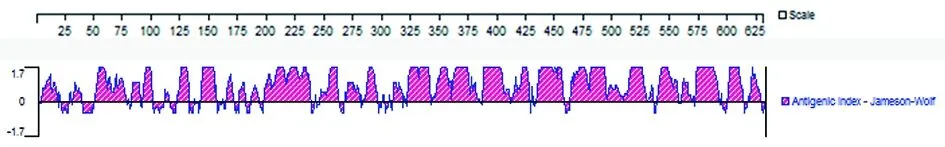
图1 Eg-07279抗原表位预测分析Fig.1 Eg-07279 epitope prediction analysis
2.1.3Eg-07279同源性分析将该分子于NCBI(National Center for Biotechnology Information,https://www.ncbi.nlm.nih.gov/)数据库做Blast比对,共有102条具有同源比对信息,从中选取E value =0且ident value相对较大的同源信息用MEGA(Molecular Evolutionary Genetics Analysis)软件进行进化树制作见图2,分析比对其同源性。由结果可知Eg-07279与细粒棘球蚴、泡球蚴,多房棘球绦虫的同源性均达100%。

图2 Eg-07279同源性分析Fig.2 Eg-07279 homology analysis
2.1.4Eg-07279信号通路分析通过KEGG(京都基因与基因组百科全书,http://www.kegg.jp/)数据库进行比对分析,其匹配结果显示该分子涉及多条信号通路,如JAK-STAT pathway、B/T cell receptor signaling pathway等,见图3。这些代谢通路主要参与细胞的免疫调节以及增殖分化等生物学过程。

图3 Eg-07279信号通路分析Fig.3 Eg-07279 signaling pathway analysis
2.2重组质粒的构建与鉴定Eg-07279经PCR扩增获得目的片段约为1 890 bp,与预期片段大小相符,见图4。经测序,插入序列和CGHC所公布的该分子的序列基本一致,表明重组表达质粒pet28a-Eg-07279构建成功。

M:DNA标志物;1:重组质粒pET28a-Eg-07279;2:重组质粒pET28a-Eg-07279单酶切;3:重组质粒pET28a-Eg-07279双酶切;4:PCR产物M: DNA marker; 1: Recombinant plasmid pET28a-Eg-07279; 2: Recombinant plasmid digested by Sac I;3: Recombinant plasmid digested by Sac I and Xho I; 4: PCR product.图4 重组质粒pET28a-Eg-07279酶切鉴定结果Fig.4 Identification of pET28a-Eg-07279 by restriction enzyme
2.3重组蛋白rEg-07279纯化及鉴定在最优表达条件(37 ℃,6h,IPTG 1 mmol/L)下诱导表达重组rEg-07279蛋白,经超声破碎裂解及亲和层析法进行纯化,获得包涵体重组蛋白rEG-07279,经尿素梯度透析对其进行复性。完成复性的重组蛋白rEG-07279进行SDS-PAGE凝胶电泳检测重组蛋白rEg-07279大小为69 kD,见图5,与目的蛋白一致。

M: 预染蛋白质标志物 1: 未诱导阴性对照;2:诱导后全菌;3: 纯化重组蛋白rEg-07279M: Protein marker; 1: Uninduced negative control; 2: Whole-cell lysate after induction;3: Purified rEg-07279 after dialysis.图5 重组蛋白rEg-07279 SDS-PAGE电泳结果Fig.5 SDS-PAGE analysis of recombinant protein rEg-07279
2.4rEg-07279免疫小鼠后其血清中特异性IgG水平检测经检测小鼠在重组抗原首次免疫2周后免疫组特异性IgG抗体水平开始升高,加强免疫后特异性IgG抗体水平显著升高,第6周时达到最高(2.559±0.125),与佐剂组(0.3640±0.005)和空白对照组(0.319 0±0.01)相比差异有统计学意义(P<0.01),而佐剂组和空白对照组的IgG抗体水平随时间变化不大,差异无统计学意义(P>0.05),见图6。
(7)畸形攀比。寄宿生盲目攀比,特别是部分孩子家境条件较差,爱与同学比较,又总觉得自己底气不足,于是怨天尤人,不思进取。

图6 小鼠血清抗rEg-07279特异性IgG水平变化Fig.6 Kinetics of specific anti-rEg-07279 IgG in murine sera
2.5重组蛋白rEg-07279免疫原性分析重组蛋白rEg-07279分别与空白对照组小鼠血清、原头蚴继发感染鼠血清以及重组蛋白免疫组小鼠血清进行western blot检测,结果显示原头蚴继发感染组和重组蛋白免疫组血清均可与该重组蛋白识别,空白对照组鼠血清不能识别,见图7。
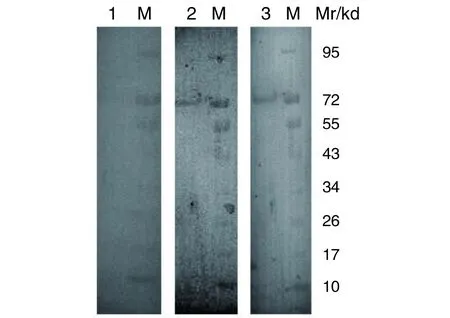
M:蛋白标志物;1:空白对照组;2:原头蚴继发感染组;3:重组蛋白rEg-07279免疫组M: Protein marker; 1: Serum of the control mice;2: Serum of mice with secondary infection;3: Serum of the immunization group.图7 重组蛋白rEg-07279 western blot分析 Fig.7 Western blot analysis of recombinant protein rEg-07279
2.6重组蛋白rEg-07279人血清学识别将重组蛋白rEg-07279包被ELISA板,分别以正常人(Control)的血清和包虫病人(Patient)的血清进行血清学识别,结果显示与正常人的检测值相比,包虫病人的IgG抗体水平表现出明显差异,且具有统计学意义(P<0.05),见图8。
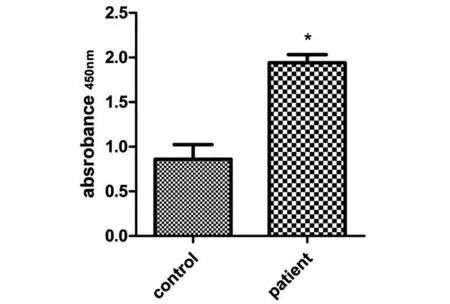
图8 重组蛋白rEg-07279 人类血清学识别Fig.8 Human serological identification of recombinant protein rEg-07279
3 讨 论
细粒棘球蚴病具有人兽共患性,已被列为我国今后重点防控的寄生虫疾病之一。它对人体健康和畜牧业发展均会产生较大危害[7]。人体感染棘球蚴后产生包囊生长缓慢,一般发现患病时包囊已在肝脏或肺等器官里形成较大体积的占位,对人体相关组织和器官造成机械性或病理性损伤[8]。近年来,随着畜牧业的发展,各地引进和饲养牲畜数目不断增加,形成新的包虫病污染区。在城市中,随着皮毛制品的流通使用、宠物饲养数目的增多以及旅游业发展带来的快速人口流动导致包虫病向城市蔓延的危险性也不断增加,近年来更多省区出现散在病例报告[9-10]。因此,细粒棘球蚴病不但是个特殊的医学和兽医学问题也是社会经济问题。
国内目前针对人体棘球蚴患者,手术治疗是主要手段,但是经常伴有术后复发和继发感染[11]。目前较为有效的药物治疗主要为甲苯咪唑、阿苯哒唑(又名丙硫咪唑)。但是这些手段都只能用于病灶发展成型期,此时已经对患者造成了生理及心理的损伤。能够准确判断包虫病发展的状况,选择合适的用药时机,找到新的具有代表性的、针对性的、敏感性的、特异性高的、某个阶段特有的抗原势在必行。因此筛选包虫病特异性诊断抗原,对包虫病的防治有十分重要的作用和意义。
本研究通过对CHGC公开发表的细粒棘球绦虫不同发育阶段转录组数据进行差异分析,比较筛选出优势抗原分子Eg-07279,分子大小为1890 bp。通过对该分子在不同阶段表达谱的分析发现其在原头蚴阶段高表达,其饱和度(Reads)值和表达丰度(RPKM)分别为28和161,而在六钩蚴阶段饱和度(Reads)和表达丰度(RPKM)均为0,是在棘球蚴阶段特异性表达的分子。利用DNAStar分析软件对Eg-07279进行抗原表位预测分析,预测结果显示该分子具有丰富的抗原表位。经进化树分析比对,该分子与泡球蚴、多房棘球绦虫有很高的同源性,结合KEGG信号通路分析知该分子与细胞免疫应答、增值分裂等生物过程有关,有可能是寄生虫发育阶段必需分子。基于此,本研究构建了重组表达质粒载体pET28a-Eg-07279,在大肠埃希菌中经IPTG诱导表达获得重组蛋白rEg-07279,该重组蛋白纯化后用于免疫动物,免疫后实验组和空白组小鼠进行血清学检测,结果显示2周后即可在动物血清中检测到特异性IgG抗体,4周后特异性IgG水平出现明显升高,第6周时达到最高(2.559 ± 0.125),可见,该重组抗原可诱导小鼠产生特异性抗体,表现出良好的免疫原性。重组抗原rEg-07279原头蚴Western blot检测结果,重组抗原rEg-07279能够特异性识别原头蚴继发感染的小鼠血清和该重组抗原免疫后的小鼠血清,而对空白组小鼠血清不识别,表明该重组蛋白具有较好的抗原性。
由上可知,重组抗原rEg-07279免疫动物后能够在动物体内产生较强烈的免疫反应,说明重组抗原rEg-07279具有良好的抗原特性和免疫原性,有望成为细粒棘球蚴特异性诊断抗原分子。
参考文献:
[1] Fan LC, Liao TX, Li H, et al. Dynamic of maternal antibody immunized with genetic engineering subunit vaccine of sheep hydatid disease [J]. China Herbivore Science, 2015, 35(5): 53-55. (in Chinese)
[2] McManus DP, Zhang WB, Li J, et al. Echinococcosis[J]. Lancet, 2003, 362(9392): 1295-1304. DOI: 016/S0140-6736(03)14573-4
[3] Budke CM, Peter D, Torgerson PR. Global socioeconomic impact of cystic Echinococcosis[J]. Emerg Infect Dis, 2006, 12(2): 296-303. DOI: 10.3201/eid1202.050499
[4] Jia WZ, Tian GF. Study on the prevention and treatment of hydatid disease [J]. Chin J Veter Parasitol, 1998, 6(4): 49-51. (in Chinese)
贾万忠, 田广孚. 棘球蚴病防治技术研究概况[J]. 中国兽医寄生虫病杂志, 1998, 6(4): 49-51.
[5] Cao DP, Fan HN, Wu DF, et al. Preliminary proteomics analysis on protoscoleces and cyst wall of human hydatid cyst [J]. Chin J Zoonoses, 2014, 30(6): 575-582. DOI:10.3969/cjz.j.issn.1002-2694.2014.06.006 (in Chinese)
曹得萍, 樊海宁, 毋德芳, 等. 细粒棘球绦虫在人体内棘球蚴原头节、囊壁蛋白表达谱分析[J]. 中国人兽共患病学报, 2014, 30(6): 575-582.
[6] Zhao YQ, Li ZH, Wang H, et al. Cloning, expression and immungenicity analysis of antigenEg-01883 screened from protoscoleces ofEchinococcusgranulosus[J]. Chin J Parasitol Paras Dis, 2016, 3(34): 208-213. (in Chinese)
赵殷奇, 李子华, 王浩, 等. 细粒棘球绦虫原头节抗原分子Eg-01883的克隆、表达及免疫原性分析[J]. 中国寄生虫学与寄生虫病杂志, 2016, 3(34): 208-213.
[7] Zhang W, Zhang Z, Wu W, et al. Epidemiology and control of Echinococcosis in central Asia, with particular reference to the People’s Republic of China[J]. Acta Tropica, 2015, 141(Part B): 235-243.4. DOI: 10.1016/j.actatropica.2014.03.014. DOI: 10.1016/B978-0-444-53490-3.00026-1
[8] Barnes TS, Deplazes P, Gottstein B, et al. Challenges for diagnosis and control of cystic hydatid disease[J]. Acta Trop, 2012, 123(1): 1-7. DOI: 10.1016/j.actatropica.2012.02.066
[9] Otero-Abad B, Torgerson PR. Asystematic review of the epide-miology of Echinococcosis in domestic and wild animals[J]. PLoS Negl Trop Dis, 2013, 7(6): 2249. DOI: 10.1371/journal.pntd.0002249
[10] Zeng XM, Guan YY, Wu WP. Epidemiological distribution characteristics of Echinococcosis[J]. Chin J Zoonoses, 2014, 30(4): 413-417. DOI: 10.3969/j.issn.1002-22694.204.04.014. (in Chinese)
曾祥嫚, 官亚宜, 伍卫平. 棘球蚴病的流行病学分布特征[J]. 中国人兽共患病学报, 2014,30(4): 412-417.
[11] Li J, Li J, Peng XY, et al. Cost effectiveness evaluation of four kinds of surgical methods for hepatic echinococcosis [J]. Chin J Zoonoses, 2017, 33(6): 559-563. DOI:10.3969/j.issn.1002-2694.2017.06.017 (in Chinese)
李婧, 李江, 彭心宇, 等. 肝细粒棘球蚴病4种手术方式的成本—效果评价[J]. 中国人兽共患病学报, 2017, 33(6): 559-563.

