ALS抑制剂类除草剂抗性水稻功能标记的开发与验证
陈涛 张善磊 赵凌 张亚东 朱镇 赵庆勇 周丽慧 姚姝 赵春芳梁文化 王才林,*
ALS抑制剂类除草剂抗性水稻功能标记的开发与验证
陈涛1, 2张善磊1赵凌1张亚东1朱镇1赵庆勇1周丽慧1姚姝1赵春芳1梁文化1王才林1,*
(1江苏省农业科学院 粮食作物研究所/江苏省优质水稻工程技术研究中心/国家水稻改良中心 南京分中心,南京 210014;2扬州大学 江苏省粮食作物现代产业技术协同创新中心,江苏 扬州 225009;)
【目的】培育具有乙酰乳酸合酶(ALS)抑制剂类除草剂抗性的品种是防治水稻直播田杂草危害最经济、有效的途径之一,而利用分子标记辅助选择有助于提高其品种选择效率。【方法】在明确除草剂抗性突变体黄华占M-1基因编码区碱基差异的基础上,利用四引物扩增受阻突变体系PCR(Tetra-primer ARMS-PCR)技术,设计引物对不同品种(品系)和淮稻5号/黄华占M-1的F2群体进行基因型检测,并结合除草剂的田间试验对标记的准确性进行验证。【结果】基因编码区序列比对分析表明,尽管籼、粳稻之间具有多处差异碱基,但只有第1642和1643碱基TG到AT的变异能导致位于高度保守域的第548位编码氨基酸由色氨酸突变为甲硫氨酸,进而使水稻产生对ALS抑制剂类除草剂的抗性。依据PCR扩增产物的电泳带型,可以准确区分出3种不同的基因型,其基因型与苗期除草剂抗性的表型完全一致。【结论】利用Tetra-primer ARMS-PCR技术,可以实现对两个连续变异碱基位点基因型的快速检测,从而加快ALS抑制剂类除草剂抗性水稻品种的选育进程。
乙酰乳酸合酶基因;除草剂抗性;碱基突变;四引物扩增受阻突变体系PCR
直播稻作为水稻轻简栽培的一种重要方式,由于省工节本效果明显,深受广大农户的欢迎,种植面积迅速扩大。近年来,随着机插秧技术的快速推广以及严控直播稻盲目发展措施的落实,其迅猛增长的趋势有所缓和,但仍是水稻种植的重要方式。据统计,2016年全国有超过30%的水稻种植面积采用直播技术[1]。长期以来,田间杂草危害一直是困扰直播稻生产的技术难题,尽管除草剂能有效防治草害发生,但施用不当常常会对水稻造成不同程度的药害。因此,培育具有除草剂抗性的水稻品种是防治直播田杂草危害最经济、有效的途径。
近年来,各种以乙酰乳酸合成酶(Acetolactate Synthase, ALS)为靶标的除草剂,如咪唑啉酮类(Imidazolinones, IMs)、磺酸脲类(Sulfonylureas, SUs)、三唑并嘧啶类(Triazolopyrimidines, TPs)、嘧啶硫代苯甲酸酯类(pyrimidinyhhiobenzoate, PTBs)、磺酰胺羰基三唑啉酮类(sulfonylamino carbonyl triazolinone, SCTs)除草剂等,由于除草谱广、低毒高效、选择性强等优点,被广泛用于防除各种作物种植田的杂草[2]。该类除草剂的作用机理主要是通过与植物体内的乙酰乳酸合酶形成复合物阻断底物进入酶活性位点通路,抑制ALS活性,使支链氨基酸如亮氨酸、异亮氨酸、缬氨酸的合成受阻,导致植物死亡。抗性机制研究表明,植物基因保守区发生错义突变会导致酶结构或空间构象发生变化,降低对除草剂的亲和力,进而产生抗性[3]。
美国是最早开展ALS抑制剂类除草剂抗性品种选育的国家。1993年路易斯安那州立大学农业中心利用甲磺酸乙酯(Ethyl Methanesulfonate, EMS)诱变水稻品种AS3510,M2代喷洒咪唑乙烟酸,筛选出具有咪唑啉酮类除草剂抗性的突变系93AS3510,并进一步与品种Cocodrie和MayBelle杂交,选育出抗性品种CL121与CL141,并于2002年首次在美国进行商业化种植[4]。为进一步提高品种的丰产性,该中心利用相同的方法对美国优质籼稻品种Cypress进行诱变,筛选出抗性品系PWC16,系统选育出品种CL161,并逐步取代CL121和CL141[5]。此后,阿根廷学者也从当地品种IRGA 417的EMS诱变后代中筛选出抗性材料并育成品种Puita’ Intacl[6]。分子生物学研究表明,虽然AS3510、PWC16和Puita’ Intacl等材料都具有相似的除草剂抗性,但基因的变异位点则完全不同。AS3510的抗性源自基因第628位甘氨酸(Gly, G)转变为谷氨酸(Glu, E);PWC16的抗性是由第627位丝氨酸(Ser, S)突变为天冬氨酸(Asp, D)造成的;而Puita’ Intacl出现抗性则是由第96位缬氨酸(Val, V)到苏氨酸(Thr, T)的变异所致[6]。目前,由于上述位点均已申请相关专利,而我国想在此基础上开展商业化育种,不仅会受到国外研究机构的诸多限制,而且还必须承担昂贵的专利使用费。深圳兴旺生物种业有限公司利用化学诱变的方法处理广东优质常规籼稻品种黄华占,通过苗期大规模咪唑啉酮类除草剂的筛选,获得了一批抗性突变植株。其中一个突变体的基因在编码区第1642和1643碱基发生TG到AT的突变,导致第548位编码氨基酸由色氨酸(Trp, W)突变为甲硫氨酸(Met, M),进而产生抗性。这是我国首次在水稻中发现具有自主知识产权的抗ALS抑制剂类除草剂新位点和新材料[7]。
利用目标基因存在的碱基差异,开发共显性的功能标记进行辅助选择可以提高ALS抑制剂类除草剂抗性品种选育的效率。四引物扩增受阻突变体系PCR技术(Tetra-primer amplification refractory mutation system PCR, Tetra-primer ARMS-PCR)是近年来在等位基因特异扩增PCR基础之上发展起来的,专门针对单核苷酸突变的一种新的检测方法。通过四条引物的一次PCR扩增、电泳即可达到区分不同基因型的目的,具有快速、简便、费用低等特点,并在水稻分子育种中得到广泛应用[8-9]。其技术原理是依据DNA聚合酶缺少3′→5′外切酶活性,对于3′末端错配的引物,以低于正常末端配对引物的速度延伸,当错配碱基的数目达到一定程度或者条件达到一定的严谨程度时,3′末端碱基则因磷酸二酯键的形成困难而不能继续延伸,反应终止,不能得到特异长度的扩增条带[10]。因此,从理论上讲,该技术能够实现对两个连续单核苷酸变异的检测。
为提高ALS抑制剂类除草剂抗性品种的选育效率,有效解决水稻直播田的杂草危害,本研究在分析Tetra-primer ARMS-PCR原理的基础上,根据突变位点的碱基差异,设计相关引物对基因的变异进行快速检测,并结合除草剂的田间试验对其准确性进行验证,以期为ALS抑制剂类除草剂抗性品种的高效选育提供技术手段。
1 材料与方法
1.1 供试材料
供试水稻材料包括广东常规籼稻品种黄华占及其ALS抑制剂类除草剂抗性突变材料(简称黄华占M-1),江苏常规粳稻新品种(品系)南粳2728、淮稻5号、镇稻99,分离群体是以淮稻5号为母本,黄华占M-1为父本进行杂交、自交获得的280个F2单株。2016年5月将上述材料浸种催芽后,将亲本和F2群体分别均匀点播在长、宽、高规格分别为60 cm×30 cm×15 cm的塑料周转箱中,并放置在露天网室。当叶龄为1叶心和3叶1心期时,按10 g/m2施用尿素,同时,为直观反映F2群体基因型与其除草剂抗性表型是否一致性,在4叶1心期时将F2群体单株按基因的3种基因型分类移栽在同一周转箱中。
1.2 试验方法
1.2.1 除草剂抗性鉴定
当水稻在塑料周转箱中生长到5叶1心期,将5%咪唑乙烟酸水剂(山东先达农化股份有限公司)稀释1000倍,使用小型喷雾瓶按300 L/hm²的用量进行喷雾处理,10 d后调查除草剂抗性,无明显症状的记为抗,叶片全部黄化枯死的记为感。
1.2.2 序列对比和引物合成
从水稻基因组注释数据库网站(http://rice. plantbiology.msu.edu/)下载粳稻品种日本晴位于第4染色体基因的编码区序列(Coding Sequence, CDS),与深圳兴旺生物种业有限公司提供的抗ALS抑制剂类除草剂籼稻突变体黄华占M-1及其野生型的CDS序列进行比对。根据编码区第1642和1643位点发生的突变,采用Tetra-primer ARMS-PCR技术并结合Primer Premier 5.0软件(http://www.premierbiosoft.com/)设计相应的引物(表1)[11]。引物由上海英骏生物技术有限公司合成。
1.2.3 DNA提取、PCR扩增和电泳检测
水稻3叶1心期F2群体分类移栽前,收集水稻品种(品系)、F1杂种、F2群体的微量新鲜叶片,按CTAB法提取基因组DNA[12]。PCR根据Chen等[13]的报道进行,略作修改。20 μL PCR体系包括DNA (10 ng/μL) 2.0 μL,四条引物(4 pmol/μL)各0.5 μL,10×缓冲液(含MgCl2) 2.0 μL,dNTP (2.5 mmol/L) 0.4 μL,(5 U/μL) 0.5 μL,ddH2O 13.1 μL。反应程序如下:95℃下预变性5min;95℃下变性30 s,59℃下复性30 s,72℃下延伸1 min,循环35次;72℃下延伸7 min,10℃冷却10 min。将扩增产物加溴酚蓝指示剂后备用。反应产物用加入DuRed核酸染料3%的琼脂糖凝胶130V电泳30 min,在凝胶成像系统下观察记载。
2 结果与分析
2.1 ALS基因序列分析和引物设计
水稻基因编码区序列全长为1935 bp,仅有一个外显子,编码644个氨基酸[14]。通过比较粳稻品种日本晴和籼稻品种黄华占的相关序列,发现上述籼、粳稻编码区序列存在29处核苷酸变异,其中绝大多数点突变为同义突变,并不影响其编码的氨基酸序列,仅有4处能导致氨基酸序列变异的错义突变,分别在第11、273、548和604位氨基酸位点。通过对拟南芥、玉米、油菜、大豆编码ALS蛋白的氨基酸序列进行同源性比对,发现除第548位氨基酸位点比较保守外,其他3处位点都存在序列变化(数据未列出)。在此基础上,进一步比较黄华占野生型与黄华占M-1的相关序列,发现它们仅在编码区第1642和1643位点存在TG到AT的变异,并导致第548位氨基酸由色氨酸突变为甲硫氨酸(图1)。该位点正好处于植物基因5个高度保守结构域B(QWED)中,是目前已报道的能导致植物对ALS抑制剂除草剂产生抗性的20个重要氨基酸位点之一[15-19]。下载日本晴基因的全长序列,根据Tetra-primer ARMS-PCR技术原理,先确定正向(-I-F)和反向内引物(-I-R),其中正向内引物的3′末端与黄华占突变体M-1 1642位碱基相同,反向内引物与黄华占野生型1643位碱基互补,同时为增强内引物的特异性,在3′端第3位各引入一个人工错配碱基,即-I-F由A变为T,而反向内引物则由C变为T。同时,利用Primer Premier 5.0软件设计出多对正向和反向外引物,综合考虑四条引物的m(Melting Temperature)值、引物之间的互补情况以及差异片段是否能在琼脂糖凝胶电泳中得到有效区分等多种因素,选择出最合适的外引物对进行搭配(图1、表1)。根据各引物在基因序列中的位置,从理论上讲无论是否具有目标位点的碱基变异都能被正反向外引物扩增出具有阳性对照作用的646 bp条带。除此之外,含基因突变纯合基因型的水稻还能扩增出381 bp的特征条带,不含基因突变纯合基因型水稻则能扩增出321 bp的特征条带,而杂合材料能同时扩增646 bp、381 bp以及321 bp三条特征条带。
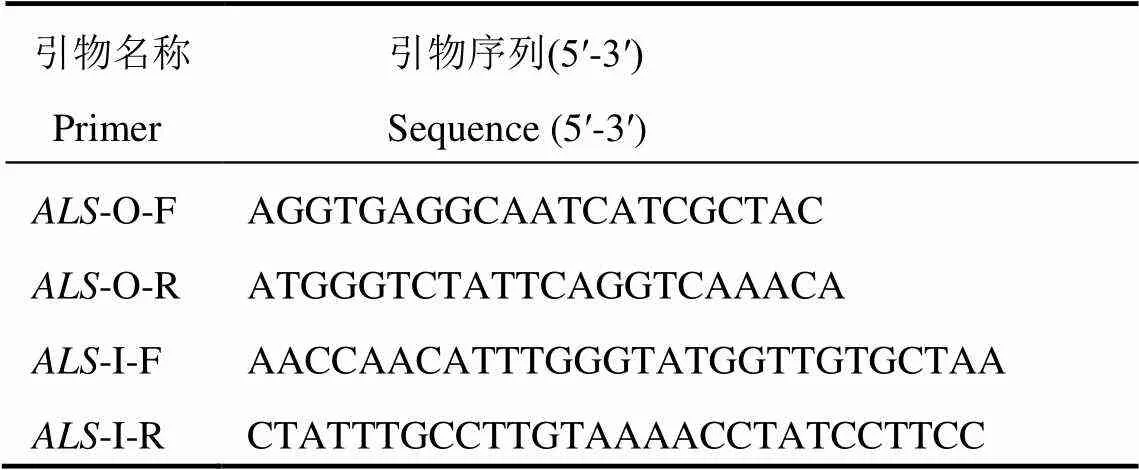
表1 四引物扩增受阻突变体系PCR技术检测水稻ALS基因碱基变异的引物序列

序列中黑色碱基表示外显子, 蓝色碱基表示基因的非编码区序列, 红色碱基表示引物序列, 阴影表示差异碱基, 阴影斜体表示产生ALS抑制剂类除草剂抗性的关键碱基。
Fig. 1. Strategy for Tetra-primer ARMS-PCR system to detect the two continuous base mutations forgene in rice.
2.2 不同品系ALS基因型检测和除草剂抗性鉴定
在除草剂处理前3 d,提取黄华占、黄华占M-1、南粳2728、淮稻5号和镇稻99等5个籼、粳稻品种(品系)的DNA进行Tetra-primer ARMS-PCR扩增,产物经3%琼脂糖凝胶电泳可显示两种类型的条带(图2),被正向外引物-O-F和反向外引物-O-R扩增起阳性对照作用的646 bp的条带在每个检测材料中均出现,这表明所有样本的DNA都得到了有效扩增。除646 bp的条带外,南粳2728、淮稻5号、镇稻99和黄华占中还能检测出一条约为321 bp的条带,它是由正向外引物-O-F和反向内引物-I-R扩增产生的,其特异扩增基因编码区序列中第1643位核苷酸为G的等位位点。而突变体黄华占M-1虽不能扩增出321 bp的条带,却能扩增出一条381 bp的条带,该条带是由正向内引物-I-F和反向外引物-O-R扩增产生的,其特异扩增基因编码区第1642位核苷酸为A的等位变异位点。为验证基因型和表型是否具有一致性,当上述品种(品系)生长到5叶1心期时进行除草剂喷雾处理。除黄华占M-1没有表现出明显症状外,其他材料叶片全部黄化枯死(图3)。这说明利用该方法可以对基因编码区第1642和1643位点发生TG到AT突变的抗除草剂水稻进行快速、准确的鉴定。
M-DNA分子量标准(DL2000);1-黄华占M-1;2-黄华占;3-南粳2728;4-淮稻5号;5-镇稻99。
Fig. 2. Electrophoresis detection ofgenotypes by Tetra-primer ARMS-PCR in different rice varieties or lines.

A―黄华占M-1;B―南粳2728。
Fig. 3. Resistance test of different varieties or lines to ALS inhibitor herbicide imazethapyr.
2.3 F2分离群体ALS基因型检测和除草剂抗性鉴定
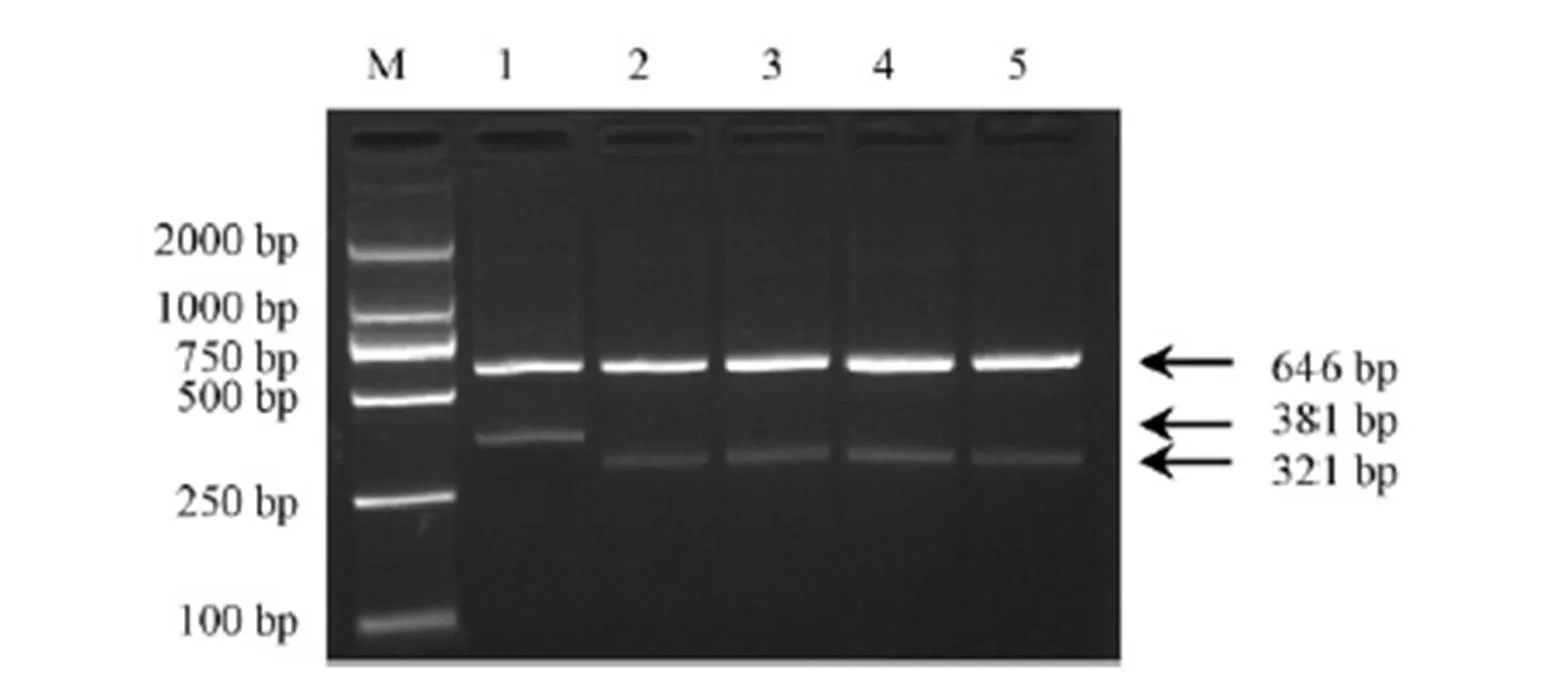
为进一步验证Tetra-primer ARMS-PCR引物对杂合基因型的检测效果,在4叶1心期时,提取淮稻5号/黄华占M-1 F2群体280个单株的DNA并对其进行PCR扩增。结果表明,所有F2单株的电泳产物只出现三种类型的条带,其中67株能扩增出646 bp和381 bp的条带,60株能扩增出646 bp和321 bp的条带,其余153株则能扩增出646 bp、381 bp和321 bp的条带(图4)。三种带型对应的基因型比例为1∶2∶1,符合1对基因的分离规律(χ2=2.764<χ20.05,2,0.25<<0.50)。为直观反映基因型和表型是否一致,将群体单株按不同基因型进行移栽,待苗恢复正常后进行除草剂喷雾处理。除不含基因突变纯合基因型水稻全部黄化枯死外,其他两种基因型的单株都不出现除草剂危害的症状(图5)。这不仅说明该引物可以有效对杂合基因型进行准确鉴定,同时也说明突变所产生的除草剂抗性由一对显性基因所控制。
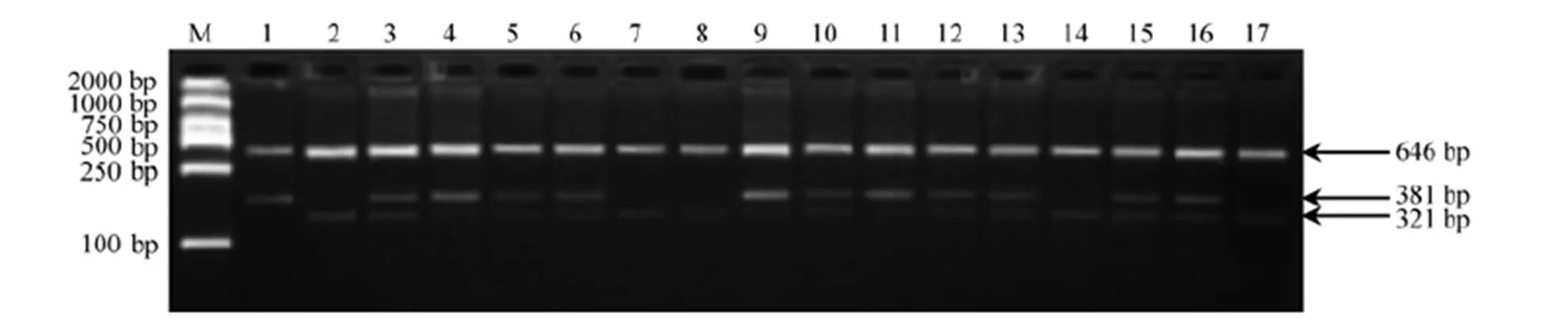
M-DNA分子量标准(DL2000);1―黄华占M-1;2―淮稻5号;3―淮稻5号/黄华占M-1 F1;4~17―部分F2分离单株。
Fig. 4. Electrophoresis detection ofgenotype by Tetra-primer ARMS-PCR in F2population derived from Huaidao 5/Huanghuazhan M-1.

A-不含ALS基因突变纯合基因型单株;B-含ALS基因突变纯合基因型植株;C-含ALS基因突变杂合基因型单株。
Fig. 5. Resistance test of F2population derived from Huaidao 5/Huanghuazhan M-1 to ALS inhibitor herbicide imazethapyr.
3 讨论
3.1 植物对ALS抑制剂类除草剂的抗药性机理
自1990年Mallory-Smith首次报道毒莴苣对磺酰脲类除草剂出现抗药性以来,国际上发表了大量关于植物对ALS抑制剂除草剂产生抗性的研究报道[20-21]。研究表明,植物在ALS抑制剂除草剂的选择压下,能进化出不同机制的抗性。根据作用方式的不同,目前主要分为非靶标抗性和靶标抗性。非靶标抗性机制是指植物通过降低ALS抑制剂除草剂的吸收和转运,限制其到达作用部位以及提高与除草剂代谢相关酶类如谷胱甘肽还原酶、过氧化物歧化酶、细胞色素P450单加氧酶等含量和活性,使除草剂代谢为无毒化合物的能力增强。此类抗性的产生一般是多基因共同作用的结果,其分子机制尚不明确;靶标抗性则主要是通过基因作用位点突变、过量表达以及拷贝数增加导致靶标蛋白有所修饰进而产生抗性[22-24]。因此,靶标抗性存在抗谱相对狭窄、抗药性易于丧失等缺陷,但由于涉及基因单一、遗传方式简单、抗性程度高等特点,便于除草剂开发和抗性育种利用。
基因碱基突变造成氨基酸残基位点变化,导致靶标蛋白发生修饰,进而引起除草剂与ALS 酶结合方式的变化是水稻产生靶标抗性的重要方式之一。已有研究发现,ALS蛋白中至少存在着20个能导致植物对ALS抑制剂除草剂产生抗性的氨基酸位点,以模式植物拟南芥基因氨基酸序列为标准分别为Gly 121、Ala 122、Met 124、Gly162、Val 196、Pro 197、Arg 199、Ala 205、Phe 206、Lys 256、Met 351、His 352、Asp 376、Arg 377、Met 570、Leu 571、Trp 574、Phe 578、Ser 653、Gly654[15-19]。目前,水稻中已报道的抗ALS抑制剂除草剂突变位点主要包括Gly 95、Ala 96、Pro 171、Trp 548、Ser 627、Gly 628,分别对应拟南芥的Gly121、Ala 122、Pro 197、Trp 574、Ser 653和Gly 654[6,19,25]。这些位点大多分布在ALS蛋白5个不连续的高度保守区,结构域A (AITGQVPRRMIGT)、结构域B (QWED)、结构域C (VFAYPGGASMEIHQALTRS)、结构域D (AFQETP)和结构域E (IPSGG)中。
由于不同ALS抑制剂除草剂在化学结构上存在差异,不同取代位点、替换氨基酸类型以及物种间的差异均会导致其抗药性范围和强弱的变化。Ala 122的突变一般只产生对咪唑啉酮类的抗性,对磺酸脲类、三唑并嘧啶类、嘧啶羧酸类除草剂则不太敏感,当其突变为Tyr时则对三唑并嘧啶类、磺酸脲类和咪唑啉酮类都产生不同程度的抗性;Pro 197位点的突变类型较多,可突变成His、Arg、Leu、Gln、Ser、Ala、Ile、Thr、Asn等,主要产生对磺酸脲类的抗性,而突变成Glu后则会产生对4种除草剂的广谱抗性[26]。在不同物种中同一位点同一氨基酸突变也会产生不同效果,如地肤中Pro197位点突变成Leu,仅产生磺酸脲类的抗性,而同样突变在反枝苋中则可产生对磺酸脲类、咪唑啉酮类等多种除草剂的抗性[27-28]。本研究中所述Trp 548位点位于基因高度保守结构域B中,主要产生Leu和Gly两种突变类型,与上述4种类别的除草剂的抗性都密切相关[29]。综上所述,基因与除草剂之间的作用方式和机理相当复杂,一些新的抗除草剂位点、氨基酸替换类型以及与除草剂的抗性关系还有待进一步研究。
3.2 Tetra-primer ARMS-PCR检测碱基变异的技术优势
利用分子标记辅助选择是提高ALS抑制剂类除草剂抗性水稻品种育种效率的重要手段。基因产生抗性大多是其保守区域上发生单核苷酸突变导致氨基酸序列变化产生的。针对这些变异,Kadaru等、Roso等和Rosas等分别利用等位基因特异PCR(Allele-Specific PCR,AS-PCR)和竞争性等位基因特异性PCR的方法(Kompetitive Allele Specific PCR,KASP),对造成G654E、S653D、A122T氨基酸变异的碱基位点开发相应的分子标记,实现了对上述差异位点准确的鉴定[30-32]。然而,传统AS-PCR虽然能够避免CAPS(Cleaved Amplified Polymorphism Sequences)标记检测过程中酶切等繁琐的操作,但结果假阴性偏多,且不能对杂合基因型进行一次性检测;而KASP技术尽管具有高通量的特性,但对引物和检测设备的要求较高,国内大多数育种单位目前还难以应用。与上述方法相比,Tetra-primer ARMS-PCR具有简单、快速、准确、易操作等特点,因而在实际应用中具有明显的优势。本研究根据ALS抑制剂类除草剂抗性水稻突变体黄华占M-1在基因编码区存在两个连续的变异碱基设计相应的Tetra-primer ARMS-PCR引物,实现了对不同基因型快速、准确的检测,可广泛应用于相关资源鉴定和分子标记辅助选择育种工作。
3.3 抗ALS抑制剂类除草剂水稻存在的问题和解决途径
抗除草剂特性是水稻适合直播的一种重要性状,对其进行利用能有效解决直播田的草害问题。由于种植水稻ALS抑制剂类除草剂抗性品种不仅具有省本节力的优势,而且其本身不属于转基因作物,其产品贸易和食品安全不受限制,因此具有广阔的市场应用前景。据统计,该类水稻在世界许多水稻生产国如美国、巴西、乌拉圭、阿根廷、意大利、马来西亚等都有广泛种植,其中美国超过76%的杂交水稻组合都具有ALS抑制剂类除草剂抗性[4]。然而,此类除草剂抗性水稻在生态、环境安全方面也存在一些问题。首先,通过异花授粉产生的基因飘移和除草剂选择压的作用下,杂草稻也会产生抗性。自ALS抑制剂类除草剂水稻推广以来,各种植国都有抗性杂草稻发生的报道。抗性杂草稻喷施除草剂不死亡,不仅能通过竞争性生长使水稻产量下降,而且严重影响稻米品质,降低其商品性。据统计,2008年,美国水稻主产区阿肯色州62%的水稻田块都出现抗性杂草稻,由此造成的经济损失平均达300美元/hm2。而在意大利,在随机抽查的种植过抗ALS类除草剂的9块水稻田中,其中8块也发现了抗性杂草稻[33-34];其次,长期单一施用同类型的除草剂产生的强选择压会导致杂草出现基因变异,产生抗药性,降低除草效果。迄今,在159种杂草中都出现过ALS类除草剂抗性,包括97种双子叶杂草和62种单子叶杂草,如常见的稗草、鸭舌草、千金子等[35]。此外,ALS抑制剂类除草剂在土壤中的降解期较长,过量施用而造成的农药残留极易造成后茬作物受害[36]。针对这些问题,国内外学者也提出了许多对策,比如加强种子繁育和直播田管理,避免杂草稻混入或萌发;开发新的非转基因除草剂作物如乙酰辅酶A羧化酶(Acetyl CoA carboxylase, ACCase)类抑制剂除草剂抗性和羟基苯基丙酮酸双氧化酶(4-hydroxyphenylpyruvate dioxygenase, HPPD)类抑制剂除草剂抗性作物等,通过相互轮作减轻选择强度,减低抗性杂草和杂草稻出现的几率;选育具有ALS抑制剂类除草剂抗性的小麦、油菜、玉米等其他农作物品种以保证正常的轮作或套作以及发现降解相应除草剂的微生物菌株等[37-39]。
与国外相比,我国对此类水稻的品种研发和推广应用则显得非常滞后。除缺乏自主知识产权的基因位点和相关育种材料外,最重要的因素是除草剂残留对轮作或套作农作物产生的药害问题,这在我国水旱轮作的单季稻地区尤其值得注意。如何在生产中避免这一问题,提高安全程度,可以从两个方面进行考虑。一方面,必须选择在集约化、规模化、机械化程度高的稻区进行示范种植,并配套高效、低残留、易降解的除草剂产品进行科学化、定量化喷施管理,并在轮作和套作时尽量种植对该类除草剂不敏感的农作物,以免出现不必要的损失;另一方面,持续加大对其他ALS抑制剂类除草剂抗性农作物的研发力度和经费投入,为农作物的多样化种植提供物质基础。目前,我国在玉米、油菜、棉花、谷子等作物中已筛选或创制出相应的抗性种质资源,并开始在育种中得以利用[40-43]。因此,随着技术的发展和不断完善,相信这些问题一定会得到有效解决,我国抗ALS抑制剂类除草剂水稻研发也会迎来新的契机并在生产中发挥重要价值。
谢辞:感谢深圳兴旺生物种业有限公司提供ALS抑制剂类除草剂抗性突变材料黄华占M-1。
[1] 中国农村技术开发中心. 我国水稻机械化直播技术体系日臻完善. 中国农业科技导报, 2017, 19(2): 139.
China Rural Technology Development Center. More and more perfect technology system of mechanized direct-sowing rice in China., 2017, 19(2): 139. (in Chinese)
[2] 张云月, 卢宗志, 李洪鑫, 崔海兰. 杂草对乙酰乳酸合成酶抑制剂类除草剂抗药性的研究进展. 杂草科学, 2013, 31(2): 1-5.
Zhang Y Y, Lu Z Z, Li H X, Cui H N. Research progress on weed resistance to acetolactate synthase inhibitors., 2013, 31(2): 1-5. (in Chinese with English abstract)
[3] Duggleby R G, McCourt J A, Guddat L W. Structure and mechanism of inhibition of plant acetohydroxyacid synthase., 2008, 46: 309-324.
[4] Sudianto E, Beng-Kah S, Ting-Xiang N, Saldain N E, Scott R C, Burgos N R. Clearfieldrice: Its development, success, and key challenges on a global perspective., 2013, 49: 40-51.
[5] Wenefrida I, Utomo H S, Meche M M, Nash J L. Inheritance of herbicide resistance in two germplasm lines of Clearfield®riceL.)., 2007, 87: 659-669.
[6] Goulart I C G R, Matzenbacher F O, Merotto A J R. Differential germination pattern of rice cultivars resistant to imidazolinone herbicides carrying different acetolactate synthase gene mutations., 2012, 52: 224-232.
[7] 陈竹锋, 王承旭, 柳威, 唐晓艳, 邓兴旺. 水稻抗除草剂蛋白及其在植物育种中的应用: CN201210037789.9. 2013-04-17.
Chen Z F, Wang C X, Liu W, Tang X X, Deng X W. Rice herbicide resistant protein and application thereof in plant breeding[P]: CN201210037789.9. 2013-04-17. (in Chinese)
[8] 陈涛, 骆名瑞, 张亚东, 朱镇, 赵凌, 赵庆勇, 周丽慧, 姚姝, 于新, 王才林. 利用四引物扩增受阻突变体系PCR技术检测水稻低直链淀粉含量基因. 中国水稻科学, 2013, 27(5): 529-534.
Chen T, Luo M R, Zhang Y D, Zhu Z, Zhao Q Y, Zhou L H, Yao S, Yu X, Wang C L. Detection ofgene for low-amylose content by tetra-primer amplification refractory mutation system PCR in rice., 2013, 27(5): 529-534. (in Chinese with English abstract)
[9] 李军, 李白, 高荣村. 利用四引物扩增受阻突变体系PCR技术检测水稻光温敏核不育基因. 中国水稻科学, 2014, 28(4): 442-446.
Li J, Li B, Gao R C. Detection of genefor photoperiod- and thermo-sensitive genic male sterility by tetra-primer amplication refractory mutation system PCR in rice., 2014, 28(4): 442-446. (in Chinese with English abstract)
[10] Ye S, DhillonS, Ke X Y, Collins A R, Day I N M. An efficient procedure for genotyping single nucleotide polymorphisms., 2001, 29, e88.
[11] Lalitha S. Primer Premier 5., 2000, 1(6): 270-272.
[12] Murray M G, Thompson W F. Rapid isolation of high molecular-weight plant DNA., 1980, 8: 4321–4325.
[13] Chen X, Temnykh S, Xu Y, Cho Y G, McCouch S R. Development of a microsatellite framework map providing genome-wide coverage in rice (L.)., 1997, 95: 553-567.
[14] 宋贵生, 冯德江, 魏晓丽, 唐家斌, 朱桢. 水稻乙酰乳酸合成酶基因的克隆和功能分析. 中国农业科技导报, 2007, 9(3): 66-72.
Song G S, Feng D J, Wei X L, Tang J B, Zhu Z. Isolation and functional analysis of rice acetolactate-synthase (ALS).,2007, 9(3): 66-72. (in Chinese with English abstract)
[15] Boutsalis P, Karotam J, Powles S B. Molecular basis of resistance to acetolactate synthase-inhibiting herbicides inand., 1999, 55: 507-516.
[16] Tan S, Evans R, Singh B. Herbicidal inhibitors of amino acid biosynthesis and herbicide tolerant crops., 2006, 30: 195-204.
[17] Zhou Q Y, Liu W P, Zhang Y S, Liu K K. Action mechanisms of acetolactate synthase-inhibiting herbicides., 2007, 89: 89-96.
[18] Massa D, Krenz B, Gerhards R. Target-site resistance to ALS-inhibiting herbicides inpopulations is conferred by documented and previously unknown mutations., 2011, 51: 294-303.
[19] 张保龙, 王金彦, 陈天子, 凌溪铁. 粳稻的ALS突变型基因及其蛋白和应用: CN201710120061.5. 2017-03-02.
Zhang B L, Wang J Y, Chen T Z, Ling X T. Mutantgene and its applications and japonica[P]: CN201710120061.5. 2017-03-02. (in Chinese)
[20] Mallory-Smith C A, Thill D C , Dial M J. Identification of sulfonylurea herbicide-resistant Prickly Lettuce ()., 1990, 4: 163-168.
[21] 任洪雷. 乙酰乳酸合成酶及基因研究概述. 中国农学通报, 2016, 32(26): 37-42.
Ren H L. Acetolactate synthase andgene research., 2016, 32(26): 37-42. (in Chinese with English abstract)
[22] Délye C. Unravelling the genetic bases of non-target- site-based resistance (NTSR) to herbicides: A major challenge for weed science in the forthcoming decade., 2013, 69: 176-187.
[23] Délye C, Jasieniuk M, Le Corre V. Deciphering the evolution of herbicide resistance in weeds., 2013, 29: 649-658.
[24] Rey-Caballero J, Menéndez J, Osuna M D, Salas M, Torra J. Target-site and non-target-site resistance mechanisms to ALS inhibiting herbicides in., 2017, 138: 57-65.
[25] Okuzaki A, Shimizu T, Kaku K, Kawai K, Toriyama K. A novel mutated acetolactate synthase gene conferring specific resistance to pyrimidinyl carboxy herbicides in rice., 2007, 64: 219-224.
[26] Yu Q, Powles S B. Resistance to AHAS inhibitor herbicides: current understanding., 2014, 70: 1340-1350.
[27] Guttieri M J, Eberlein C V, Thill D C. Diverse mutations in the acetolactate synthase gene confer chlorsulfuron resistance in kochia () biotypes., 1995, 43: 175-178.
[28] Sibony M, Michel A, Haas H U, Rubin B, Hurle K. Sulfometuron-resistant: Cross- resistance and molecular basis for resistance to acetolactate synthase-inhibiting herbicides., 2001, 41: 509-522.
[29] Tranel P J, Wright T R. Resistance of weeds to ALS-inhibiting herbicides: What have we learned?, 2002, 50: 700-712.
[30] Kadaru S, Zhang W Q, Yadav A, Oard J H. Development and application of allele-specific PCR assays for imazethapyr resistance in rice ()., 2008, 160: 431-438.
[31] Roso A C, Merotto A Jr, Delatorrea C A, Menezesb V G. Regional scale distribution of imidazolinone herbicide- resistant alleles in red rice (L.) determined through SNP markers., 2010, 119: 175-182.
[32] Rosas J E, Bonnecarrère V, Vida F P D. One-step, codominant detection of imidazolinone resistance mutations in weedy rice (L.)., 2014, 17: 95-101.
[33] Burgos N R, Norsworthy J K, Scott R C, Smith K L. Red rice () status after 5 years of imidazolinone-resistant rice technology in Arkansas., 2008, 22: 200-208.
[34] Busconi M, Rossi D, Lorenzoni C, Baldi G, Fogher C. Spread of herbicide-resistant weedy rice (red rice,L.) after 5 years of Clearfield rice cultivation in Italy., 2012, 14: 751-759.
[35] Heap I. International survey of herbicide resistant weeds. [2017-07-01]. http://www.weedscience.org/.
[36] 黄春艳, 陈铁保, 王宇, 孙宝宏, 杨绍义. 咪唑啉酮类除草剂对后茬作物安全性研究初报. 农药学学报, 2001, 3(2): 29-34.
Huang C Y, Chen T B, Wang Y, Sun B H, Yang S Y. Study on safety of imidazolinone herbicides to succeeding crops., 2001, 3(2): 29-34. (in Chinese with English abstract)
[37] Tan S, Evans R R, Dahmer M L, Singh B K, Shaner D L. Imidazolinone-tolerant crops: History, current status and future., 2005, 61: 246-257.
[38] Dauer J, Hulting A, Carlson D, Mankin L, Harden J, Mallory-Smith C. Gene flow from single and stacked herbicide-resistant rice (): Modeling occurrence of multiple herbicide-resistant weedy rice., 2017, 74(2): 348-355
[39] Green J M, Owen M D K. Herbicide-resistant crops: utilities and limitations for herbicide-resistant weed management., 2011, 59: 5819-5829.
[40] 仲义, 王云鹏, 代秀云, 刘文国. 利用玉米萌动胚获得抗除草剂转基因新材料. 湖北农业科学, 2014, 53(17):
4001-4004.
Zhong Y, Wang Y P, Dai X X, Liu W G. Generating herbicide resistant transgenic plants in maize with germinating embryo as explants., 2014, 53(17): 4001-4004. (in Chinese)
[41] 胡茂龙, 浦惠明, 龙卫华, 高建芹, 戚存扣, 张洁夫, 陈松. 油菜乙酰乳酸合酶突变体S638N的酶学特性及其对ALS类除草剂的抗性. 作物学报, 2015, 41(9): 1353-1360.
Hu M L, Pu H M, Long W H, Gao J Q, Qi C K, Zhang J F, Chen S. Enzymatic characteristics of acetolactate syn- thase mutant S638N inand its resistance to ALS inhibitor herbicides., 2015, 41(9): 1353-1360. (in Chinese with English abstract)
[42] 连丽君, 李莹, 王娟, 郭宁, 张可炜. 转/基因棉花生存竞争力和基因漂流的调查. 山东大学学报:理学版, 2009, 44(5): 20-27.
Lian L J, Li Y, Wang J, Guo N, Zhang K W. Investigations on survival competitiveness and gene flow of transgenic cotton withgene in the field.:, 2009, 44(5): 20-27. (in Chinese with English abstract)
[43] 师志刚, 夏雪岩, 刘正理, 程汝宏. 谷子抗咪唑乙烟酸新种质的初步研究. 河北农业科学, 2010, 14(11): 133-134, 136.
Shi Z G, Xia X Y, Liu Z L, Cheng R H. Preliminary study on new imazethapyr resistant foxtail millet germplasm., 2010, 14(11): 133-134,136. (in Chinese)
Development and Verification of a Functional Marker Associated with Resistance to ALS Inhibitor Herbicide
CHEN Tao1,2, ZHANG Shanlei1, ZHAO Ling1, ZHANG Yadong1, ZHU Zhen1, ZHAO Qingyong1, ZHOU Lihui1, YAO Shu1, ZHAO Chunfang1, LIANG Wenhua1, WANG Cailin1,*
(1Institute of Food Crops, Jiangsu Academy of Agricultural Sciences, Jiangsu High Quality Rice R&D Center / Nanjing Branch of China National Center for Rice Improvement, Nanjing 210014, China;2Jiangsu Co-Innovation Center for Modern Production Technology of Grain Crops, Yangzhou University, Yangzhou 225009, China;)
【Objective】Breeding rice varieties with resistance to ALS-inhibiting herbicide is the most economical and effective method to prevent weeds in direct-sowing field, and molecular marker-assisted selection can improve its efficiency. 【Method】The dominant molecular marker, designed for genotypic detection in different varieties and an F2population derived from Huaidao 5/Huanghuazhan M-1(mutant with resistance to ALS-inhibiting herbicide) was developed with Tetra-primer ARMS-PCR technique, based on the clarified mutation in CDS ofgene. 【Result】 The sequence alignment analysis ofgene encoding region showed that only the mutation from T1642G1643to A1642T1643leading to the 548th amino acid substitution from tryptophan to methionine in highly conserved region was the critical factors to produce resistance to ALS-inhibiting herbicide in Huanghuazhan M-1, despite the existence of multiple base differences between differentandrice varieties. The results of PCR detection indicated that three different genotypes could be accurately distinguished by electrophoretic bands, and it was exactly consistent with the phenotype of herbicide resistance at the seedling stage. 【Conclusion】 The genotype associated with two continuous base mutations could be rapidly detected by Tetra-primer ARMS-PCR technique, and the efficiency for varieties with resistance to ALS-inhibiting herbicide could be improved in breeding process.
acetolactate synthase; herbicide resistance; base mutation; tetra-primer ARMS-PCR
Corresponding author, E-mail: clwang@jaas.ac.cn
S482.4; S511.034
A
1001-7216(2018)02-0137-09
2017-08-01;
2017-09-29。
国家重点研发计划重点专项(2017YFD0100305);现代农业产业技术体系建设专项资金资助项目(CARS-01-62);江苏省重点研发计划资助项目(BE2016416);江苏省农业科学院粮食作物研究所科研基金资助项目(LZS17-7)。
通讯联系人,E-mail:clwang@jaas.ac.cn
10.16819/j.1001-7216.2018.7091

