不同苗龄牛樟叶绿素荧光差异性
杨 杰,郑 蓉,李建民,温晓芸,林永洲,洪小龙,郑维鹏
(1.福建省林业科学研究院,福建 福州 350012; 2.国家林业局南方山地用材林培育重点实验室,福建 福州 350012; 3.福建省森林培育与林产品加工利用重点实验室,福建 福州 350012;4.漳州市林业科学研究所,福建 漳州 363000; 5.漳州市龙海九龙岭林场,福建 龙海 363112)
引种、驯化、推广对于珍贵植物物种资源保护、开发、利用具有重要的意义[1],特别是近几十年来,引种已成为我国森林资源保护和发展的重要途径[2]。但由于评价体系的不同[2-3],绝大多数研究者判断引种是否成功的标准仅仅是被引植物是否存活而非生长状态是否良好[4],因此我国在良木引种、驯化、栽培等领域仍存在一定的盲目性。张丽君等[5]引种金花茶的研究提出,由于认识及评价技术的模糊,错误地将引种的存活误认为生长良好,进而进行大面积推广造林,从而带来巨大的损失。杨艳敏等[6]引种美国红栌的研究以及肖泳等[7]引种美国红枫的研究等均提到,由于片面地追求引种效果造成引种树种对引入地气候、环境等不适应而产生生长缓慢、品种退化等现象,也在良种资源和时间上造成巨大的浪费。
光合作用是植物重要的生命特征之一[8],是唯一能把太阳能转化为稳定的化学能储存在有机物中的过程,也是植物产量形成的决定性因素[9]。有研究表明,作为光合作用机理研究的一种“内在探针”[10-11],叶绿素荧光参数能够准确、真实地反映植物内在生理特点[10,12]。通过植物叶绿素荧光特征参数来诊断植物光合性能的高低[13],探究植物与环境之间相互关系,判断引种植物生长状态及其对环境的适应能力已被田间试验广泛应用[14-15]。
牛樟(CinnamomumkanehiraeHay.)为樟科(Lauraceae)樟属(Cinnamomumtrew)植物[16],是台湾特有的常绿阔叶大乔木树种。其树干通直,树体高耸,为优美的园景树;因其木材含有大量的松油醇,不易腐朽,材质细致且纹理交错,亦为高价值的家具及木刻工艺品用材。近年来,因过度开发及人为盗伐,牛樟在原生地台湾的天然林资源急剧减少,加上其生物学特性使得种群自然更新困难[17-18]。为避免牛樟物种资源消失,实现牛樟资源的可持续利用及生态系统的稳定,我国科研工作者进行了大量的引种栽培工作。但目前,国内对牛樟的研究主要集中在形态特征、生长发育规律、繁殖技术以及牛樟木的开发利用、牛樟芝的药用功效等[17-19]方面,对其不同生长阶段的生物学特性、引种环境适应能力评价等方面鲜有涉及。作为珍贵树种引进,保证牛樟适应栽培地的生态环境并健康生长是大规模繁育的前提。为掌握牛樟在引种地的适应情况,本研究对不同年龄段牛樟幼苗叶绿素荧光特征进行比较,以了解其在引种地各项生长特性和主要环境胁迫因子,为其引种成功及今后科学高效的栽培和管理提供参考。
1 引种地与原产地概况
引种试验地位于福建省龙海市九龙岭林场,地处东经117°37′30″—117°45′00″、北纬24°20′00″—24°75′00″,为沿海低山丘陵地带,海拔200 m,坡度25°左右。属亚热带季风性湿润气候,年均气温21 ℃,年均降水量1760 mm。母质为凝灰岩,土壤为红壤土类、黄红壤亚类,试验区表层土壤(0~10 cm)基本理化性质见表1。
台湾牛樟原产于台湾热带与亚热带交界处[20],原生分布于海拔500~800 m的天然阔叶林带。本试验繁殖体来源于台湾工业技术研究院南分院,地处东经122°00′00″、北纬24°50′00″,年均降水量1949.1 mm,年均温21.8 ℃,1月均温15 ℃,7月均温27.9 ℃,气候条件与福建省龙海市极为相似。该地区牛樟长势良好,抗病虫能力较强。依据气候相似理论,选择龙海市九龙岭林场为引种试验区。

表1 试验区土壤基本理化性质
2 试验材料与方法
2.1 供试材料
供试繁殖体来源于台湾工业技术研究院南分院的1~3年生牛樟,以温室栽培的1年生牛樟及2年生本地香樟为对照。
1年生牛樟为2015年7月定植的组培苗,第7个月连同栽培袋移置于室外露天栽培至第12个月的幼苗;2年生牛樟为2014年7月的同母株组培苗,第7个月连同栽培袋移置于室外露天栽培至第12个月,再移栽至30 cm×30 cm的栽培袋内继续培养至24个月的幼苗;3年生牛樟为2013年7月的同母株组培苗,第7个月连同栽培袋移置于室外露天栽培至第12个月,再移栽至30 cm×30 cm的栽培袋内继续培养至36个月的幼苗。温室栽培的1年生牛樟为2015年7月的组培苗,人工温室内栽培至第12个月的幼苗。2年生本地香樟(Cinnamomumcamphora)栽培处理过程与2年生牛樟同步;由于试验样品缺失,处理中无1年生和3年生香樟幼苗。所有幼苗前6个月均置于人工温室栽培,以直径30 cm×30 cm的栽培袋栽培,覆土至袋高3/4处。
2.2 研究方法
2016年7月,于试验区域内随机选择长势良好的1年生、2年生、3年生牛樟,温室栽培的1年生牛樟及2年生本地香樟苗木各6株,选取向阳方向、长势较好、健康饱满的叶片(幼枝顶端倒数第3片完全伸展的新叶),采用OS5p调制叶绿素荧光仪进行叶绿素荧光参数测定(在测定前将选取的叶片进行20 min的暗适应),主要测定指标包括初始荧光(Fo)、最大荧光(Fm)、可变荧光(Fv)、稳态荧光(Fs)、实际荧光(Fms)、光化学淬灭(qP)及非光化学淬灭(qN)等。计算出最大荧光比率(Fv/Fm)、光合量子产量(ΦPSⅡ)、电子传送率(ETR)、光能天线热耗散(D)、光能光化学耗散(P)及光能非光化学耗散(N)等参数[20]。计算公式为:ΦPSⅡ=Y=(Fms-Fs)/Fm,ETR=Y×PAR×0.5×0.8,D(%)=〔1-(Fms-Fs)/Fms〕×100,P(%)=qP×(Fms-Fs)/Fms×100,N(%)=(1-qP)×(Fms-Fs)/Fms×100。
2.3 数据处理与统计
数据处理使用SPSS 18.0系统进行统计分析,Duncan新复极差法测验不同处理的差异显著性及相关性检验(P<0.05);Origin 8.5作图。
3 结果与分析
3.1 不同苗龄牛樟基本荧光参数比较
不同苗龄牛樟叶片叶绿素荧光基本参数的测定结果(表2)表明,牛樟叶片叶绿素Fo随着苗龄的增加不断增加,Fo、Fm、Fv、Fs、Fms变化范围分别为(162±0)~(178±2)、(893±41)~(1087±35)、(673±35)~(836±33)、(175±0)~(195±5)和(385±1)~(531±3)之间。其中1年生牛樟Fo和2年生牛樟Fm、Fv、Fs、Fms最小,3年生牛樟Fo、Fm、Fv和1年生牛樟Fs、Fms最大。对不同苗龄牛樟叶片叶绿素Fo、Fm、Fv、Fs、Fms进行差异显著性分析,结果表明不同苗龄牛樟之间Fo、Fms均存在显著性差异。

表2 不同苗龄牛樟基本荧光参数
*:表中数据均为平均值±标准误差(n=6),同列不同小写字母为差异显著(P<0.05);下同。
相同苗龄的牛樟与本地香樟的比较分析表明,2年生香樟叶片Fo、Fs、Fms显著高于同苗龄牛樟,且2年生香樟Fo显著高于所有苗龄的牛樟。2年生牛樟Fm、Fv高于同苗龄本地香樟,但两者之间不存在显著差异;与1年生露天栽培牛樟幼苗相比,同龄的温室栽培苗Fm(968±24)、Fv(716±23)、Fs(212±8)在一定程度上有所增加,Fo(162±0)与露天苗相同,Fms(511±8)显著低于露天苗。
3.2 不同苗龄牛樟光合量子产量及电子传送速率比较
不同苗龄牛樟Fv/Fm、ΦPSⅡ、qP、qN和ETR计算结果(表3)表明,牛樟叶片Fv/Fm随着苗龄的增加不断升高,变化范围分别在(0.74±0.01)~(0.77±0.0),其中1年生牛樟Fv/Fm最小,为(0.74±0.01);3年生牛樟最大,为(0.77±0.01)。牛樟叶片叶绿素ΦPSⅡ、qN、ETR随着苗龄的增加没有明显的变化规律,其中ΦPSⅡ、ETR、qN最小均为2年生牛樟,分别为(0.54±0.00)、(18.2±0.01)、(0.03±0.01);ΦPSⅡ、ETR最大均为3年生牛樟,分别为(0.65±0.00)、(21.7±0.01);温室1年生牛樟qP最小(0.84±0.03),qN最大(0.30±0.02)。差异显著性分析结果表明,不同苗龄牛樟之间Fv/Fo存在显著差异。
根据相同苗龄的牛樟与香樟各参数计算结果(表3)表明,牛樟Fv/Fm明显高于同苗龄香樟,分别为(0.75±0.01)、(0.72±0.01),而牛樟ΦPSⅡ、qP、qN、ETR较低。露天栽培与温室栽培的1年生牛樟幼苗Fv/Fm相同,均为(0.74±0.01);露天栽培的1年生牛樟ΦPSⅡ,qP,ETR显著高于温室栽培的1年生牛樟,分别为(0.63±0.01)、(0.58±0.02),(0.88±0.01)、(0.84±0.03),(21.2±0.03)、(19.5±0.08);露天栽培的1年生牛樟qN显著低于温室栽培的1年生牛樟幼苗,分别为(0.22±0.01)、(0.30±0.02)。同苗龄牛樟与香樟叶片叶绿素Fv/Fm、ΦPSⅡ、ETR均具有显著性差异。

表3 不同苗龄牛樟光合量子产量及电子传送速率
3.3 不同苗龄牛樟叶片吸收光能分配
由表4可知,随着苗龄的增加,牛樟叶片吸收光能中的天线热耗散(D)、光化学耗散(P)和非光化学耗散(N)均无明显的变化规律,其中D最高的为2年生牛樟(0.456±0.002)%,最低为3年生牛樟(0.353±0.003)%。差异显著性分析结果表明,1年生与2年生之间具有显著性差异,而与3年生之间差异不显著。P与D相反,2年生牛樟P最低,为(0.477±0.003)%;3年生牛樟P最高,为(0.597±0.007)%,其中1年生与3年生之间不具有显著性差异。不同苗龄N差别较大,分布范围在(0.057±0.004)%~(0.075±0.006)%之间,最高为1年生牛樟,最低为2年生牛樟。

表4 不同苗龄牛樟吸收光能分配 %
与2年生牛樟相比,本地香樟P、N较高,分别为(0.530±0.008)%、(0.066±0.004)%;D较低,为(0.405±0.004)%(表4)。差异显著性分析结果表明,除N外,同龄本地香樟与牛樟两者间D、P均存在显著差异性。
3.4 叶绿素荧光参数之间的相关关系
有研究表明[21-22]叶绿素经过充分暗适应后,瞬间给予其一个饱和脉冲会使得所有用于光合作用的能量转化为荧光和热,此时叶绿素能够激发的荧光即为最大荧光(Fm),所有植物在自然状态下均无法达到Fm的状态。在实际光合作用过程中Fm表现为不断变化的参数,即Fv,Fv/Fm反映了植物的潜在最大光合能力。Kitajima M and butler W[23]研究指出,多数健康植物的Fv会随着Fm变化而变化。本研究相关性分析结果表明,Fv与Fm之间具有极显著的相关关系(R2=0.990,P<0.01;图1),也证实了这一点。
植物叶片在吸收光能后有3种利用途径[17],一种是以热量耗散的部分(天线热耗散的能量,D),一种是用于光化学反应的部分(P),还有一种是反应中心由非光化学反应耗散的能量(N)。相关性分析结果表明,ETR与ΦPSⅡ、P,P与ΦPSⅡ之间存在极显著正相关关系(R2=0.996,P<0.01;R2=0.923,P<0.01;R2=0.935,P<0.01;图2,图3,图4),D与ΦPSⅡ、ETR之间存在极显著负相关关系(R2=0.993,P<0.01;R2=0.999,P<0.01;图5、图6),说明在光合作用过程中ETR与ΦPSⅡ存在密切联系。同时可以推断光合热耗散的变化会引起荧光的相应变化,其中P即是植物用来光合反应的那部分能量,由于植物吸收能量总体不变,D与N的高低直接决定于PSⅡ过程能量的分配[17,22,24],因此,对比1年生和3年生牛樟幼苗叶片吸收光能的分配情况可以看出,其与Fv/Fm,PSⅡ潜在活性(Fv/Fo),qP及PSⅡ参数的关系可简单描述为:随着牛樟幼苗苗龄的增加,Fv/Fm不断升高,牛樟幼苗抵抗环境胁迫的能力增强,PSⅡ潜在活性增加;天线色素吸收的光能用于光化学反应的部分(P)增加,光合电子传递速率下降,直接表现为qP升高;qN及N有所降低。
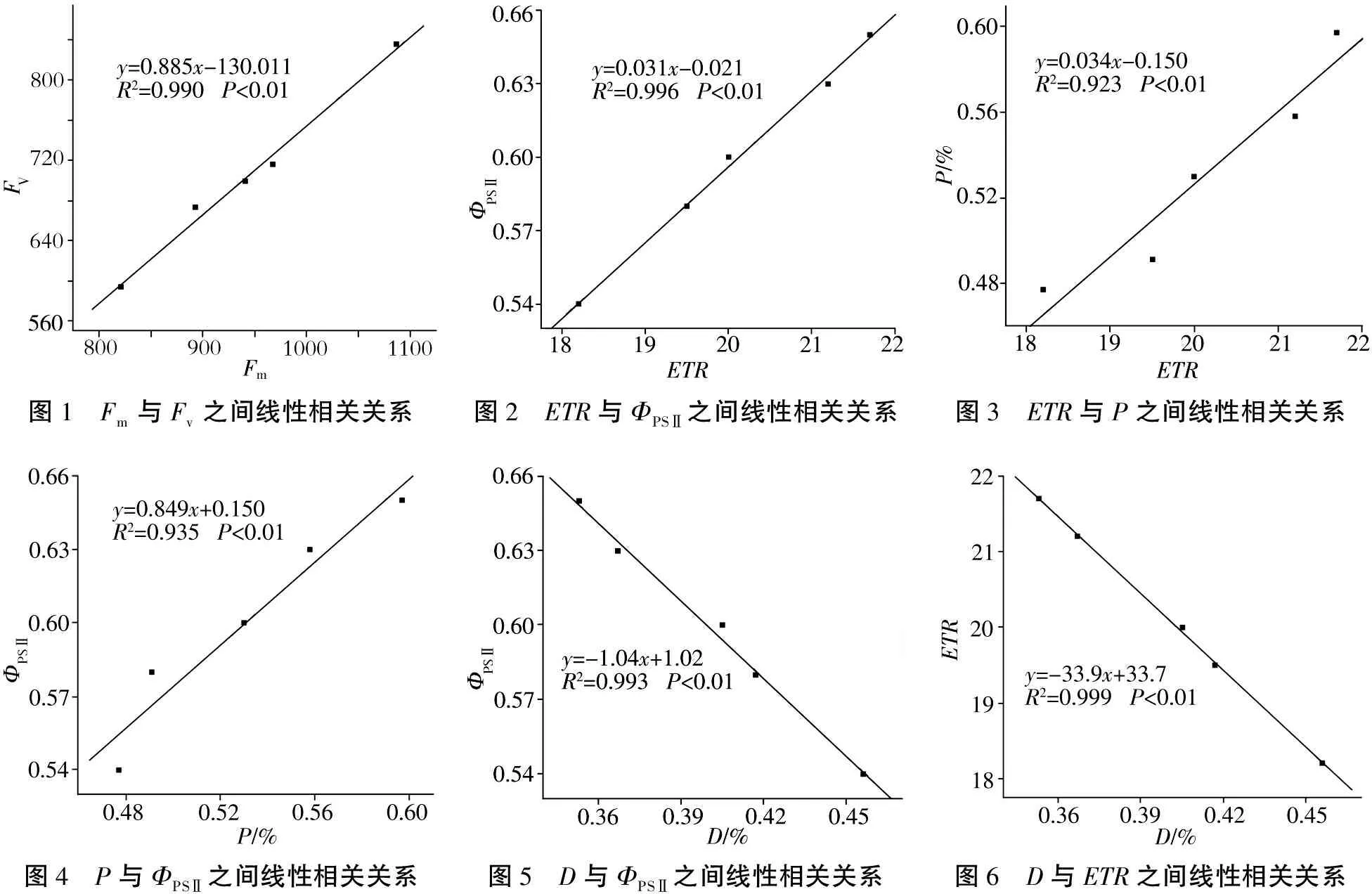
图1 Fm与Fv之间线性相关关系图2 ETR与ΦPSⅡ之间线性相关关系图3 ETR与P之间线性相关关系图4 P与ΦPSⅡ之间线性相关关系图5 D与ΦPSⅡ之间线性相关关系图6 D与ETR之间线性相关关系
4 讨论
4.1 不同苗龄叶绿素荧光差异性分析
不同植物体叶绿素荧光不同[21,25-26],不同荧光值反应的植物生理状态也各不相同,Krause等[26]研究表明色素吸收的光能绝大部分用来进行光化学反应,一般植物只有约3%~5%的能量用于产生荧光。在接受极弱光刺激时,植物产生的初始荧光(Fo)高低与叶绿素浓度直接相关[27]。本研究中随着牛樟苗龄的增加Fo不断升高,说明随着牛樟幼苗苗龄的增加,其新叶中叶绿素含量不断升高,更有利于叶片光合作用的进行,有助于牛樟幼苗的生长,也在一定程度上说明大龄幼苗进行光合作用积累有机物的速率更快[13]。
传统研究认为Fv/Fm值约为0.832±0.004[28],现在叶绿素荧光研究领域普遍认为,在健康生理状态下绝大多数高等植物的Fv/Fm在0.8~0.85之间[23],当Fv/Fm下降时,代表植物受到了胁迫。本研究结果中所有牛樟幼苗Fv/Fm均在0.8~0.85之外,说明牛樟从台湾引种到福建后已发生了环境胁迫作用。进一步分析发现3年生牛樟Fv/Fm显著高于其它苗龄牛樟,说明3年生牛樟潜在最大光合能力最高,应对胁迫的能力也最强。随着苗龄的增加牛樟幼苗潜在光和能力逐渐升高,也在一定程度上反映了3年生幼苗对外部环境已经形成了一定的适应性,随着苗龄的增加,抵抗外界环境胁迫的能力逐渐增强。
ΦPSⅡ反映的是PSⅡ过程的实际光合量子产量[29],是植物叶片光合电子传递速率的相对指标,反映了叶片在光下的实际光能转化效率,一般植物正常情况下ΦPSⅡ与Fv/Fm的变化趋势相同。本研究中3年生牛樟叶片ΦPSⅡ最大,表明3年生牛樟不仅潜在最大光合能力最高,实际光能转化效率也最高。有研究表明[28-29],在光合作用过程中ΦPSⅡ受到诸多因素的影响,但主要决定于Fs和Fms。在光诱导的过程中,Fv和Fm均会逐渐达到一个趋于稳定的状态[28],此时相对稳定的荧光值为Fs,叶片暴露光源下进行光合作用时的最大荧光值为Fms。对Fms和Fm进行比较可以发现,Fms远低于Fm,这是由于在光照下光合作用进行时,发生了荧光淬灭[22,30]。Kramer DM等[24]提出,植物吸收的光能有3种消耗方式:光合作用、叶绿素荧光和热耗散,光合作用和热耗散均会引起叶绿素荧光的降低,其中由光合作用引起的荧光降低称为光化学淬灭(qP),由热耗散引起的荧光降低称为非光化学淬灭(qN)。qP反映了植物光合活性的高低,qN反映了植物耗散过剩光能为热的能力,也就是光保护能力[30]。本研究中,随着苗龄的增加qP逐渐升高,而qN没有明显的变化规律,说明随着牛樟苗龄的增加,由于3年生牛樟ΦPSⅡ和Fv/Fm的升高,直接导致了其光合活性增加,而qN则反映发生光胁迫下植物耗散过剩光能实施自我保护,1年生牛樟幼苗的自我保护能力更强。
很多研究者[29,31]将理想状态下PSⅡ吸收的光能占总入射PAR的比例称为ETR,且ETR被看作是CO2吸收或者是O2排出的速率。已有研究表明[31]ETR的高低与ΦPSⅡ紧密相关,但有所区别,由于ETR被看做是理想状态下通过计算而来,所以一般状态下均远大于ΦPSⅡ值。本研究中不同苗龄牛樟之间ETR差异明显,其中1年生和3年生牛樟幼苗ETR显著高于2年生牛樟,说明1年生和3年生牛樟生理活性远高于2年生牛樟,其结果与ΦPSⅡ反映结果基本相同。这可能与2年生幼苗在苗龄达到12个月时进行过栽培袋的更换有关,栽培袋的更换在一定程度上会损伤幼苗根系,从而影响到2年生幼苗的生长状态。
4.2 相同苗龄牛樟与本地香樟叶绿素荧光比较分析
植物对环境的适应性直接表现在植物生长状况上[13],其实质是吸收利用光能供自身生长的能力的外在表现,叶绿素荧光分析更具有反映植物“内在性”的特点[12],有研究表明[13,27],通过测定植物叶绿素荧光释放量来诊断植物光合性能的高低可作为衡量引种是否成功的标准。Kitajima M[23]在研究中指出Fm、Fv、Fv/Fm、Fv/Fo、qP、qN与植物品种有关,Fs、Fms、ΦPSⅡ、ETR与PSⅡ过程中实际环境因素更为密切[28],在一定程度上受到环境因素的影响。与本地香樟叶绿素荧光参数相比,同龄牛樟Fm、Fv、Fv/Fm和Fv/Fo均显著升高,Fo、Fs、Fms、qP、qN、ΦPSⅡ、ETR显著降低。台湾引种牛樟引种异地后对受到环境胁迫使得Fs、Fms、qP、qN、ΦPSⅡ、ETR降低,而其Fm、Fv、Fv/Fm、Fv/Fo受影响较小。对于本地香樟来说,经过长期自然进化、品种选育,已形成了良好的环境适应性[19],因此Fs、Fms、ΦPSⅡ、ETR较高。相对于牛樟,本地香樟最大荧光较低、潜在最大光合能力较低,PSⅡ潜在活性较低,应对环境胁迫的能力也较差。牛樟是台湾珍贵针叶五阔树种之一,木材含有大量松油醇,并且牛樟具有较高的药用价值,与本地香樟相比,牛樟叶绿素荧光特性较为优良,但作为引种植物,需要一个驯化、选育的过程方能成为推广良种。
4.3 相同苗龄露天与温室栽培牛樟叶绿素荧光比较分析
植物在幼苗期接受适当的环境刺激,有助于其提高抵御环境胁迫的能力,适应环境条件[12]。为进一步明确环境因素对植物叶绿素荧光造成的影响,本研究选取了温室栽培与露天栽培的1年生牛樟进行比较,结果表明,露天栽培牛樟幼苗qP、ΦPSⅡ、ETR均显著高于温室栽培苗,说明露天栽培显著提升牛樟幼苗光合速率及对光能的实际利用率,Margarita Pérez-Jiménez等[13]对樱桃的研究也表明,适当的环境胁迫有助于增加幼苗对光能的利用率,因此在引种选育的过程中应注重适当进行炼苗。
5 结论
研究表明,不同苗龄台湾牛樟的叶绿素荧光特性具有差异,主要表现为大龄幼苗叶绿素荧光参数Fv/Fm、ΦPSⅡ、qP及ETR较高。对于幼龄牛樟而言,适当的环境胁迫将有助于提高其抵抗环境胁迫的能力。与本地香樟相比,相同苗龄牛樟的Fm、Fv、Fv/Fm、Fv/Fo较高,Fs、Fms、ΦPSⅡ、ETR较低,反映出台湾牛樟的光合能力较强,但作为引种树种仍需要对引种地环境有一个适应的过程,经驯化、选育等过程后方可进行大面积推广种植。
参考文献:
[1]刘洪谔,张若蕙,沈锡康,等.7种台湾特产珍贵树种的引种[J].浙江农林大学学报,1994(3):315-319.
[2]朱慧芬,张长芹,龚洵.植物引种驯化研究概述[J].广西植物,2003,23(1):52-60.
[3]赵善欢,张业光,蔡德智,等.印楝引种试验初报[J].华南农业大学学报,1989(2):34-39.
[4]张继方,代色平,傅小霞,等.观赏簕杜鹃在广州地区的引种及综合评价[J].热带农业科学,2016,36(8):38-44.
[5]张丽君,梁远楠,周莹,等.广东肇庆金花茶引种现状及发展建议[J].中南林业调查规划,2016,35(1):6-9.
[6]杨艳敏,凌娜,潘一展.我国美国红栌产业现状及发展思路[J].特种经济动植物,2016,19(6):25-27.
[7]肖泳,尤文忠,李振宇,等.辽宁省引种美国红枫现状及发展建议[J].辽宁林业科技,2015(3):46-48.
[8]Howe P L,Reichelt-Brushett A J,Clark M W,et al.Toxicity estimates for diuron and atrazine for the tropical marine cnidarian Exaiptasia pallida,and in-hospite Symbiodinium,spp.using PAM chlorophyll-a,fluorometry[J].Journal of Photochemistry & Photobiology B Biology,2017(171):125-132.
[9]Gao R,Wang Z,Shi J,et al.Effect of Bursaphelenchus xylophilusinfection on leaf photosynthetic characteristics and resource-use efficiency of Pinus massoniana[J].Ecology & Evolution,2016,7(10):3455-3463.
[10]Jiang Y,Wang X,Yu X,et al.Quantitative trait loci associated with drought tolerance in Brachypodium distachyon[J].Frontiers in Plant Science,2017(8):1-10.
[11]Miao L F,Yang F,Han C Y,et al.Sex-specific responses to winter flooding,spring waterlogging and post-flooding recovery in Populus deltoids[J].Scientific reports,2017,7(1):2534.
[12]龚莎莎,江洪,马锦丽,等.安吉毛竹林净生态系统碳交换量及叶绿素荧光参数的变化[J].浙江农业学报,2016,28(6):1003-1008.
[13]Pérez-Jiménez M,Carmen Piero M,López-Ortega G,et al.Two minuses can make a plus:waterlogging and elevated CO2interactions in sweet cherry (Prunus avium) cultivars[J].Physiol Plant,2017,161(2):257-272.
[14]Hartings S,Paradies S,Karnuth B,et al.The DnaJ-like zinc-finger protein HCF222 is required for thylakoid membrane biogenesis.[J].Plant Physiology,2017,174(3):1807.
[15]徐圆圆,杜佩莲,刘旭庆,等.不同处理对红心杉微扦插苗木生根及叶绿素荧光参数的影响[J].北华大学学报:自然科学版,2016,17(4):530-536.
[16]高毓斌.牛樟之扦插繁殖[J].林業試驗所研究報告季刊,1993,8(4):371-388.
[17]李晶,林雄杰,何静敏,等.牛樟芝菌丝体和子实体三萜含量测定及Se和Mvd基因表达分析[J].西南农业学报,2016,29(9):2206-2211.
[18]杨海宽,章挺,汪信东,等.牛樟叶精油化学成分分析及类型划分研究[J].江西农业大学学报,2016,38(4):668-673.
[19]彭真汾,王威,谢倩,等.牛樟资源保护现状及繁育研究进展[J].亚热带农业研究,2016,12(1):68-72.
[20]林永洲.台湾牛樟引种造林试验初报[J].福建热作科技,2017,42(1):39-43.
[21]Schreiber U.Pulse-Amplitude-Modulation (PAM) fluorometry and saturation pulse method:an overview.In GC Papageorgiou,Govindjee,eds,Chlorophyll Fluorescence:a Signature of Photosynthesis,Ed 1[J].Springer,2004,(19):279-319.
[22]Schreiber U,Bilger W,Schliwa U.Continuous recording of photochemical and non-photochemical chlorophyll fluorescence quenching with a new type of modulation fluorometer[J].Photosynthesis Research,1986(10):51-62.
[23]Kitajima M,Butler W.Quenching of chlorophyll fluorescence and primary photochemistry in chloroplasts by dibromothymoquinone[J].Biochimicaet Biophysica Acta,1975(376):105-115.
[24]Kramer D M,Johnson G,Kiirats O,et al.New fluorescence parameters for the determination of QA redox state and excitation energy fluxes[J].Photosynthesis Research,2004(79):209-218.
[25]韩博平,韩志国,付翔.藻类光合作用机理与模型[M].北京:科学出版社,2003:253.
[26]Krause G H,Weis E.Chlorophyll fluorescence and photosynthesis:the basics[J].Annual Review of Plant Physiology and Plant Molecular Biology,1991(42):313-349.
[27]Schreiber U (1986) Detection of rapid induction kinetics with a new type of high-frequency modulated chlorophyll fluorometer[J].Photosynthesis Research,1986(9):261-272.
[28]Björkman O,Demmig B.Photon yield of O2 evolution and chlorophyll fluorescence characteristics at 77 Kamong vascular plants of diverse origins[J].Planta,1987(170):489-504.
[29]Genty B,Briantais J-M,Baker N R.The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J].Biochimica et Biophysica Acta,1989(990):87-92.
[30]Van K O,Snel J F H.The use of chlorophyll fluorescence nomenclature in plant stress physiology[J].Photosynthesis Research,1990(25):147-150.
[31]Schreiber U,Bilger W,Neubauer C.Chlorophyll fluorescence as a non-intrusive indicator for rapid assessment of in vivo photosynthesis[M]∥E-D Schulze,MM Caldwell.Ecophysiology of Photosynthesis:Vol 100.Berlin Heidelberg:springer,1995:49-70.

