人牙髓干细胞与根尖牙乳头干细胞miRNAs表达谱的差异分析
林诗晗 胡雪刚 吕红兵
人牙髓干细胞(dental pulp stem cells,DPSCs)和根尖牙乳头干细胞(stem cells from the apical papilla,SCAPs)是牙髓和牙髓牙本质复合体形成的基础,为牙根的再生提供保障。研究表明,DPSCs和SCAPs都具有牙本质形成和分化能力,具有相似的牙本质发生和生长因子受体基因,STRO-1和牙本质形成标记物DSPP、BGP等及生长因子 FGFR1、TGFβR1共同表达于体外培养的细胞中[1]。但SCAPs有着更高的溴脱氧尿苷吸收率、更高的倍增数、更强的组织再生能力,表达更高水平的抗细胞凋亡蛋白[2]。推测,SCAPs可能是一种比DPSCs更早期、更优越的牙源性干细胞,在牙髓再生、牙体修复,甚至骨组织的重建中具有更广阔的应用前景。miRNAs的发现为干细胞的干性研究提供了崭新的研究领域。miRNAs是一类在真核生物中长20~25个核苷酸的内源性非编码小分子RNA,成熟的miRNAs通过核酸互补序列识别特异性靶mRNA,使之降解或抑制其翻译,从而抑制蛋白质的合成,达到调控基因表达的目的。
DPSCs和SCAPs是组织工程理想的细胞来源,SCAPs来源于根尖孔未闭合的年轻恒牙,是组织构建的首选。miRNAs在DPSCs和SCAPs中干性的维持作用,目前尚不明确。本研究旨在分析DPSCs和SCAPs中差异表达的miRNAs及其靶基因预测,为进一步阐明miRNAs在DPSCs和SCAPs干性维持中的调控机制提供研究基础。
1 材料与方法
1.1 主要仪器和试剂
超净工作台SW-CJ-IFD型(上海力申科学仪器有限公司);光学显微镜、酶标仪(Heraeu,德国);高速台式离心机(Eppendorf,德国);-80℃超低温冰箱(SANYO,日本);α-MEM、胎牛血清、1 000 U/ml青霉素、1 000 U/ml链霉素、胰蛋白酶(Gibco,美国);Ⅰ型胶原酶、dispase II酶(Sigma,美国);成人骨髓间充质干细胞成骨、成脂诱导分化培养基(Cyagen,美国);鼠抗人STRO-1单克隆抗体(R&D systems,美国);免疫磁珠(Miltenyi Biotec,德国);ALP检测试剂盒(南京建成生物科技有限公司);茜素红、油红O染色液(南京森贝伽生物科技有限公司);TruSeq Small RNA Sample Prep Kit(Illumina,美国)。
1.2 牙髓细胞和根尖牙乳头细胞的培养
选取临床17~20岁健康的第三磨牙,无菌条件下取出牙髓或分离根尖牙乳头组织。剪碎,CD酶(I型胶原酶3 mg/ml,dispase II酶 4 mg/ml)37℃消化 30 min,终止消化后1 000 r/min离心5 min,细胞筛过滤,获得单细胞悬液。加入含10%胎牛血清的 α-MEM培养液,37℃、5%CO2饱和湿度条件下培养7~10 d。细胞生长达70%~80%时用胰蛋白酶消化传代,标记为第1代,取第3代细胞进行后续实验。
1.3 免疫磁珠分选DPSCs和SCAPs
分别取1×107对数生长期的DPSCs和SCAPs,鼠抗人STRO-1单克隆抗体2.5μg/106cells标记;每107细胞加入 60μl running buffer、20μl FcR blocking、20 μl免疫磁珠,混匀后4℃孵育15 min;置LS分选柱中,STRO-1表达阳性细胞结合于分选柱中的磁珠,阴性细胞位于分选液中。收集分选液,其中即为非DPSCs或非SCAPs。准备阳性标本收集管,取下LS柱,加入5 ml running buffer后用活塞快速推下,收集DPSCs和SCAPs。采用CCK-8法检测细胞增殖,连续7 d,实验重复3次。以检测天数为横坐标,A值为纵坐标绘制DPSCs和SCAPs的生长曲线。
1.4 DPSCs和SCAPs的诱导分化鉴定
将细胞克隆胰蛋白酶消化后,以1×104个/孔接种于6孔板。细胞生长至80%汇合后改为成骨、成脂诱导液培养21 d。取诱导后和正常培养的DPSCs、SCAPs按照说明书进行ALP测定,茜素红(4%多聚甲醛室温固定30 min后用1%pH4.1茜素红染色液染色10 min,蒸馏水快速冲洗,干燥,封固后显微镜下观察)和油红O染色(固定后的细胞用新配制的油红O染色液染色15 min,60%异丙醇漂洗30 s,苏木素染色2 min,流水冲洗,晾干后观察)鉴定其分化能力。
1.5 二代测序技术检测miRNAs表达谱
分别取DPSCs和SCAPs,加入Trizol混合后抽提总RNA。使用 TruSeq Small RNA Sample Prep Kit,按照厂家的标准流程,主要步骤如下:使用NanoDrop测定RNA的浓度、琼脂糖凝胶电泳检查RNA的完整性、以及Agilent2100 Bioanalyzer测定RNA的RIN值;完成RNA质检后,使用特异性接头连接miRNAs的3'与5'端,逆转录合成cDNA第一链。随后进行15个循环的PCR扩增,扩增产物经PAGE电泳质检、切胶纯化、Qubit浓度测定以及2100质检后,miRNAs文库构建即告完成。待测miRNAs文库在cBot上完成簇类生长,将流通池转移到HiSeq 2000型测序系统上,按照标准流程进行二代测序及数据分析。实验重复2次。
1.6 miRNAs靶基因及基因功能生物信息学分析
利用miRNAs靶基因数据库进行靶基因预测。经t检验统计分析,对于细胞中表达差异有统计学意义的 miRNAs,应用 DIANA-microT、miRanda、miRBase、PicTar和TargetScanS等软件联合进行生物信息学分析,搜索靶基因。基于Gene Ontology数据库,对靶基因进行GO分类和KEGG pathway的功能分析,进行显著性基因功能筛选。
2 结 果
2.1 DPSCs和 SCAPs的分离
通过酶消化法获得的细胞悬液,7~10 d后达到70%~80%汇合。免疫磁珠筛选STRO-1表达阳性的DPSCs和SCAPs,DPSCs为成纤维样细胞,胞浆突起呈梭形。SCAPs与DPSCs形态类似,没有显著差异(图1)。绘制DPSCs和SCAPs生长曲线,对数生长期内SCAPs细胞数增长较快(图2)。
2.2 DPSCs和SCAPs的诱导分化鉴定
DPSCs和SCAPs的ALP测定值分别为(1.819±0.017)和(1.582±0.026);矿化诱导后的细胞,ALP测定值分别为(3.302±0.024)和(3.431±0.018)。诱导前后比较,差异有统计学意义(P<0.05),表明矿化诱导后的两种细胞都具有成骨细胞的特性。另外,成骨诱导液连续培养10 d左右,细胞局部增厚,似复层生长,密度增高。21 d后进行茜素红染色,可见明亮橙红色矿化结节,周边界限不清(图3)。成脂诱导液连续培养21 d后可见脂滴形成(图4)。
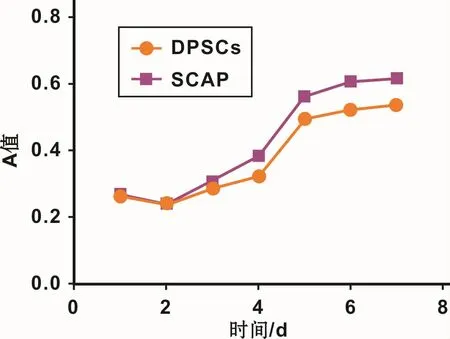
图2 DPSCs和SCAPs的生长曲线Fig 2 The growth curves of DPSCs and SCAPs
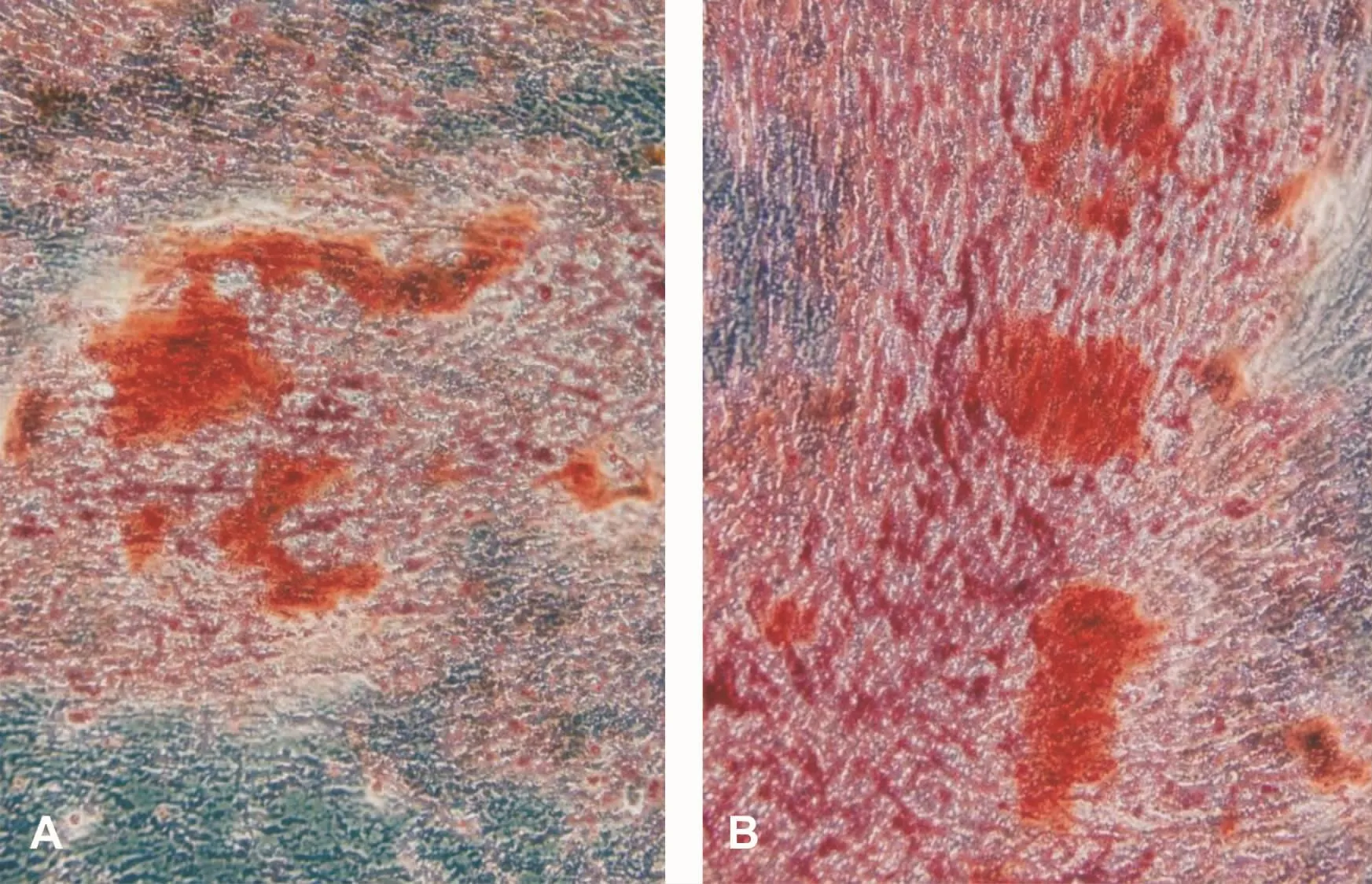
图3 成骨诱导后茜素红染色结果 (×100)Fig 3 Alizarin red staining after osteogenic induction(×100)
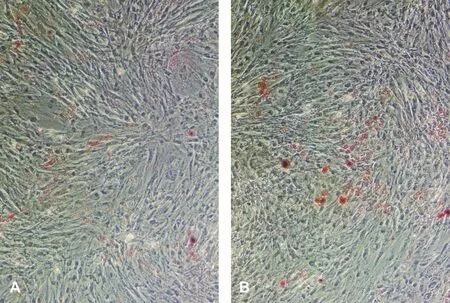
图4 成脂诱导后油红O染色结果 (×100)Fig 4 Oil Red O staining after adipogenic induction (×100)
2.3 DPSCs和SCAPs中miRNAs表达谱差异分析
应用 R package DESeq2(Version 1.6.1)软件,在每组数据中选取变化倍数值 >1.5,P<0.05的 miRNAs。与DPSCs相比,SCAPs中显著下调的miRNAs有7个,分别是 hsa-miR-224-5p、hsa-miR-1247-5p、hsamiR-3065-3p、hsa-miR-452-5p、hsa-miR-767-5p、hsa-miR-4284、hsa-miR-146a-5p,无显著上调miRNAs(图 5)。
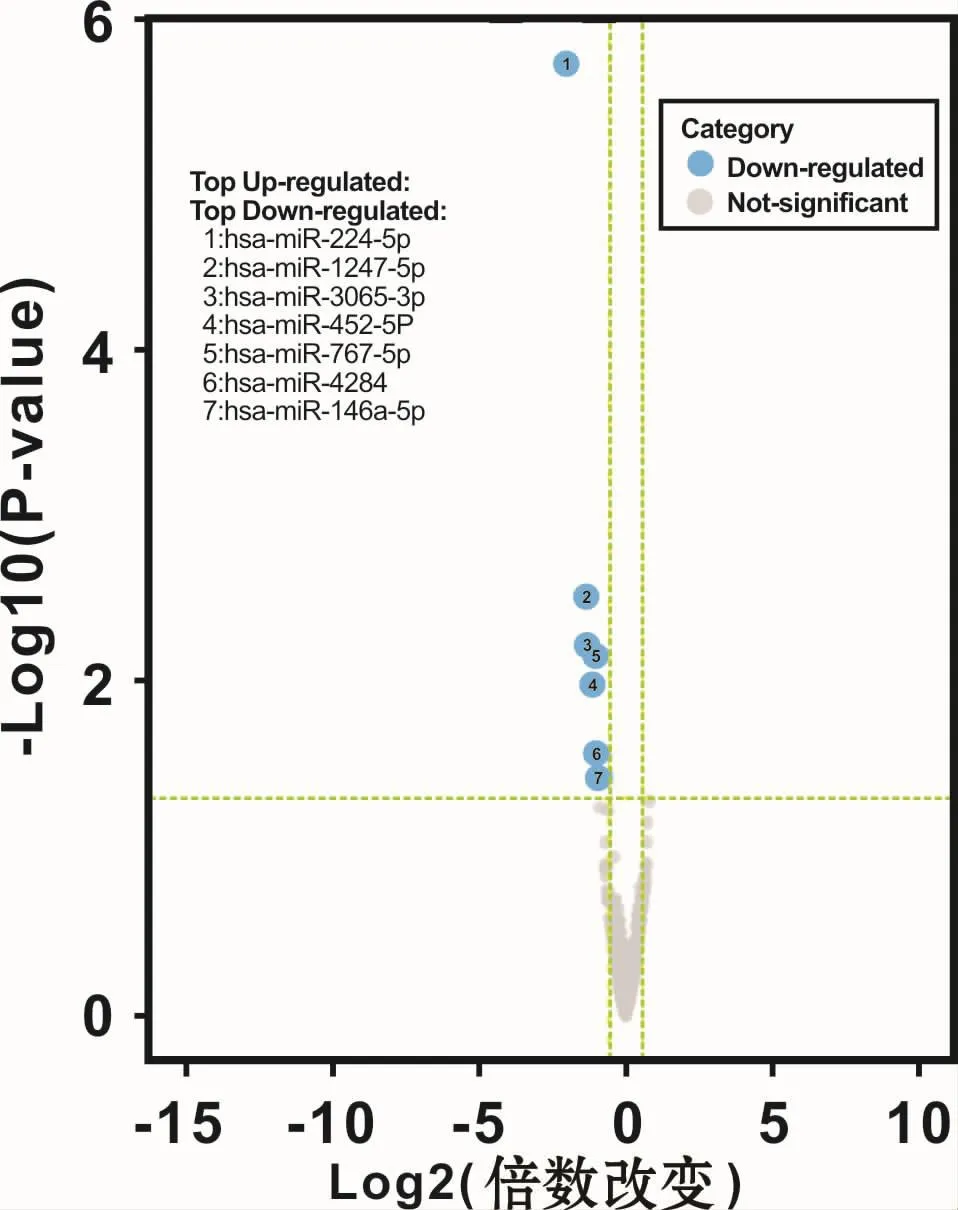
图5 DPSCs和SCAPs差异表达miRNAs火山图Fig 5 The volcano plots of the differentialmiRNA expression between DPSCs and SCAPs
2.4 差异表达miRNAs调控的靶基因
结合生物信息学方法,对miRNAs可能调控的靶基因进行预测。筛选其共同miRNAs,得到SCAPs中表达明显下调的miRNAs调控的关键基因27个:IBA57、POU2F1、PDXK、TPM3、C1orf21、ATXN1、FZD3、ADCY1、ONECUT2、SLC7A1、PRKCA、RIMS3、RAB3B、CBL、SLC1A2、STX3、ASB1、SEPT3、SLC7A1、SFMBT2、SH3BP2、 KPNA4、 KLF13、 NFIB、 IPO9、 CDS2、CSNK1G1。
2.5 差异表达miRNAs靶基因的功能分析
基于Gene Ontology数据库,对靶基因进行GO分类和KEGG pathway分析。GO分类研究表明,差异表达miRNAs主要调控细胞器活性、细胞内和细胞间信号分子传递;影响蛋白活性、蛋白结合和蛋白跨膜转运活动;调节代谢及生物合成,影响细胞分化过程中的形态改变(图6)。KEGG分析结果显示,差异表达miRNAs参与Wnt信号通路、调节干细胞多能性信号通路、细胞寿命调节通路,影响细胞增殖、细胞凋亡和细胞多能性;也参与TRP通道炎性介质监管、mTOR信号通路等。对七个miRNAs靶基因分别进行分析,结果表明,hsa-miR-224-5P的调控与细胞生长、蛋白分解代谢有关;hsa-miR-1247-5p调节信号分子的传递、细胞多能性;hsa-miR-3065-3p调节细胞凋亡;hsamiR-452-5p调节神经嵴干细胞分化;hsa-miR-4284调节染色质组成、细胞迁移;hsa-miR-146a-5p调节转录因子活性,等等。
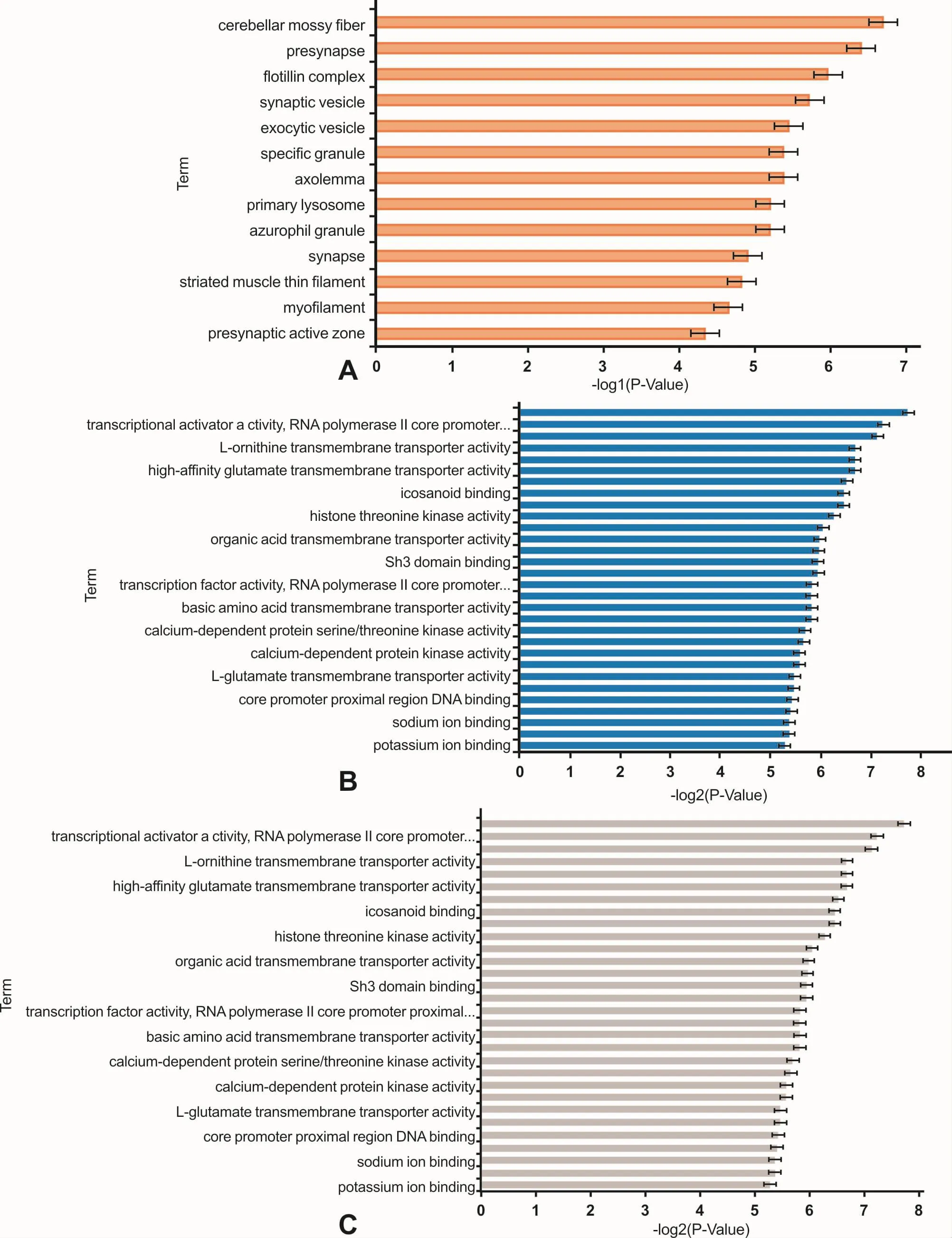
图6 靶基因在细胞组成(P<0.05)、分子功能(排名前30)和生物过程(排名前30)中的功能富集情况Fig 6 The possible roles of the target genes in cellular component(P<0.05),molecular function(top 30)and biological process(top 30)
3 讨 论
DPSCs和SCAPs是口腔医学研究领域重要的组织干细胞。Lei等[2]将大鼠 SCAPs与 DPSCs比较发现,无论体外培养还是体内移植,前者成牙本质和成骨潜能均高于后者。Huang等[3]体外培养人 SCAPs和DPSCs,以中空牙根为载体,移植到免疫功能缺陷的小鼠体内,结果表明根管内有带血管的牙髓样组织形成,同时根管牙本质壁内有新生牙本质沉积。SCAPs再生所形成的牙本质无论是厚度还是成牙本质细胞排列方式都远远好于DPSCs。DPSCs与SCAPs是干性状态不同的两种干细胞,SCAPs可能是组织工程更理想的细胞来源。miRNAs参与生命过程中一系列的重要进程,包括细胞分化、干性维持等。目前,通过基因芯片、二代测序等方法对miRNAs和干细胞的研究发现,干细胞中存在各自特异的miRNAs谱,其表达既具有时空特异性,也具有组织和细胞特异性,对干细胞的自我更新和未分化状态的维持具有重要意义,对干细胞的继续分化和增殖也具有显著的调控作用。
目前已证实miRNAs在多种牙源性干细胞中发挥了高效调控作用,DPSCs中miRNAs的研究较为深入。Gay等[4]发现DPSCs经体外成骨诱导,RUNX2活性增高,miR-218能够调控 RUNX2的表达;Gong等[5]发现DPSCs向内皮细胞分化时共有47个miRNAs的表达变化,差异表达miRNAs的靶基因,被证实与转录调控、血管形态发生、细胞骨架蛋白生成、MAPK和Wnt信号通路等生物学行为和功能有关;Li等[6]发现miR-143和miR-135抑制剂可诱发DPSCs的肌原性分化;Gardin等[7]发现miR-196a的表达能促进钛表面DPSCs的成骨分化。但miRNAs与SCAPs的研究尚少,miRNAs在DPSCs和SCAPs中的作用如何,是如何影响两者干性状态的,目前尚未见报道。
本研究表明,在差异表达miRNAs中,大部分miRNAs调控与神经系统发育、神经元增殖和分化相关。已有研究证实,miR-224可通过Npas4分子调控神经元分化;miR-452在神经嵴细胞中大量存在,调控干细胞分化[8];miR-146在小鼠中促进神经嵴细胞的增殖和分化[9]。DPSCs和SCAPs均来源于神经嵴细胞,这可能是miRNAs在发育早期就对细胞进行了不同程度的干预和调控。下调的miRNAs在SCAPs中低表达,抑制细胞分化,使其能够长期维持干性状态不变,这种猜测有待后续的实验验证。Fan等[10]研究表明miR-224可通过调节离子转运体表达来调控釉质矿化。在本实验功能分析中,miRNAs调节转录因子活性、信号分子传递等,在干细胞中,差异表达miRNAs可能发挥着对细胞分化的调节作用。
另外,miR-3065、miR-452等影响蛋白活性、蛋白结合等,调节细胞寿命和细胞凋亡,这可能是SCAPs表达更高水平抗细胞凋亡蛋白的原因所在,但miRNAs是如何调控这些蛋白的机制尚不清楚。miR-224被证实能够通过DMRT1调控干细胞的自我更新进程,Wnt/β信号通路参与,细胞不断增殖代替死亡细胞,保持干细胞数量不降低[11]。这与本研究中的靶基因功能预测分析相符,可能是SCAPs维持其干性状态的另一可能机制。
大量研究证实,差异表达miRNAs调控着各类癌症的发生[12-14]。本研究显示,miRNAs调控包括mTOR信号通路的多种癌症通路,参与癌症的生长和代谢。在 SCAPs中,差异 miRNAs的表达可能使SCAPs的mTOR或其他信号通路活跃,调控细胞周期,使SCAPs获得更强的增殖能力,这种推论有待进一步证实。
本研究深入地探讨了DPSCs与SCAPs不同干性状态维持的可能机制,结果中miR-224下调显著,且在干细胞中作用的研究甚少,其机制需进一步验证。miRNAs在DPSCs和SCAPs中的研究,为牙齿组织工程和牙髓组织再生中的作用机制探索了新的方向。
[1]Sonoyama W,Liu Y,Yamaza T,et al.Characterization of the apical papilla and its residing stem cells from human immature permanent teeth:A pilot study[J].JEndod,2008,34(2):166-171.
[2]LeiG,Yan M,Wang Z,et al.Dentinogenic capacity:Immature root papilla stem cells versusmature root pulp stem cells[J].Biol Cell,2011,103(4):185-196.
[3]Huang GT,Yamaza T,Shea LD,et al.Stem/progenitor cell-mediated de novo regeneration of dental pulp with newly deposited continuous layer of dentin in anin vivomodel[J].Tissue Eng Part A,2010,16(2):605-615.
[4]Gay I,Cavender A,Peto D,et al.Differentiation of human dental stem cells reveals a role for microRNA-218[J].J Periodontal Res,2014,49(1):110-120.
[5]龚启梅,蒋宏伟,王劲茗,等.人牙髓细胞内皮向分化中miRNA的表达及生物信息学分析[J].中华口腔医学杂志,2014,49(5):284-289.
[6]Li D,Deng T,Li H,et al.MiR-143 and miR-135 inhibitors treatment induces skeletalmyogenic differentiation of human adult dental pulp stem cells[J].Arch Oral Biol,2015,60(11):1613-1617.
[7]Gardin C,Ferroni L,Piattelli A,etal.Non-washed resorbable blasting media(NWRBM)on titanium surfaces could enhance osteogenic properties of MSCs through increase of miRNA-196a and VCAM1[J].Stem Cell Rev,2016,12(5):543-552.
[8]Sheehy NT,Cordes KR,White MP,etal.The neural crestenriched microRNA miR-452 regulates epithelial-mesenchymal signaling in the first pharyngeal arch[J].Development,2010,137(24):4307-4016.
[9]Xiao WZ,Lu AQ,Liu XW,et al.Role ofmiRNA-146 in proliferation and differentiation of mouse neural stem cells[J].Biosci Rep,2015,35(5)pii:e00245.
[10]Fan Y,Zhou Y,Zhou X,et al.MicroRNA 224 regulates ion transporter expression in ameloblasts to coordinate enamelmineralization[J].Mol Cell Biol,2015,35(16):2875-2890.
[11]Cui N,Hao G,Zhao Z,et al.MicroRNA-224 regulates self-renewal ofmouse spermatogonial stem cells via targeting DMRT1[J].JCell Mol Med,2016,20(8):1503-1512.
[12]Zhao F,Lv J,Gan H,etal.MiRNA profile of osteosarcoma with CD117 and stro-1 expression:miR-1247 functions as an onco-miRNA by targeting MAP3K9[J].Int J Clin Exp Pathol,2015,8(2):1451-1458.
[13]Tamaddon G,Geramizadeh B,Karimi MH,et al.miR-4284 and miR-4484 as putative biomarkers for diffuse large B-cell lymphoma[J].Iran JMed Sci,2016,41(4):334-339.
[14]Yang F,Nam S,Brown CE,et al.A novel berbamine derivative inhibits cell viability and induces apoptosis in cancer stem-like cells of human glioblastoma,via up-regulation of miRNA-4284 and JNK/AP-1 signaling[J].PLoS One,2014,9(4):e94443.

