海藻糖类抗冻保水剂对冻藏南美白对虾(Litopenaeus vannamei)品质的影响
白 冬,郑 炜,梁 佳,俞群娣,黄 菊,谢 超
(浙江海洋大学食品与医药学院,浙江舟山 316000)
南美白对虾(Litopenaeusvannamei)肉质鲜美,营养丰富,富含氨基酸、多肽、多不饱和脂肪酸等多种营养成分。但是,由于其体内含有大量的自溶酶和非蛋白质氮,因此在捕捞和贮藏的过程中容易受到微生物的污染,极易腐烂,这也导致其死后变质速度快,质构特性改变严重,产生明显的异味[12]。不仅如此,在贮藏过程中虾中的蛋白质,如肌原纤维蛋白,肌质蛋白和结缔组织蛋白的改性也会直接影响加工贮藏过程中虾的嫩度,保水能力以及风味等品质[3]。
冷冻贮藏作为一种长期保存虾类产品最常用的方法,可以抑制微生物的生长,降低酶的活性。但在冷冻贮藏的过程中,产品的质量得不到有效保证[4]。另外,产品冻融的过程中也有可能发生蛋白质变性,脂质氧化,保水能力下降等不良变化,对产品的营养品质产生了负面影响,降低了消费者对虾的可接受性[5]。
焦磷酸盐是目前水产品中常用的添加剂,能够显著的改善产品的功能特性,对水产品质量的提高发挥了积极地作用,例如提高新鲜食物的保水性,减少冷冻产品的融化损失,保持产品质构特征,减缓氧化酸败等[67]。但许多国家对磷酸盐作为防腐剂的使用有严格的规定[8],在虾仁的处理过程中,焦磷酸盐的添加仍存在着一些问题,某些不法商贩为自己利益,在虾类产品的加工过程中过度添加焦磷酸盐,出现半透明粘稠的胶体物质,以假冒真,从而引发消费欺诈问题[9]。因此,在保证产品品质的同时并杜绝此类问题的发生,研究新的添加剂用以替代焦磷酸盐成为虾类产品开发的一个重要课题[1011]。
研究发现海藻酸钠寡糖在某些植物细胞中能够促进生长活性的增强[12],能够有效地促进氧化自由基的清除[13],并且能与鱼肌原纤维蛋白共轭提高其溶解度[14]。虽然海藻糖、海藻酸钠及其寡糖的优点及其应用得到了食品领域的广泛关注,但在虾类保鲜领域却少有研究。因此,本文通过对上述糖类的抗冻效果及其对冷冻南美白对虾仁质量影响的研究,开发出一种能够有效提高冷冻虾类产品质量的抗冻保鲜剂,为水产品冷冻保鲜提供新的思路。
1 材料与方法
1.1 材料与仪器
鲜活南美白对虾 体长9~10 cm,由舟山越洋食品有限公司提供,将鲜活虾体置于装有冰块的保温箱内,30 min内运回实验室;海藻糖(C12H22O11)、海藻酸钠([C6H7NaO6]n,32~200 kDa)、海藻酸钠寡糖([C6H7NaO6]n,n=2~4,440~800 Da) 北京国药化学试剂有限公司;焦磷酸钠 纯度>99%,食品级,青岛博智汇力生物科技有限公司;顺丁烯二酸、牛血清蛋白、三氯乙酸、亚硫酸氢钠及米吐尔等其他试剂 均为分析纯。
CR10型便携式色差仪 日本柯尼卡美能达公司;DHS20A卤素水分测定仪 上海菁海仪器有限公司;HD3A型水分活度测定仪 无锡市华科仪器仪表有限公司;均质机 德国IKAStaufen。
1.2 实验方法
1.2.1 实验原料处理 经前期预实验发现0.5%与1.0%磷酸盐类对虾仁有较好的抗冻保水效果,因此研究中使用的溶液如下:蒸馏水(阴性对照);0.5%和1.0%(w/v)焦磷酸钠(阳性对照);0.5%和1.0%(w/v)海藻糖;0.5%和1.0%(w/v)海藻酸钠;0.5%和1.0%(w/v)海藻酸钠寡糖。将去头、去壳和去肠的虾立即浸入提前制备好的溶液(0 ℃)中,浸泡30 min,使冷冻保护物质扩散到虾的表面上。
在浸泡完成后取出样品,沥干1 min后准确称取单个虾仁初始重量M1,并在30 ℃的冷冻机中冷冻3 h。随后,将来自不同组的冷冻样品装入聚苯乙烯托盘中,每盘20只样品并编号,将其放置在聚酰胺聚乙烯袋(20.0 cm×25.0 cm,150 μm)中,所有处理好的样品在18 ℃下贮藏6周,每个组的样品在冷冻贮藏期间每隔1周进行相关分析,在分析之前,将冷冻样品在冰箱(4 ℃)中解冻3 h。每个组样品平行测定三次。
1.2.2 解冻损失的测定 在解冻后立即测试冷冻虾的解冻损失,参照文献[15]的方法,对样品进行离心。每组随机选取3只样品,在4 ℃下以1500×g离心10 min后,准确称量每个样品离心后的重量M2,根据冷冻前的初始重量M1,计算冷冻虾的解冻损失如下:解冻损失(%)=(M1M2)/M1×100。
1.2.3 颜色测定 采用色差仪测定虾仁的L*、a*、b*值,测定前进行白板校正。以虾仁第2腹节为测试点,每个处理组取3个样品(3个重复),取平均值作为最终测试结果[16]。
1.2.4 肌原纤维蛋白含量的测定 依据夏秀芳等的研究[17],使用捣碎机将每个样品切碎,并在10倍体积的0 ℃缓冲液(Trismaleate 20 mmol/L,KCl 0.05 mol/L,pH=7.0)中利用均质机,在0~4 ℃以10000 r/min均质60 s。将得到的匀浆物在0~4 ℃以10000×g离心15 min,取沉淀,将沉淀物置于相同的缓冲液中再次萃取。反复均质和离心两次之后,将所得的沉淀物加入到10倍体积的0 ℃缓冲液(Tris-maleate 20 mmol/L,KCl 0.6mol/L pH=7.0)中,再将混合物均质并在4 ℃下以6000×g离心15 min。最后所得上清液即为肌原纤维蛋白溶液,将其在适当稀释后通过Lowry[18]等方法进行测定,以牛血清白蛋白用作标准液(线性方程为y=0.2308x0.2931,R2=0.9895),重复测定三次。
1.2.5 Ca2+ATP酶活性的测定 根据蒙健宗等[19]方法配制混合溶液,取1.0~2.0 mg/mL样品肌原纤维蛋白悬浮液,每组样品中加入预冷的混合底物:0.50 mol/L马来酸缓冲液,0.10 mol/L CaCl2,20 mmol/L ATP,调节pH=7.0。反应液充分混匀,在30 ℃振荡温育5 min,反应完成后取出置于冰浴中,随后加入1.0 mL冷冻的15%(w/v)三氯乙酸(TCA)终止反应。然后将反应混合物以4000×g离心5 min。
根据上步操作,测定在上清液中释放的无机磷酸盐的量。在离心后的上清液中加入钼磷比色剂,于30 ℃下显色反应30 min。随后加入25%(w/v)柠檬酸三钠终止反应,在波长650 nm处测定OD值,根据标准曲线(线性方程为y=0.6308x0.3219,R2=0.4892)计算得到磷含量。Ca2+ATP酶活性以每毫克蛋白质每分钟酶促水解ATP生成无机磷酸盐的含量表示[μmol Pi/(mg·min)][20]。
1.2.6 苏木精伊红染色实验 在室温下取虾仁背部肌肉组织于包氏固定液中固定24 h,梯度乙醇脱水,进一步石蜡包埋,切片染色,然后用光学电子显微镜观察肌肉组织结构变化情况。
1.2.7 SDS聚丙烯酰胺凝胶电泳 取虾肉5 g,加入5%的SDS溶液(50 g/L)45 mL,在10000 r/min条件下均质5 min,每均质30 s,停止30 s,以防过热。均质后的溶液置于85 ℃恒温水浴中保温1 h,接着在10000 r/min条件下离心30 min(4 ℃),取上清液备用。
根据Laemmli的方法[21],使用5%浓缩胶和12%分离胶对样品蛋白上清液和标准蛋白溶液进行SDS聚丙烯酰胺凝胶电泳(SDSPAGE)。电泳完成后的凝胶条在甲醇醋酸溶液中用0.1%考马斯亮蓝R250进行染色,染色完成后用乙醇醋酸溶液对其进行脱色。通过将其与标准蛋白质溶液(10~200 kDa)条带进行比较来确定样品蛋白的相对量。
1.2.8 数据处理 数据处理及作图采用Origin 8.1、SPSS 13.0统计分析软件,结果为平均值±标准偏差,采用SNK法分析测验显著性水平(p<0.05)。
2 结果与分析
2.1 解冻损失
对于冷冻虾类产品而言,解冻损失是其质量水平的重要衡量标准之一,对添加不同抗冻剂的冷冻虾仁及其对照组的解冻损失进行了测定,结果如表1所示。

表1 不同抗冻剂对样品解冻损失的影响(%)Table 1 Effect of different cryoprotective saccharides on thawing loss of shrimp during frozen storage(%)
根据表1可知,随着贮藏时间的延长,水处理样品的解冻损失显著升高(p<0.05)。0.5%和1.0%的海藻酸钠处理的样品,其解冻损失与水处理对照组之间没有显著差异(p>0.05)。相比之下,在冻藏期间,0.5%和1.0%焦磷酸盐、海藻糖和海藻酸钠寡糖3种抗冻剂处理的样品,其解冻损失保持在较低的水平。因此,与阴性对照组相比,这3种抗冻剂处理的样品显示出更高(p<0.05)的抗冻效果,3组间的差异无统计学意义(p>0.05)。
阴性对照组的解冻损失明显增加(5.85%~8.60%),可能归因于样品肌肉蛋白质的不可逆性和冻结过程中肌肉纤维的破坏,这是由冰冻贮藏期间形成大冰晶而引起的[22]。冷冻过程中形成的结晶水在解冻过程中没有被样品组织再吸收,导致样品解冻损失较高。通过数据可知,与阴性对照组相比,海藻酸钠溶液对冷冻虾的解冻损失没有显著差异。一些研究表明,低分子质量的碳水化合物可以提高肌原纤维蛋白的稳定性[2324]。本研究中使用的海藻酸钠的分子量范围为32~200 kDa,因此在冷冻过程中很难与水发生相互作用。这表明高分子量的海藻酸钠对冷冻虾并无抗冻作用,反而干扰了肌肉蛋白质的三维结构[25]。另外在实验中发现,原料在添加了海藻酸钠后变得非常粘稠,这种性质也会降低其在加工上的实用性。焦磷酸钠处理的样品在解冻后保持了虾仁本身的特性,这与Ribeiro发现一致[26],在冷冻过程中,焦磷酸钠对样品组织具有抗冻效果。在冻藏过程中,海藻糖处理组显著降低了冻虾体液的流失(解冻损失为5.00%~5.44%),且1.0%高浓度处理优于0.5%低浓度处理组。其原因为海藻糖分子在肌肉组织中与蛋白质结合形成晶状体,从而使得蛋白质分子结构更紧密稳定,在冻藏期间起到保护作用。海藻酸钠寡糖同样可显著降低样品的解冻损失(5.04%~5.52%),高浓度处理组效果优于低浓度处理组。其原因可能在于海藻胶低聚糖可与肌肉中Ca2+、Mg2+发生螯合作用形成稳定的三维网络,从而降低了虾仁在解冻过程中水分的流失。综上所述,1%的海藻糖与海藻酸钠寡糖对冻虾具有更好的抗冻保水性。
2.2 颜色变化
水产品的颜色是十分重要的一个感官指标,直接决定了消费者的购买决策。在0~6周的冻藏期内,不同处理组虾仁的a*、b*值变化不显著(p>0.05),表明以上各抗冻剂处理对虾仁红绿度和黄蓝色光线的吸收和反射无显著影响。因此仅讨论冷冻虾仁的L*值随着冷冻时间变化的情况,结果如表2所示。

表2 不同抗冻剂对冻藏虾仁L*值的影响Table 2 Effect of different antifreeze agents on the L* value of frozen shrimp
根据表2可知,在冷冻贮藏3周后,水处理组、0.5%和1.0%海藻酸钠溶液处理组的虾仁样品,其L*值发生了显著的下降(p<0.05),色泽由明亮逐渐变暗,可能此时冻藏的虾仁肌肉肌原纤维蛋白结构破坏程度以及ATPase活性下降程度较大,使得表观明度发生变化。然而与前述样品相比,两种浓度的焦磷酸钠、海藻糖和海藻酸钠寡糖溶液处理的样品,在冷冻贮藏期间L*值的变化不明显,样品稍显暗淡。1.0%焦磷酸钠、1.0%海藻糖和1.0%海藻酸钠寡糖处理组之间无显著差异(p>0.05)。海藻糖和海藻酸钠寡糖在冷冻过程中提高了蛋白质结构的稳定性,增强了样品肌肉的持水能力,这显著减缓了冷冻贮藏过程中形成的大冰晶对样品组织造成的物理损伤。
2.3 肌原纤维蛋白分析
肌原纤维蛋白对水产品的品质起到重要的作用,其含量直接影响了蛋白的弹性、多汁性、口感等感官指标。冻藏南美白对虾样品肌原纤维蛋白的测定结果见图1。
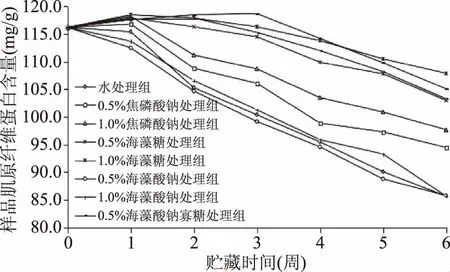
图1 不同抗冻剂对冻藏虾仁肌原纤维蛋白含量的影响Fig.1 Effect of different antifreeze agents on the myofibrillar protein content of frozen shrimp
从图1中可以看出,所有处理组中,肌肉中的肌原纤维蛋白含量均随冷冻贮藏时间增加发生显著下降(p<0.05)。未进行冷冻的新鲜样品肌肉初始肌原纤维含量为115.6 mg/g。冷冻贮藏6周后,水处理组和0.5%、1.0%海藻酸钠处理组样品的肌原纤维含量分别降至84.6、85.1和84.8 mg/g。相比之下,焦磷酸盐、海藻糖和海藻酸钠寡糖处理的样品含量较高,其肌原纤维含量分别达到92.6~95.9、100.6~104.2、101.0~103.2 mg/g。根据实验测得的数据发现,与水处理相比,样品经过1.0%海藻糖与1.0%海藻酸钠寡糖抗冻剂处理过后,其肌肉中肌原纤维蛋白的流失明显的减少(p<0.05)。
2.4 Ca2+ATP酶活性
Ca2+ATP酶活性是衡量被测样本生物活性的一项重要指标,研究中对不同抗冻剂处理过的南美白对虾仁样品进行了Ca2+ATP酶活性的测定,结果如图2所示。
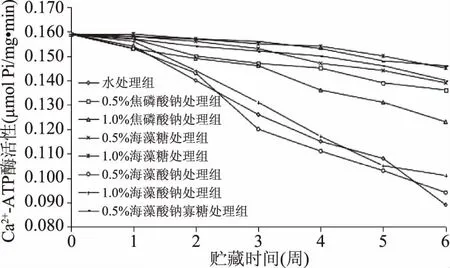
图2 不同抗冻剂对冻藏虾仁Ca2+ATP酶活性的影响Fig.2 Effect of different antifreeze agents on the Ca2+ATPase activity of frozen shrimp
通过图2可知,不同抗冻剂处理过的样品在冻藏期间,Ca2+ATP酶活性均有所降低。未经冷冻新鲜样品的初始Ca2+ATP酶活性为0.162 μmol Pi/mg·min,在冷冻贮藏6周后,阴性对照组样品Ca2+-ATP酶活性显著下降(p<0.05),降低至0.092 μmol Pi/mg·min,阴性对照组和海藻酸钠处理组样品之间无显著差异(p>0.05),焦磷酸钠处理组样品的Ca2+ATP酶活性降低至0.122~0.131 μmol Pi/(mg·min),而海藻糖和海藻酸钠寡糖处理样品中的活性分别为0.134~0.141 μmol Pi/(mg·min)和0.135~0.142 μmol Pi/(mg·min),酶活性差异不明显。但与阴性对照组相比,海藻糖和海藻酸钠寡糖抗冻剂处理的样品表现出了较高的Ca2+ATP酶活性(p<0.05)。
2.5 苏木精伊红染色实验
染色实验通过对样品的微观结构进行观察,能够更为直观的评价几种抗冻剂对冷冻贮藏的南美白对虾仁的抗冻效果。不同抗冻剂处理的虾仁样品肌肉组织纵剖面微观结构如图3所示。
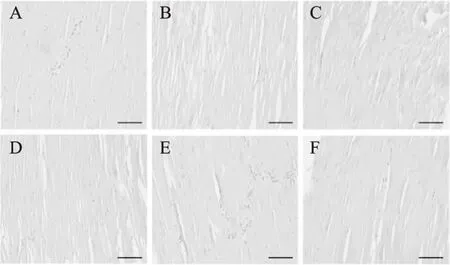
图3 不同抗冻剂对于蒸煮虾仁肌肉组织结构的影响Fig.3 Effect of different antifreeze agents on the muscular tissue structure of frozen shrimp注:A为未经冷冻处理的新鲜虾肌肉,B为水处理过的虾肌肉,C为1.0%焦磷酸钠处理过的虾肌肉,D为1.0%海藻酸钠处理过的虾肌肉,E为1.0%海藻糖处理过的虾肌肉,F为1.0%海藻酸钠寡糖处理过的虾肌肉。
通过图3可以看出,未经冷冻的新鲜样品(图3A)的肌纤维(红)之间紧密连接,纤维间的间隙(空白)较窄小。在6周的冷冻贮藏之后,水处理组样品(图3B)肌纤维间的间隙明显增大,其中部分肌纤维变得松散甚至紊乱,说明肌肉结缔组织的机械强度相对较弱,可能是由于冷冻贮藏期间形成的大冰晶对样品组织造成物理损伤。相比之下,焦磷酸钠、海藻糖和海藻酸钠寡糖处理组(图3C、图3E、图3F)样品的肌纤维间隙明显更小,肌纤维比水处理组样品排列更为紧密。海藻酸钠处理组(图3D)与水处理组样品相比,肌肉组织的物理结构产生相似变化,这与前文所述的结论相一致。
2.6 SDSPAGE
对添加不同抗冻剂处理组样品的蛋白质进行SDSPAGE实验,得到的电泳图谱如图4所示。根据电泳图谱,约200 kDa的宽带对应肌球蛋白重链(MHC),同时还存在副肌球蛋白(约90 kDa)和肌动蛋白(约40 kDa)。附加条带对应原肌球蛋白(约37 kDa)和肌球蛋白轻链(MLC,约20 kDa)。与抗冻剂处理组样品(图4A~图4D)相比,水处理组样品(图4E)中的MHC、副肌球蛋白、肌动蛋白和MLC的强度在冷冻贮藏6周后发生显著降低。在没有添加防冻剂处理的样品中,MHC和MLC条带开始显著消失。这可能是由于冷冻贮藏期间蛋白发生变性或水解。另外,内源性蛋白酶(如组织蛋白酶、钙蛋白酶)和丝氨酸蛋白酶的氧化作用也促进了蛋白质的降解。海藻酸钠处理的样品与焦磷酸钠、海藻糖和海藻酸钠寡糖处理的样品相比,其副肌球蛋白和肌动蛋白条带的强度具有明显的降低。
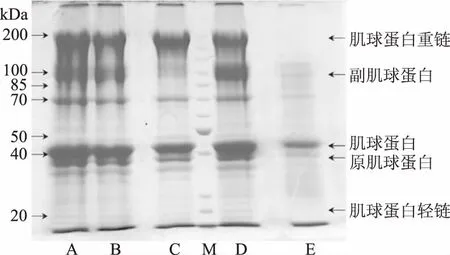
图4 不同抗冻剂冻藏6周后肌肉蛋白的SDSPAGE分析Fig.4 SDSPAGE analysis of muscle proteins after 6 weeks of frozen antifreeze注:A为1.0%焦磷酸钠处理过的虾肌肉,B为1.0%海藻糖处理过的虾肌肉,C为1.0%海藻酸钠处理过的虾肌肉,D为1.0%海藻糖处理过的虾肌肉,E为水处理过的虾肌肉,M为标准分子量(20~200 kDa)。
3 结论
0.5%和1.0%焦磷酸盐、海藻糖和海藻酸钠寡糖浸泡处理显著降低了虾仁解冻损失率,同时还具有保持冻藏虾仁色泽白色鲜艳的作用。焦磷酸盐、海藻糖和海藻酸钠寡糖处理的样品含量肌原纤维含量较高,冷冻贮藏6周后分别为92.6~95.9、100.6~104.2、101.0~103.2 mg/g。与阴性对照组相比,添加海藻糖和海藻酸钠寡糖抗冻剂处理的样品Ca2+ATP酶活性显著(p<0.05)高于阴性对照组,冷冻贮藏6周后海藻糖和海藻酸钠寡糖活性分别达到0.134~0.141 μmol Pi/(mg·min)和0.135~0.142 μmol Pi/(mg·min),酶活性下降变化不明显。海藻糖处理虾仁肌肉肌纤维结构完整,肌肉间无较大空隙形成,较好地保持了冻藏虾仁组织完整性。焦磷酸钠、海藻糖和海藻酸钠寡糖处理的样品与海藻酸钠处理的样品相比,其副肌球蛋白和肌动蛋白条带的强度具没有明显的降低。由此可见,海藻糖、海藻胶寡糖抗冻保水剂的开发与利用,可作为冻藏水产品复合磷酸盐保水剂的一种较好替代品,也可为水产品无磷保水剂的开发提供参考方向。
[1]Mastromatteo M,Danza A,Conte A,et al. Shelf life of ready to use peeled shrimps as affected by thymol essential oil and modified atmosphere packaging[J]. International Journal of Food Microbiology,2010,144(2):250256.
[2]邹明辉,李来好,郝淑贤,等. 凡纳滨对虾虾仁在冻藏过程中品质变化研究[J]. 南方水产科学,2010,6(4):3742.
[3]Sundararajan S,Prudente A,Bankston J D,et al. Evaluation of green tea extract as a glazing material for shrimp frozen by cryogenic freezing[J]. Journal of Food Science,2011,76(7):511518.
[4]Gonçalves A A,Gindri Junior C S G. The effect of glaze uptake on storage quality of frozen shrimp[J]. Journal of Food Engineering,2009,90(2):285290.
[5]Soares N M,Mendes T S,Vicente A A. Effect of chitosan-based solutions applied as edible coatings and water glazing on frozen salmon preservationa pilotscale study[J]. Journal of Food Engineering,2013,119(2):316323.
[6]Rattanasatheirn N,Benjakul S,Visessanguan W,et al. Properties,translucence,and microstructure of pacific white shrimp treated with mixed phosphates as affected by freshness and deveining[J]. Journal of Food Science,2008,73(1):3140.
[8]韩敏义,李巧玲,陈红叶. 复合磷酸盐在食品中的应用[J].中国食品添加剂,2004(3):9396.
[9]Kaewmanee T,Benjakul S,Visessanguan W. Protein hydrolysate of salted duck egg white as a substitute of phosphate and its effect on quality of pacific white shrimp(Litopenaeusvannamei)[J]. Journal of Food Science,2009,74(8):351361.
[10]余小领,周光宏,李学斌. 海藻酸钠被膜及其在食品加工中的应用[J]. 食品研究与开发,2009,30(9):181184.
[11]邹明辉. 无磷保水剂在凡纳滨对虾虾仁冻藏加工中的应用及保水机理研究[D]. 湛江:广东海洋大学,2011.
[12]Yamasaki Y,Yokose T,Nishikawa T,et al. Effects of alginate oligosaccharide mixtures on the growth and fatty acid composition of the green algaChlamydomonasreinhardtii[J]. Journal of Bioscience and Bioengineering,2012,113(1):112116.
[13]Falkeborg M,Cheong L Z,Gianfico C,et al. Alginate oligosaccharides:enzymatic preparation and antioxidant property evaluation[J]. Food Chemistry,2014,164(20):185194.
[14]Sanmartín E,Arboleya J C,Villamiel M,et al. Recent advances in the recovery and improvement of functional proteins from fish processing byproducts:use of protein glycation as an alternative method[J]. Comprehensive Reviews in Food Science and Food Safety,2009,8(4):332344.
[15]苏永玲,谢晶. 冻结和解冻过程对水产品品质的影响[J].食品工业科技,2011(1):304308.
[16]冉俊,李凤. 反复冻融对猪肉品质特性的影响[J]. 农业科技与信息,2012(8):2628.
[17]夏秀芳,孔保华,郭园园,等. 反复冷冻解冻对猪肉品质特性和微观结构的影响[J]. 中国农业科学,2009,42(3):982988.
[18]Lowry O H,Rosebrough N J,Farr A L,et al. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry,1951,193(1):265.
[19]蒙健宗,秦小明,赵文报,等. 海藻糖对冷冻罗非鱼片蛋白质变性作用的影响[J]. 食品工业科技,2007(2):214216.
[20]侯晓荣. 中国对虾的解冻方式研究和调理制品研制[D]. 杭州:浙江大学,2014.
[22]Leygonie C,Britz T J,Hoffman L C. Impact of freezing and thawing on the quality of meat:review[J]. Meat Science,2012,91(2):9398.
[23]Lee K Y,Mooney D J. Alginate:properties and biomedical applications[J]. Progress in Polymer Science,2012,37(1):106126.
[24]Okada. History of surimi technology in Japan[M]. New York:Marcel Dekker,Surimi technology. Inc. editor,LanierTC and LeeCM,1992:1321.
[25]Somjit K,Ruttanapornwareesakul Y,Hara K,et al. The cryoprotectant effect of shrimp chitin and shrimp chitin hydrolysate on denaturation and unfrozen water of lizardfish surimi during frozen storage[J]. Food Research International,2005,38(4):345355.
[26]Gonçalves A A,Ribeiro J L D. Optimization of the freezing process of red shrimp(Pleoticusmuelleri)previously treated with phosphates[J]. International Journal of Refrigeration,2008,31(7):11341144.
权威·核心·领先·实用·全面

