苹果生长素响应因子MdARF5的克隆与功能鉴定
安建平,宋来庆,赵玲玲,由春香,王小非,郝玉金
苹果生长素响应因子的克隆与功能鉴定
安建平1,宋来庆2,赵玲玲2,由春香1,王小非1,郝玉金1
(1山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东 泰安 271018;2烟台市农业科学研究院,山东 烟台 265599)
【】分离苹果生长素响应因子(Auxin Response Factor 5),分析其对生长素的响应,鉴定其在调节花青苷合成过程中的作用,揭示的生物学功能,为进一步研究生长素对花青苷的调节提供理论依据。【】以‘嘎拉’苹果(בRoyal Gala’)为材料,利用同源克隆技术,克隆得到一个ARF(Auxin Response Factor)转录因子,并将其命名为。利用MEGA5.0软件构建多物种间系统进化树。通过农杆菌介导的遗传转化获得转基因苹果愈伤组织。比较野生型和转基因苹果愈伤组织花青苷积累的差异。利用烟草叶片瞬时转化试验,分析对的转录调控。【】克隆获得苹果生长素响应因子(序列号:MDP0000143749),该基因CDS为2 691 bp,编码含有896个氨基酸的蛋白。系统进化树分析表明,苹果MdARF5与梨PbARF5同源性最高。基因表达分析显示,该基因响应生长素处理,并且与花青苷合成相关基因表现出相反的表达模式。在苹果愈伤组织中超表达,其花青苷积累较野生型显著降低,表明在调控花青苷积累过程中发挥重要作用。对苹果启动子序列进行分析,发现其序列包含一个的结合位点。烟草瞬时表达试验显示,能够抑制的表达。【】推测苹果可能通过直接抑制的表达负调节花青苷的积累。
苹果;生长素;ARF转录因子;花青苷
0 引言
【研究意义】生长素是一类重要的植物激素,参与植物生长发育的许多方面,涉及细胞分裂与伸长、形态建成、环境胁迫响应等[1-3]。然而,对生长素介导的花青苷积累研究较少。明确生长素调节花青苷的机理,对研究生长素信号途径和调节果树生长发育具有重要意义。【前人研究进展】自从生长素(吲哚乙酸)在20世纪30年代被首次发现以来,人们对生长素信号转导的分子机制已经进行了广泛研究。遗传分析和生理生化试验表明,TIR1(Transport Inhibitor Response 1)作为生长素受体感知生长素信号[4]。Aux/IAA阻遏蛋白能够与生长素响应因子相互作用,抑制其蛋白活性,进而负调节生长素信号[5]。此外,SCFTIR1泛素连接酶复合体在生长素信号途径中扮演核心调控者的角色,它能够通过泛素化降解Aux/IAA阻遏蛋白传递生长素信号[6-7]。当植物感受到生长素信号,TIR1蛋白复合体降解Aux/IAA阻遏蛋白,释放生长素响应因子,从而实现生长素介导的植物生长[8-9]。其中,ARF(auxin response factor)被鉴定为一类重要的生长素响应调控因子[10],ARF转录因子调节生长素响应基因的表达[5]。迄今为止,在拟南芥和水稻中分别鉴定了23和25个[11-12]。通过对ARF氨基酸序列进行比对分析,发现ARF蛋白都含有一个保守的DNA绑定结构域(DBD)和一个保守的羧基末端二聚化结构域(CTD)[13]。作为转录因子,ARF蛋白能够通过结合下游靶基因的AuxRE序列(TGTCTC/GAGACA)调节基因的表达,进而影响多种植物生长发育过程[14-15]。研究表明,转录因子参与植物多种发育过程。在拟南芥中,参与植物胚胎形成(、)[16]、根系生长(、、、)[17-18]、花器官发育(、、、)[19-20]及衰老过程(、)[21]。但水稻的功能不同于拟南芥,参与根系形成和种子萌发[22],影响植株对铁离子的吸收和积累[23]。最近的研究显示,调节叶片倾斜角度[24]。李慧峰等[25]对苹果ARF全基因组进行了初步分析。王意程等[26]研究发现,响应生长素处理,并且可能参与生长素介导的花青苷积累过程。【本研究切入点】作为多年生木本植物,苹果中关于转录因子的功能研究较少。【拟解决的关键问题】本试验从‘嘎拉’苹果中鉴定并分离一个苹果ARF基因,并通过转基因分析和烟草瞬时表达试验,揭示在调节苹果花青苷积累过程中的重要作用,为揭示转录因子调节花青苷积累提供理论基础。
1 材料与方法
试验于2017年3—8月在山东农业大学园艺科学与工程学院果树分子生物学实验室进行。
1.1 试验材料
试验所用的植物材料有苹果‘嘎拉’(Royal Gala)幼苗和‘王林’(Orin)苹果愈伤组织。
对长势一致的盆栽‘嘎拉’苹果幼苗用不同浓度的生长素(IAA)进行处理(0、2.5、5、7.5和10 µmol∙L-1)。溶液少量多次浇灌至完全浸透,处理6 h后取样,液氮速冻后保存备用。
‘王林’苹果愈伤组织用来进行遗传转化。苹果愈伤组织放置在继代培养基(MS培养基+1.5 mg·L-12,4-D+0.5 mg·L-16-BA)室温(24℃)、暗处培养。每隔15 d更新继代一次。
采用本氏烟草()进行瞬时表达试验。
1.2 基因克隆
根据在苹果(‘金冠’)参考基因组数据库中检索到的序列设计引物MdARF5-F/R(表1),以‘嘎拉’苹果幼苗的cDNA为模板进行PCR扩增。PCR反应程序为:94℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸2 min,34个循环;72℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳并回收目的条带,连接到克隆载体pMD18-T进行测序。所用的定量引物见表1。
1.3 RNA的提取与实时荧光定量PCR分析
苹果幼苗及愈伤组织的RNA提取采用天根生化科技有限公司的Plus植物总RNA提取试剂盒(DP437)。以提取的RNA为模板,按照Clontech SMARTTMLibrary试剂盒说明书进行反转录,合成cDNA第一链。以(GenBank accession number: CN938024)为内参基因,使用Ultra SYBR Mixture试剂盒(康为世纪)进行实时荧光定量PCR分析。荧光定量PCR使用的仪器为BIO-RAD IQ5,所有PCR都设3个循环。PCR反应体系:2×UltraSYBR Mixture 10.0 μL,cDNA 1.0 μL,加去离子水至20 μL。PCR反应程序:94℃预变性10 min,94℃变性15 s,56℃退火15 s,65℃延伸15 s,40个循环,每次循环第2步进行荧光采集。最后采用2-△△CT法进行定量数据分析。所用定量引物见表1。

表1 基因克隆和载体构建所用的引物序列
1.4 苹果愈伤组织转化和鉴定
构建-pCAMBIA-1300超表达载体,并将其转化农杆菌LBA4404。取15 d左右生长状态良好的苹果愈伤组织与转化的农杆菌室温孵育20—30 min。将愈伤组织用纱网过滤并吸干表面的菌液,置于继代培养基上培养1—2 d。随后,将苹果愈伤组织转移至筛选培养基(继代培养基+100 mg·L-1潮霉素+500 mg·L-1头孢霉素)。PCR检测得到的阳性转基因愈伤组织,在筛选培养基上继代3代以上,进行后续试验。
1.5 苹果愈伤组织着色试验
选择生长状态一致的野生型(WT)和转基因(-L1和-L2)苹果愈伤组织进行着色试验。将愈伤组织放置到持续强光(光子通量密度约为100 μmol·s-1·m-2)、低温(16℃)培养箱内进行培养,观察愈伤着色情况。
用花青苷提取液(95%无水乙醇+1.5 mol·L-1HCl)提取苹果愈伤组织内的花青苷[27]。提取过程在暗处进行。使用分光光度计(UV-1600,岛津公司,日本),在530、620和650 nm波长下检测样品吸光度并计算花青苷含量[27]。计算公式:OD=(A530-A620)-0.1×(A650-A620)。
1.6 烟草瞬时表达试验
本氏烟草叶片用来进行瞬时表达试验。的ORF序列连接到pGreenII 62-SK载体(- pGreen 62-SK)。结合位点序列连接pGreen 0800-LUC(-pGreen 0800-LUC)。活体成像系统被用来检测荧光强度。具体方法参照An等[27]。启动子序列及潜在NAC结合位点见图1。
1.7 统计学分析
使用R(3.0.2)软件进行统计学分析。每个试验至少重复3次,所有结果都是基于3个平行试验的平均值。
2 结果
2.1 苹果MdARF5的克隆及进化树分析
通过RT-PCR技术克隆获得一条大约2 500 bp的条带(图2)。对克隆得到的片段测序分析,结果显示,该基因片段的开放阅读框(ORF)长度为2 691 bp,编码一个含896个氨基酸的蛋白质。
将苹果MdARF5蛋白序列与拟南芥、梨、桃等8个不同物种的ARF5蛋白序列进行分析并构建进化树(图3)。进化树分析结果表明,苹果MdARF5与梨PbARF5亲缘关系最近,同源性最高。
2.2 生长素对MdARF5及花青苷合成相关基因的影响
实时荧光定量PCR分析对生长素的响应。结果显示,在不同浓度生长素素处理下(0、2.5、5、7.5和10 µmol∙L-1IAA),表达量显著上调(图4-A)。同时,花青苷合成相关基因(、、、、、)表达下调(图4-B)。

灰色标注表示潜在NAC结合位点

图2 苹果MdARF5RT-PCR扩增产物电泳
2.3 超表达MdARF5抑制花青苷积累
为了进一步研究的功能,构建- pCAMBIA-1300植物超表达载体(图5-A)。将重组超表达载体转化农杆菌LBA4404,通过农杆菌介导的遗传转化侵染苹果愈伤组织。定量PCR检测转基因株系表达量(图5-B)。获得L1和L2两个转基因株系。
对获得的转基因苹果愈伤组织进行强光、低温处理,10 d后,转基因苹果愈伤组织(- L1和-L2)比野生型愈伤积累的花青苷少(图4-C、D)。
实时荧光定量PCR检测花青苷合成基因的表达。结果显示,超表达明显抑制花青苷合成结构基因的表达(图4-E)。
2.4 MdARF5转录因子抑制MdMYB1的表达
利用PlantCARE软件(http://bioinformatics.psb. ugent.be/webtools/plantcare/html/)对启动子序列进行分析,发现其序列包含一个转录因子的潜在结合位点(图6-A、图1)。为了验证对的调控作用,构建-pGreen 62-SK和-pGreen 0800 LUC载体,并转化烟草叶片。如图6-B、C所示,由于自主激活作用,转化- pGreen 0800 LUC载体,叶片表现出较强的荧光强度。而同时转化-pGreen 62-SK和-pGreen 0800 LUC,叶片的荧光强度显著降低。这些结果说明,能够直接抑制的表达。
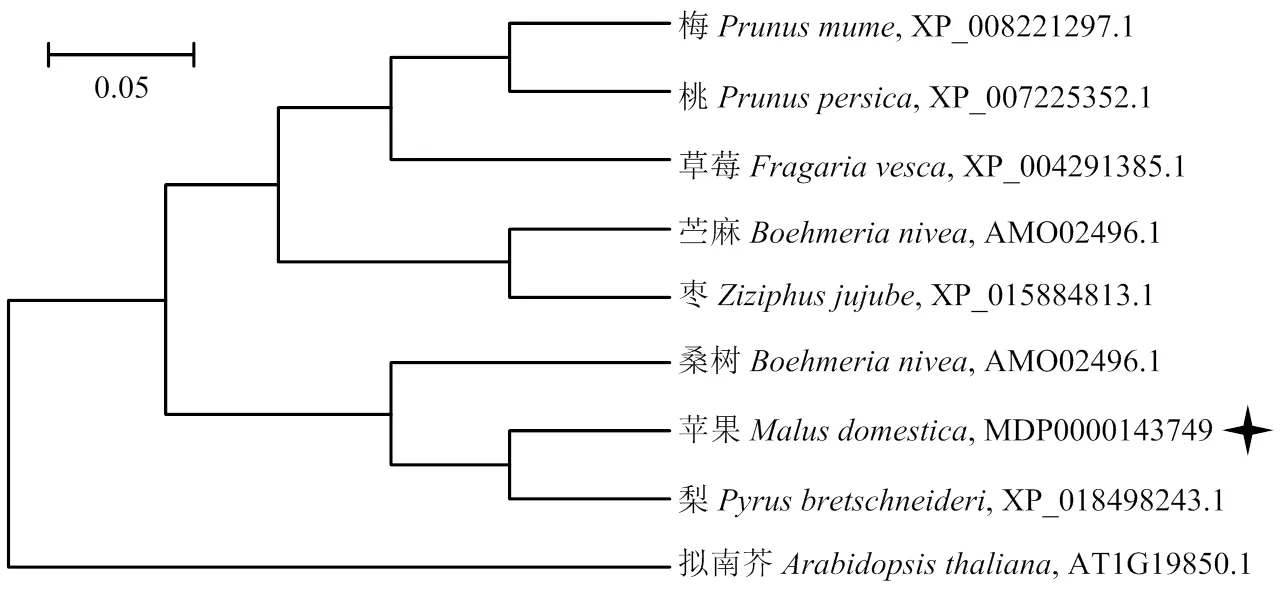
图3 苹果MdARF5及其同源基因的进化树分析

图4及花青苷合成相关基因对生长素的响应
Fig. 4 Analysis ofand anthocyanin biosynthesis genes expression in response to IAA
*差异显著(<0.05),**差异极显著(<0.01)。下同
* indicate significant difference (<0.05), ** indicate very significant difference (<0.01). The same as below
3 讨论
苹果()是世界上最重要的经济作物之一。中国苹果种植和产量常年居于世界前列[28]。通常红皮苹果更受人们欢迎[29],花青苷作为一种重要的次生代谢产物,有助于果皮的着色[30-32]。转录因子已经被鉴定能够通过激活花青苷合成相关基因的表达,促进花青苷的积累[33]。花青苷的生物合成受到多种植物激素信号的影响。其中,生长素在调节花青苷的生物合成过程中发挥重要作用[34]。虽然前人的研究已经表明,生长素抑制植物花青苷的合成[35-36],但是,生长素在调节花青苷积累过程中的作用及其潜在的分子机制还不清楚。本研究发现响应生长素处理,并且通过转基因技术验证了在苹果愈伤组织中超量表达抑制花青苷积累。
转录因子能够结合下游靶基因的AuxRE序列调节基因的表达[37]。通过对启动子序列进行分析[27],发现其序列包含一个转录因子的潜在结合位点。同时,烟草瞬时表达试验也验证了确实可以直接抑制的表达。后期将通过酵母双杂交试验(Y2H)和电泳凝胶迁移率试验(EMSA)[38],进一步验证MdARF5蛋白对启动子的结合。
4 结论
克隆获得苹果生长素响应因子基因,能够响应生长素处理。转基因苹果愈伤组织表现出抑制花青苷积累的表型。烟草瞬时转化试验表明直接抑制的表达。研究结果为深入研究转录因子调节植物花青苷积累提供了参考。

A:MdARF5-pCAMBIA-1300结构示意图;B:定量PCR分析MdARF5在转基因苹果愈伤组织L1和L2中的表达水平;C:野生型(WT)和转基因(MdARF5-L1和MdARF5-L2)苹果愈伤组织花青苷积累情况分析;D:检测花青苷含量;E:定量PCR检测花青苷合成基因的表达,其在WT中的表达量设定为1

A:图示MdMYB1启动子包含一个潜在的MdARF5的结合位点。B:烟草叶片瞬时表达试验。a:混合注射pGreen 62-SK和pGreen 0800 LUC菌液;b:混合注射pGreen 62-SK和MdMYB1-pGreen 0800 LUC菌液;c:混合注射MdARF5-pGreen 62-C:SK和MdMYB1-pGreen 0800 LUC菌液。C:相对发光强度,c的荧光强度设定为1
[1] MOCKAITIS K, ESTELLE M. Auxin receptors and plant development: A new signaling paradigm., 2008, 24: 55-80.
[2] VANNESTE S, RIML J. Auxin: a trigger for change in plant development., 2009, 136: 1005-1016.
[3] 任怡怡, 戴绍军, 刘炜. 生长素的运输及其在信号转导及植物发育中的作用. 生物技术通报, 2012, 3(4): 9-16.
REN Y Y, DAI S J, LIU W. Auxin transport and its roles in signal transduction and plant development., 2012, 3(4): 9-16. (in Chinese)
[4] DHARMASIRI N, DHARMASIRI S, ESTELLE M. The F-box protein TIR1 is an auxin receptor., 2005, 435: 441-445.
[5] LISCUM E, REED J W. Genetics of Aux/IAA and ARF action in plant growth and development., 2002, 49(3): 387-400.
[6] KEPINSKI S, LEYSER O. TheF-box protein TIR1 is an auxin receptor., 2005, 435: 446-451.
[7] QUINT M, GRAY W M. Auxin signaling., 2006, 9: 448-453.
[8] DHARMASIRI S, ESTELLE M. The role of regulated protein degradation in auxin response., 2002, 49: 401-408.
[9] WEIJERS D, FRIML J. SnapShot: auxin signaling and transport., 2009, 136: 1172-1172.
[10] 刘振华, 于延冲, 向凤宁. 生长素响应因子与植物的生长发育. 遗传, 2011, 33(12): 1335-1346.
LIU Z H, YU Y C, XIANG F N. Auxin response factors and plant growth and development., 2011, 33(12): 1335-1346. (in Chinese)
[11] GUILFOYLE T J, HAGEN G. Auxin response factors., 2007, 10: 453-460.
[12] WANG D, PEI K, FU Y, SUN Z, LI S, LIU H, TAO Y. Genome-wide analysis of the auxin response factors (ARF) gene family in rice ()., 2007, 394: 13-24.
[13] TIWARI S B, HAGEN G, GUILFOYLE T. The roles of auxin response factor domains in auxin-responsive transcription., 2003, 15: 533-543.
[14] ULMASOV T, HAGEN G, GUILFOYLE T J. Dimerization and DNA binding of auxin response factors., 1999, 19: 309-319.
[15] 梅梅, 王晓禹, 张晓林, 陆秀君. 植物生长素响应因子ARF研究进展. 种子, 2017, 36(1): 47-54.
MEI M, WANG X Y, ZHANG X L, LU X J. Advances in plant auxin response factors., 2017, 36(1): 47-54. (in Chinese)
[16] MALLORY A C, BARTEL D P, BARTEL B. MicroRNA-directed regulation ofauxin response factor17 is essential for proper development and modulates expression of early auxin response genes., 2005, 17: 1360-1375.
[17] OKUSHIMA Y, OVERVOORDE P J, ARIMA K, ALONSO J M, CHAN A, CHANG C, ECKER J R, HUGHES B, LUI A, NGUYEN D. Function genomic analysis of the auxin response factor gene family members in: unique and overlapping functions of ARF7 and ARF19., 2005, 17: 444-463.
[18] FUKAKI H, TASAKA M. Hormone interactions during lateral root formation., 2009, 69: 437-449.
[19] NAGPAL P, ELLIS C M, WEBER H, PLOENSE S E, BARKAWI L S, GUILFOYLE T J, HAGEN G, ALONSO J M, COHEN J D, FARMER E E. Auxin response factors ARF6 and ARF8 promote jasmonic acid production and flower maturation., 2005, 132: 4107-4118.
[20] FINET C, FOURQUIN C, VINAUGER M, BERNE-DEDIEU A, CHAMBRIER P, PAINDAVOINE S, SCUTT C P. Parallel structural evolution of auxin response factors in the angiosperms., 2010, 63: 952-959.
[21] ELLIS C M, NAGPAL P, YOUNG J C, HAGE G, GUILFOYLE T J, REED J W. AUXIN RESPONSE FACTOR1 and AUXIN RESPONSE FACTOR2 regulate senescence and floral organ abscission in., 2005, 132: 4563-4574.
[22] ATTIA K A, ABDELKHALIK A F, AMMAR M H, WEI C, YANG J, LIGHTFOOT D A, EL-SHEMY H A. Antisense phenotypes reveal a functional expression of OsARF1, an auxin response factor, in transgenic rice., 2009, 11: 129.
[23] QI Y, WANG S, SHEN C, ZHANG S, CHEN Y, XU Y, JIANG D. OsARF12, a transcription activator on auxin response gene, regulates root elongation and affects iron accumulation in rice ()., 2002, 193: 109-120.
[24] ZHANG S, WANG S, XU Y, YU C, SHEN C, QIAN Q, QI Y. The auxin response factor, OsARF19, controls rice leaf angles through positively regulating OsGH3 and OsBRI1., 2005, 38: 638-654.
[25] 李慧峰, 冉昆, 何平, 王海波, 常源升, 孙清荣, 程来亮, 李林光. 苹果生长素响应因子(ARF)基因家族全基因组鉴定及表达分析. 植物生理学报, 2015, 51(7): 1045-1054.
LI H F, RAN K, HE P, WANG H B, CHANG Y S, SUN Q R, CHENG L L, LI L G. Genome-wide identification and expression analysis of Auxin Response Factor (ARF) gene family in apple., 2015, 51(7): 1045-1054. (in Chinese)
[26] 王意程, 许海峰, 王楠, 姜生辉, 刘静轩, 王得云, 左卫芳, 陈学森. 红肉苹果愈伤组织生长素信号相关基因MdARF3的克隆与表达分析. 园艺学报, 2017, 44(4): 633-643.
WANG Y C, XU H F, WANG N, JIANG S H, LIU J X, WANG D Y, ZUO W F, CHEN X S. Molecular cloning and expression analysis of an auxin signaling related gene MdARF3 in red flesh apple., 2017, 44(4): 633-643. (in Chinese)
[27] AN J P, QU F J, YAO J F, WANG X N, YOU C X, WANG X F, HAO Y J. The bZIP transcription factor MdHY5 regulates anthocyanin accumulation and nitrate assimilation in apple., 2017, 4: 17023.
[28] 束怀瑞. 中国果树产业可持续发展战略研究. 落叶果树, 2012, 44(1): 1-4.
SHU H R. The sustainable development strategy research of fruit industry in China., 2012, 44(1): 1-4. (in Chinese)
[29] SAURE M C. External control of anthocyanin formation in apple., 1990, 42: 181-218
[30] 高华君, 王少敏, 王江勇. 套袋对苹果果皮花青苷合成及着色的影响. 果树学报, 2006(5): 750-755.
Gao H J, WANG, S M, WANG J Y. Effect of bagging on anthocyanin biosynthesis and pigmentation in apple skin., 2006(5): 750-755. (in Chinese)
[31] UBI, B E, HONDA C, BESSHO H, KONDO S, WADA M, KOBAYASHI S, MORIGUCHI T. Expression analysis of anthocyanin biosynthetic genes in apple skin: Effect of UV-B and temperature., 2006, 170: 571-578.
[32] BAN Y, HONDA C, HATSUYAMA Y, IGARASHI M, BESSHO H, MORIGUCHI T. Isolation and functional analysis of a MYB transcription factor gene that is a key regulator for the development of red coloration in apple skin., 2007, 48: 958-970.
[33] 杨玲, 王忆, 丛佩华, 张新忠, 韩振海. 光诱导转录因子MdMYB1对苹果果皮花青苷合成调控的表达分析. 农业生物技术学报, 2014, 22(4): 422-431.
YANG L, WANG Y, CONG P H, ZHANG X Z, HAN Z H. Expression analysis of the regulation of anthocyanin biosynthesis in apple peels by the transcription factor MdMYB1 under light-induced., 2014, 22(4): 422-431.
[34] 于海涛, 霍俊伟, 吕其涛, 李兴国. 植物激素对果实花青苷合成的影响. 北方园艺, 2003(4): 56-57.
YU H T, HUO J W, LV Q T, LI X G. Effect of plant hormones on fruit anthocyanin biosynthesis,, 2003(4): 56-57. (in Chinese)
[35] NARAYAN M S, THIMMARAJU R, BHAGYALAKSHMI N. Interplay of growth regulators during solid-state and liquid-state batch cultivation of anthocyanin producing cell line of., 2005, 40: 351-358.
[36] SHI M Z, XIE D Y. Engineering of red cells ofand comparative genome-wide gene expression analysis of red cells versus wild-type cells., 2011, 233: 787-805.
[37] ULMASOV T, HAGEN G, GUILFOYLE T J. Dimerization and DNA binding of auxin response factors., 1999, 19: 309-319.
[38] 安建平, 宋来庆, 赵玲玲, 由春香, 王小非, 郝玉金. 超表达苹果细胞分裂素响应基因影响花青苷积累和盐胁迫抗性. 中国农业科学, 2017, 50(16): 3196-3204.
AN J P, SONG L Q, ZHAO L L, YOU C X, WANG X F, HAO Y J. Effects of overexpression of apple cytokinin response factor geneon anthocyanins accumulation and salt stress tolerance., 2017, 50(16): 3196-3204.
(责任编辑 赵伶俐)
Cloning and Functional Characterization of an Auxin Response Factor Gene
AN JianPing1, SONG LaiQing2, ZHAO LingLing2, YOU ChunXiang1, WANG XiaoFei1, HAO YuJin1
(1College of Horticulture Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology, Tai’an271018, Shandong;2)
【】The objective of this study is to isolate an apple auxin response factor gene, to analyze its expression of exposing to auxin, to identify its role in regulating anthocyanin biosynthesis, then to reveal its biological functions and to provide a theoretical basis for auxin-mediated anthocyanin accumulation. 【】The apple auxin response factor genewas cloned by PCR technology from apple (בRoyal Gala’). The phylogenetic tree was constructed by MEGA 5.0 software. The transgenic apple calli were generated via-mediated transformation. The differences in the anthocyanin accumulation were compared between wild-type and transgenic apple calli. The transient expression assays in tobacco leaves were carried out to test the transcriptional regulation ofgene by. 【】gene (MDP0000143749) was obtained. The open reading frame (ORF) ofcontained 2 691 bp, encoding a protein of 896 amino acid residues. Phylogenetic tree analysis showed that the homology of MdARF5 was close to the PbARF5. The transcriptional analysis results indicated thatwas induced by auxin treatment. On the contrary, the expression levels of anthocyanin biosynthesis genes were repressed. The-overexpressing apple calli exhibited decreased anthocyanin content, suggesting thatgene might play an important role in regulating anthocyanin accumulation. The sequence ofpromoter region was analyzed and a putative ARF binding motif was found. Meanwhile, the transient expression assays were performed inleaves and the results showed that MdARF5 could repress the expression of. 【】It is speculated that MdARF5 down-regulates anthocyanin accumulation by directly repressing the transcript of.
apple; auxin; ARF transcription factor; anthocyanin
2017-08-13;
2017-10-13
国家自然科学基金(31601742)、教育部创新团队支持计划(IRT15R42)、山东省现代农业产业技术体系(SDAIT-06-03)
安建平,E-mail:1393427413@qq.com。宋来庆,E-mail:slq_zh@163.com。安建平和宋来庆为同等贡献作者。
郝玉金,E-mail:haoyujin@sdau.edu.cn。通信作者王小非,E-mail:xfwang2004@163.com

